肥胖对外周血白细胞胆固醇逆转运相关基因表达的影响
2016-09-11张苗苗仝其广毛雯吴迪
张苗苗 仝其广 毛雯 吴迪
临床研究
肥胖对外周血白细胞胆固醇逆转运相关基因表达的影响
张苗苗 仝其广 毛雯 吴迪
目的 研究肥胖者外周血白细胞胆固醇逆转运相关基因表达的情况。方法 采用实时荧光定量PCR方法,测定肥胖组和对照组外周血白细胞胆固醇逆转运相关基因ABCA1、ABCG1和ApoA1 mRNA表达水平。结果 肥胖组ABCG1mRNA表达水平较对照组显著降低(0.536±0.271比6.243±1.511,P<0.05),ApoA1mRNA表达水平较对照组升高(0.385±0.188比 0.206±0.062,P<0.05)。单因素相关分析显示,ABCG1mRNA表达与体重指数BMI呈负相关(r=-0.403,P=0.012)。多元线性回归分析提示,ABCG1mRNA表达与体重指数BMI呈独立相关性(β=-0.488,P=0.004)。结论 肥胖者外周血白细胞ABCG1mRNA表达下调,且ABCG1mRNA与体重指数BMI呈负相关,这可能是肥胖导致动脉粥样硬化发生、发展的机制之一。
肥胖; 体重指数; 胆固醇逆转运基因; ATP结合盒转运体G1
随着生活水平的提高,肥胖患者越来越多。肥胖是导致动脉粥样硬化包括冠状动脉粥样硬化性心脏病的危险因素之一。胆固醇逆转运是机体拮抗动脉粥样硬化的主要防御机制之一。机体通过胆固醇逆向转运将外周细胞胆固醇转运回到肝脏,促进其经胆道排泄,从而拮抗动脉粥样硬化发生[1,2]。胆固醇逆转运是机体排除过多胆固醇的唯一途径,受到人们的关注。ATP结合盒转运体A1(ATP binding cassettetransporter A1,ABCA1)和 ATP 结合盒转运体 G1(ATP binding cassette transporter G1,ABCG1)是一类膜蛋白,它们通过相互独立的机制参与胆固醇逆转运,避免外周细胞胆固醇严重沉积[3,4],因此成为研究抑制动脉粥样硬化发展的重要靶点。那么,肥胖者外周血白细胞胆固醇逆转运相关基因表达情况如何,目前尚无相关报道。本研究旨在探讨肥胖对外周血白细胞胆固醇逆转运相关基因表达的影响。
1 对象与方法
1.1 研究对象 选择2013年3~5月在煤炭总医院心内科就诊或住院肥胖患者18例,其中男性10例、女性 8例,平均年龄(64.33±11.89)岁;对照组(BMI<25 kg/m2)20例,其中男性11例、女性9例,平均年龄(65.80±12.08)岁。体重指数(BMI,body mass index)=体重(kg)/身高(m)2。肥胖诊断标准:符合2000年《亚太区肥胖的重新定义和处理》指导性手册的肥胖标准[5],即BMI≥25 kg/m2。排除糖尿病、急性冠脉综合征、脑卒中、入院前1个月内服用他汀或其他降脂药物、心力衰竭、严重肝肾功能损害、血液病、甲状腺疾病、肿瘤及绝经后妇女用激素替代治疗。患者均知晓本试验并签署同意协议。
1.2 研究方法
1.2.1 血清学指标测定 清晨取空腹12 h以上静脉血,分离血清,测定血脂、血糖、血清肌酐、尿素氮和肝功能等生化指标,均由贝克曼AU2700全自动生化分析仪自动检测。试剂由日本第一化学药品株式会社、北京中生北控有限公司和德赛公司提供。
1.2.2 外周血白细胞 ABCA1、ABCG1和 ApoAI mRNA表达测定RNA提取 清晨取空腹静脉血2 ml置入EDTA抗凝管内,1500 rpm离心12 min,弃去血浆,分离出血细胞,加入RNA保存液中,-80℃冰箱保存,1周内按照试剂盒说明书提取外周血白细胞RNA。检测所有标本RNA纯度、浓度和完整性。基因表达:白细胞总RNA逆转录成cDNA。逆转录体系(20 μl体 系):RNA 3 μl,5×Buffer 4 μl,dNTP 1 μl,Oligo(dT)1 μl,逆转录酶 0.5 μl,DEPC H2O 10.5 μl。逆转录程序:42 ℃保温 60 min。95 ℃5 min,4℃ 5min,迅速放入-20℃长期冻存。荧光定量PCR反应体系为25 μl含:基因组cDNA 2 μl,上游和下游引物分别为5 pmol,dNTPmix 5 nmol,Taq酶1 U,Taq酶缓冲液2.5 μl及灭菌去离子水适量,应用自动循环仪进行扩增。扩增条件为:预变性94℃ 5 min。反应循环为:变性 94℃ 30 s、退火61℃ 30 s、延伸72℃ 30 s,循环 35次;最后72℃延伸10 min。基因mRNA表达以 β-actin标化。βactin 上游引物:5′-TCCTTCT GCATCCTGTCGGCA-3′,下游引物:5′-CAA GAGATGGCCACGGCTGCT-3′。ApoA1 基因上游引物:5′-CCGCCGTTCTCCTTGAGAG-3′, 下 游 引 物 :5′-AGAAGAAGT GGCAGGAGGAGATG-3′。ABCA1基因上游引物:5′-GGCT GTGTCTCGTATTGTCTG-3′,下游引物:5′-CCTTGTGGCTGGAGTGTCA-3′。ABCG1 上游引物:5′-AGAAAGACTTTG AAAGAGTT-3′,下游 引物:5′-GGTAAATCACATACTTTGTT-3′。RNA 提取和引物合成以及荧光定量PCR均由北京鼎国昌盛生物技术有限责任公司负责完成。
1.3 统计学方法 所有数据用SPSS 20.0软件进行统计分析。计量资料以±s表示,正态分布数据两组间比较采用t检验,多组间比较采用方差分析;非正态分布数据采用非参数检验。计数资料应用例数(百分比)表示,组间比较采用χ2检验。参数间相关分析采用Pearson相关分析,线性回归用于参数独立相关分析。P<0.05为差异有统计学意义。
2 结果
2.1 一般临床资料比较 研究选择肥胖者18例,对照组20例。两组基础资料比较显示,肥胖组饮酒比例明显高于对照组(P<0.05),两组之间其他基线资料如年龄、性别、高血压、冠心病与吸烟比例基本平衡。见表1。
2.2 肥胖组与对照组临床生化指标比较 与对照组相比,肥胖组 ApoB 明显升高[(1.00±0.35)g/L比(0.76±0.31)g/L,P<0.05],丙氨酸转氨酶(ALT)及空腹血糖(BS)也明显升高[(26.39±13.92)U/L 比(16.00±10.88)U/L,(6.48±1.70)mmol/L 比 (5.54±0.85)mmol/L,P<0.05]。其他生化指标两组间未见统计学差异。见表2。
2.3 肥胖对外周血白细胞胆固醇逆转运基因mRNA表达的影响 ABCA1基因mRNA表达水平在肥胖组与对照组之间无明显差异(1.264±0.549比 0.245±0.0783,P>0.05);与对照组相比,肥胖组ABCG1基因mRNA表达明显降低(6.243±1.511比0.536±0.271,P<0.05),ApoA1mRNA 表达水平升高(0.206±0.062 比 0.385±0.188,P<0.05)。
2.4 肥胖患者胆固醇逆转运基因mRNA表达相关性分析 单因素相关分析显示,ABCG1 mRNA表达与 BMI呈负相关(r=-0.403,P=0.012),APOA1 mRNA表达与 BMI呈正相关(r=0.38,P=0.019),ABCA1表达与BMI无明显相关性(r=0.275,P=0.095)。多元线性回归分析提示,ABCG1 mRNA表达与 BMI呈独立相关性 (β=-0.488,P=0.004),APOA1 mRNA表达与 BMI无独立相关性(β=0.041,P=0.104)。
3 讨论
胆固醇逆转运是将外周细胞胆固醇转运到载脂蛋白 A-I(apolipoprotein A-I,ApoA-I)和高密度脂蛋白(high density lipoprotein,HDL)上,并将胆固醇转移至肝胆管,经肝胆管流入肠道,最后随粪便排出体外[1,2]。胆固醇逆转运对维持生物体胆固醇代谢稳态有着重大意义,也是目前认为机体对抗动脉粥样硬化发生的主要机制之一。ABCA1和ABCG1是ATP结合盒转运体(ATP bindingcassette transporter,ABC)超家族中的一员,通过消耗ATP介导蛋白质、胆固醇、磷脂等多种物质的跨膜转运。在胆固醇逆转运中,ABCA1主要负责促进胆固醇从细胞流出到载脂蛋白A-I,ABCG1主要负责促进胆固醇流出到成熟高密度脂蛋白(high density lipoprotein,HDL)上,同时两者也存在相互作用从而联合促进胆固醇逆转运[6]。
表1 肥胖组与对照组一般临床资料比较(±s)

表1 肥胖组与对照组一般临床资料比较(±s)
注:与对照组比较,aP<0.05
组别 例数 年龄(岁) 男/女 饮酒(%) 高血压(%) 冠心病(%) 吸烟(%)对照组 20 64.33±11.89 10/8 0.0 55.6 83.3 44.4肥胖组 18 65.80±12.08 11/9 30.0a55.0 55.0 30.0
表2 肥胖组与对照组生化指标比较(±s)
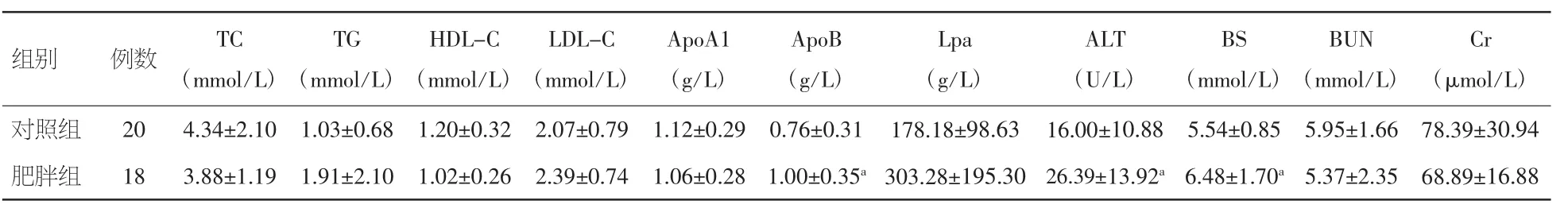
表2 肥胖组与对照组生化指标比较(±s)
注:TC:胆固醇;TG:甘油三酯;HDL-C:高密度脂蛋白胆固醇;LDL-C:低密度脂蛋白胆固醇;ApoA1:载脂蛋白 A1;ApoB:载脂蛋白 B;Lpa:脂蛋白 a;ALT:丙氨酸转氨酶;BS:空腹血糖;BUN:尿素氮;Cr:肌酐。与对照组比较,aP<0.05
组别 例数 TC(mmol/L)Cr(μmol/L)对照组 20 4.34±2.10 1.03±0.68 1.20±0.32 2.07±0.79 1.12±0.29 0.76±0.31 178.18±98.63 16.00±10.88 5.54±0.85 5.95±1.66 78.39±30.94肥胖组 18 3.88±1.19 1.91±2.10 1.02±0.26 2.39±0.74 1.06±0.28 1.00±0.35a303.28±195.30 26.39±13.92a6.48±1.70a5.37±2.35 68.89±16.88 TG(mmol/L)HDL-C(mmol/L)LDL-C(mmol/L)ApoA1(g/L)ApoB(g/L)Lpa(g/L)ALT(U/L)BS(mmol/L)BUN(mmol/L)
对ABCG1转基因鼠,靶向阻断ABCG1导致中性脂质在肝脏、肺、外周组织巨噬细胞的聚积,而ABCG1转基因动物则不产生高脂饮食引起的脂质聚积[4]。由此可见,ABCG1通过参与胆固醇代谢平衡的调节,减少外周细胞胆固醇严重沉积,进而阻止动脉粥样硬化的发生和发展。该基因的正常表达降低,胆固醇过多积聚于血管壁的巨噬细胞会促使泡沫细胞形成,从而导致动脉粥样硬化形成。本研究中肥胖患者外周血白细胞ABCG1 mRNA表达下调,提示可能通过抑制胆固醇的逆转运导致外周细胞胆固醇沉积,促进动脉粥样硬化的发生。
那么,引起ABCG1 mRNA下调的具体机制如何呢?黄嘌呤氧化还原酶(Xanthine oxidoreductase,XOR)是人体内尿酸生成的限速酶,通过将嘌呤分解为尿酸,控制着人体内嘌呤的代谢。肥胖小鼠脂肪组织中XOR mRNA的浓度均增加[7],XOR还通过调节尿酸代谢在肥胖的发生、发展过程中起重要作用[8];敲除XOR基因后J774.1细胞ABCG1表达增加,而XOR过表达会抑制ABCG1的表达,促进巨噬细胞源性泡沫细胞的形成[9]。因此提示肥胖可能通过XOR过表达抑制ABCG1 mRNA的表达,参与动脉粥样硬化的发生。脂联素(Adiponectin,APN)是由脂肪组织产生的脂肪细胞因子,具有改善胰岛素抵抗、抗炎、抗动脉粥样硬化等作用[10]。提高APN的水平能够明显增加动脉壁中胆固醇流出基因ABCG1的表达,有效促进胆固醇逆转运[11]。APN介导的PPARα激活可以诱导LXR的靶基因ABCG1的激活[11]。皮下和内脏脂肪组织中的APN水平与肥胖呈负相关[12]。提示肥胖患者的APN水平降低,可能抑制ABCG1的表达。此外,血尿酸水平与体重指数呈正相关[13]。肥胖患者尿酸升高亦可能降低APN mRNA水平,伴随着APN的生成下降。因此推测肥胖者ABCG1表达下降可能与APN水平下降有关。高血糖可抑制人巨噬细胞ABCG1蛋白表达[14]。本研究肥胖组血糖水平较对照组升高,提示此可能与高血糖有关。此外,代谢综合征的代谢产物能通过抑制ABCG1的胆固醇逆向转运功能促进动脉粥样硬化的形成[14]。肥胖属于代谢综合征诸多症候群的一种,其代谢产物亦有可能通过抑制ABCG1的表达参与动脉粥样硬化的发生。
本研究发现,肥胖患者外周血白细胞ApoA1 mRNA表达较对照组升高,而血清HDL-C和ApoA1两组间无明显差异,提示外周血白细胞ApoA1 mRNA基因表达并没有影响抗动脉粥样硬化脂蛋白的血清水平。ApoA1是HDL的主要载脂蛋白,血清ApoA1可反映HDL水平,与HDL-C呈明显正相关;ApoA1浓度与CHD发生危险性呈负相关。ApoA1主要来源于两个方面[15]:由肝细胞和小肠上皮细胞合成与分泌,也可由成熟HDL分解代谢而来,并在转录和转录后水平进行调节。肝细胞ABCA1等基因表达对血清HDL-C水平具有决定性作用,而不受外周血细胞基因表达的影响[16,17]。所以,外周血白细胞ApoA1 mRNA基因表达并未影响血清HDL-C和ApoA1水平。
正常情况下,每一个 LDL、IDL、VLDL 和 Lp(a)颗粒中均含有一分子ApoB,因LDL颗粒占绝大多数,大约90%的ApoB分布在LDL中。血清ApoB主要反映LDL水平,它与血清LDL-C水平呈明显正相关,而总ApoB含量反映了可能的致动脉粥样硬化脂蛋白的总量。本研究肥胖患者血清ApoB升高,而LDL-C浓度并未升高,提示血液中存在较多小而致密的LDL。ApoB与各项心血管危险因素均显著相关[18],血清ApoB浓度升高与CHD发生危险性呈明显正相关[19,20],提示肥胖患者ApoB升高,可能与其发生冠心病的风险增高有关。此外,本研究中肥胖组丙氨酸转氨酶升高,可能与肥胖引起肝脏脂肪沉积产生肝毒性脂肪酸有关[21]。
肥胖是动脉粥样硬化的危险因素之一。本研究中肥胖患者胆固醇逆转录基因ABCG1 mRNA表达下调,提示胆固醇逆转运降低,推测此可能为肥胖患者细胞内胆固醇聚集,发生动脉粥样硬化的机制之一;同时肥胖患者血糖升高及血清ApoB升高,亦可能参与了动脉粥样硬化的发生及发展。但具体调节机制尚需进一步研究。
[1]Lawn RM,Wade DP,Couse TL,et al.Localization of human atp-binding cassette transporter1 (abc1) in normaland atherosclerotic tissues.Arterioscler Thromb Vase Biol,2001,21:378-385.
[2]Akiyama TE,Sakai S,Lambert G,et al.Conditional disruption of the peroxisome proliferator-activated receptor gamma gene in mice results in lowered expression of abca1,abcg1,and apoe in macrophages and reduced cholesterol efflux.Mol Cell Biol,2002,22:2607-2619.
[3]Oram JF,Heinecke JW.ATP-binding cassette transporter AI:a cell cholesterol exporter that protects against cardiovascular disease.Physiol Rev,2005,85:1343-1372.
[4]Kennedy MA,Barrera GC,Nakamura K,et al.ABCGl has a critical role in mediating cholesterol efflux to HDL and preventing cellular lipid accumulation.Cell Metab,2005,1:121-131.
[5]李洋,傅华.肥胖的重新定义和处理.上海预防医学杂志,2001,13:161-162.
[6]Lorkowski S,Rust S,Engel T,et al.Genomic sequence and structure of the human abcg1(abc8)gene.Biochem Biophys Res Commun.2001,280:121-131.
[7]Cheung KJ,Tzameli I,Pissios P,et al.Xanthine oxidoreductase is a regulator of adipogenesis and PPARgamma activity.Cell Metab,2007,5:115-128.
[8]Sautin YY,Nakagawa T,Zharikov S,et al.Adverse effects of the classic antioxidant uric acid in adipocytes:NADPH oxidasemediated oxidative/nitrosative stress.Am J Physiol Cell Physiol,2007,293:C584-596.
[9]Kushiyama A,Okubo H,Sakoda H,et al.Xanthine oxidoreductase is involved in macrophage foam cellformation and atherosclerosisdevelopment.ArteriosclerThromb Vasc Biol,2012,32:291-298.
[10]赵宏字,郑强,张锦.球状脂联素上调脂联索受体抑制晚期糖基化终产物诱导人跻静脉内皮细胞凋亡的初步研究.中国病理生理杂志,2010,26:690-694.
[11]van Stijn CM,Kim J,Barish GD,et al.Adiponectin expression protects against angiotensin Ⅱ-mediated inflammation and accelerated atherosclerosis.PLoS One,2014,9:e86404.
[12]Nannipieri M,Bonotti A,Anselmino M,et al.Pattern of expression of adiponectin receptors in human adipose tissue depots and its relation to the metabolic state.Int J Obes,2007,31:1843-1848.
[13] Alberti KG,Zimmet P,Shaw J,et al.The metabolic syndrome——a newworld-widedefinition.Lancet,2005,366:1059-1062.
[14]Mauerer R,Ebert S,Langmann T.High glucose,unsaturated and saturated fatty acids differentially regulate expression of ATP-binding cassette transporters ABCA1 and ABCG1 in human macrophages.Exp Mol Med,2009,41:126-132.
[15]Zhang B,Saku K,Ohta T.In vivo metabolism of HDL,apoAI,and lp A-I,and function of HDL-a clinical perspective.J Atheroscler Thromb,2000,7:59-66.
[16]Timmins JM,Lee JY,Boudyguina E,et al.Targeted inactivation of hepatic Abca1 causes profound hypoalphalipoproteinemia and kidney hypercatabolism ofapoA-I.J Clin Invest,2005,115:1333-1342.
[17]Haghpassand M,Bourassa PA,Francone OL,et al.Monocyte/macrophage expression of ABCA1 has minimal contribution to plasma HDL levels.J Clin Invest,2001,108:1315-1320.
[18]Williams K,Sniderman AD,Sattar N,et al.Comparison of the associations of apolipoprotein B and low-density lipoprotein cholesterol with other cardiovascular risk factors in the Insulin Resistance Atherosclerosis Study(IRAS).Circulation,2003,108:2312-2316.
[19]Pischon T,Girman CJ,Sacks FM,et al.Non-high-density lipoprotein cholesterol and apo-lipoprotein B in the prediction of coronary heart disease in men.Circulation,2005,112:3375-3383.
[20]Walldius G,Jungner I,Holme I,et al.High apolipoprotein B,low apolipoprotein A-I,and improvement in the prediction of fatal myocardial infarction (AMORIS study):a prospective study.Lancet,2001,358:2026-2033.
[21]Falck-Ytter Y,Younossi ZM,Marchesini G,et al.Clinical features and natural history of nonalcoholic steatosis syndromes.Semin Liver Dis,2001,21:17-26.
Effects of obesity on the expression of reverse cholesterol transport genes in peripheral blood leukocytes
ZHANG Miao-miao,TONG Qi-guang,MAO Wen,et al.Cardiovascular Department,China Meitan General Hospital,Beijing 100028,China
Objective To study the expressions of reverse cholesterol transport genes in peripheral blood leukocytes in obese patients.Methods The expressions of peripheral blood leukocytes ATP binding cassette transporter A1(ABCA1),ATP binding cassette transporter G1(ABCG1) and apolipoprotein A1(ApoA1) mRNA in obesity group and control group were measured by real-time quantitative PCR(RT-PCR).Results Compared with control group,ABCG1 mRNA expression decreased (0.536±0.271 vs 6.243±1.511,P<0.05) and ApoA1 mRNA expression increased (0.385±0.188 vs 0.206±0.062,P<0.05)in obesity group.Single factor correlation analysis showed that the expression of ABCG1 mRNA was negatively correlated with body mass index(BMI)(r=-0.403,P=0.012).Using multivariant linear regression analysis method,it was shown that the expression of ABCG1 mRNA was dependently associated with obesity (β=-0.488,P=0.004).Conclusion The expression of ABCG1 mRNA in peripheral blood leukocytes was decreased in obesity group and was negatively correlated with BMI,which may be one of the mechanisms that obesity results in atherosclerosis.
Obesity; BMI; Reverse cholesterol transport genes; ATP binding cassette transporter G1
100028 北京市,煤炭总医院心血管内科
10.3969/j.issn.1672-5301.2016.06.007
R541.4
A
1672-5301(2016)06-0507-05
2016-01-28)
