晚期胃癌应用中药辅助胃癌根治术加化疗的疗效观察及对生活质量的影响
2016-09-09李拥军蔡正斌张雪琴
李拥军 蔡正斌 邓 飞 张雪琴
晚期胃癌应用中药辅助胃癌根治术加化疗的疗效观察及对生活质量的影响
李拥军蔡正斌邓飞张雪琴
目的探讨晚期胃癌患者应用中药辅助胃癌根治加化疗治疗的临床疗效以及对患者生活质量的影响。方法选取2014年1月至2015年6月收入医院治疗的60例晚期胃癌患者为研究对象,根据治疗方法的不同分为对照组与观察组,每组30例。两组均采取D2根治性切除术联合XELOX辅助化疗,观察组在此基础上增加扶正清解方治疗,采用Karnofsky功能状态评分评价治疗后症状改善情况,比较两组毒副反应发生情况、免疫功能与生活质量。结果观察组治疗效果明显优于对照组;观察组QOL评分高于对照组;观察组出现骨髓抑制、肝功能损害与肾功能损害的例数明显少于对照组;两组治疗后CD3+与CD4+值均较治疗前提高,且观察组治疗后CD3+与CD4+值高于对照组,上述差异均具有统计学意义(P<0.05)。结论在胃癌根治术联合化疗的基础上,增加扶正清解方辅助治疗不但能够缓解患者的临床症状,提高患者机体免疫力,而且还可降低毒副反应发生率,可提高患者生活质量,安全性较高,值得临床推广并应用。
胃癌根治术;扶正清解方;晚期胃癌;生活质量
随着生活水平的提高,人们的饮食结构发生了变化,加上吸烟饮酒等不良习惯,我国胃癌发病率呈逐年上升趋势,且大多数胃癌患者被确诊时已处于进展期。目前手术切除联合化疗是临床治疗胃癌的主要方法,手术切除以D2根治性切除术较为常用,而化疗主要起到消除术后小的转移病灶,防止肿瘤复发的作用[1]。扶正清解方具有改善免疫功能,抑制肿瘤细胞生长的功效,将其应用于胃癌的治疗中十分合适。基于此,笔者以我院60例晚期胃癌患者为研究对象,在胃癌根治术与化疗的基础上,对其中30例患者增加扶正清解方治疗,取得较好效果,现报道如下。
资料与方法
一、一般资料
选取2014年1月至2015年6月收入医院治疗的60例晚期胃癌患者为研究对象,根据采取治疗方法的不同分为对照组与观察组,各30例。对照组男性18例,女性12例;年龄41~75岁,平均年龄(60.8±5.4)岁;肿瘤部位:位于胃底12例、胃体10例、胃窦8例;病理分型:腺癌25例、细胞癌3例、混合型2例;组织学类型:高分化17例、中分化8例、低分化5例。观察组男性17例,女性13例;年龄39~76岁,平均年龄(62.4±5.2)岁;肿瘤部位:位于胃底13例、胃体9例、胃窦8例;病理分型:腺癌24例、细胞癌5例、混合型1例;组织学类型:高分化18例、中分化9例、低分化3例。两组性别、年龄、肿瘤部位等临床资料比较,差异无统计学意义(P>0.05),具有可比性。
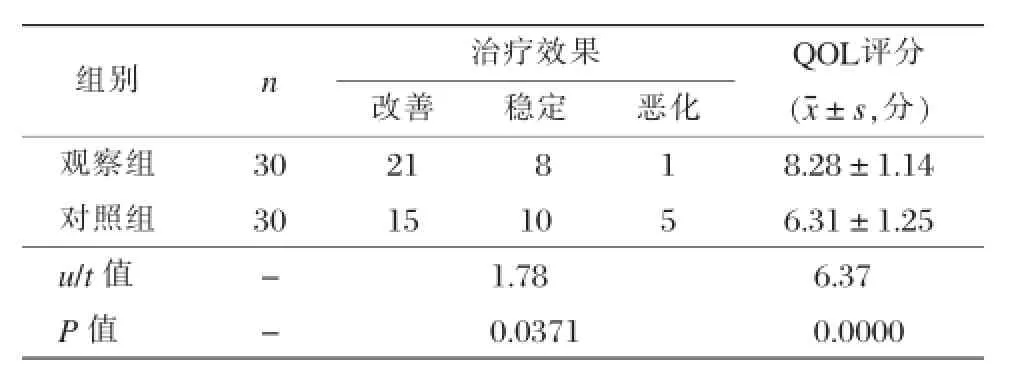
表1 两组治疗效果与QOL评分比较
二、纳入排除标准
诊断标准:2012中国肿瘤登记年报[2]中关于胃癌的诊断标准。纳入标准:①经病理确诊为晚期胃癌;②对D2根治性切除术耐受者;③对此次研究知情,签署知情同意书并能够积极配合者;④生存期至少3个月。排除标准[3]:①合并有严重原发性疾病或精神障碍患者;②准备妊娠或处于哺乳期的患者;③既往有器官移植史或长期进行全身类固醇治疗的患者;④对研究不配合的患者。
三、治疗方法
两组均实施D2根治性切除术治疗,术后给予XELOX辅助化疗,给药方案与时间安排:奥沙利铂(江苏奥赛康药业股份有限公司生产;国药准字H20064297)130 mg/m2,第1天静脉滴注3 h;卡培他滨(上海罗氏制药有限公司生产;国药准字J20080101)1 000 mg/m2,口服,2次/d,第1~14天。上述方案每3周重复1次,至少持续化疗2个周期。观察组在此基础上增加扶正清解方治疗,组方:黄芪与板蓝根各60 g,淫羊藿30 g,白术、大黄与肉豆蔻各20 g,加水500 mL煎服,每日1剂,分2次服用,持续用药14 d。
四、观察指标与判定标准
治疗效果:采用Karnofsky功能状态评分[4]评价治疗效果,治疗后较治疗前Karnofsky评分提高>10分则判定为改善,无变化则判定为稳定,下降>10分则判定为恶化;生存质量:采用生活质量总体评分量表[5](QOL)评价治疗结束后3个月患者的生活质量,评价内容包括日常生活、活动、健康、精神与支持5方面,总分值为10分,分值越高生活质量越高;毒副反应:包括骨髓抑制、肝与肾功能损害;免疫功能:通过检测CD3+与CD4+值评价免疫功能,CD3+与CD4+值越高则免疫功能越高。具体方法是:使用蓝宝石Sapphire全自动五分类血液分析仪(购自美国雅培公司)及该公司的CD3+、CD4+单克隆细胞检测自动化方案全线产品。在手术前抽取患者2 mL静脉血,用乙二胺四乙酸(EDTA)抗凝,把血常规管放置在专用的管架上,然后放含有单克隆抗体的CD3+、CD4+专用管子。选择仪器的专用程序,仪器开始自动检测标本。15 min后,包括血常规、CD3+、CD4+的多项指标以及图谱都会在计算机中出现。
五、统计学处理
利用SPSS 19.0软件对所有数据进行处理。计量资料以x±s表示,采用t检验;计数资料以%表示,釆用χ2检验。偏态分布的数据表示为中位数,组间比较运用独立样本非参数检验,P<0.05为差异有统计学意义。
结果
一、两组治疗效果与QOL评分比较
观察组治疗效果明显优于对照组;观察组QOL评分高于对照组,上述差异均具有统计学意义(P<0.05),见表1。
二、两组毒副反应比较
观察组出现骨髓抑制、肝功能损害与肾功能损害的患者例数明显少于对照组,差异具有统计学意义(P<0.05),见表2。
三、两组治疗前后免疫功能比较
两组治疗后CD3+与CD4+值均较治疗前提高,且观察组治疗后CD3+与CD4+值高于对照组,差异具有统计学意义(P<0.05),见表3。
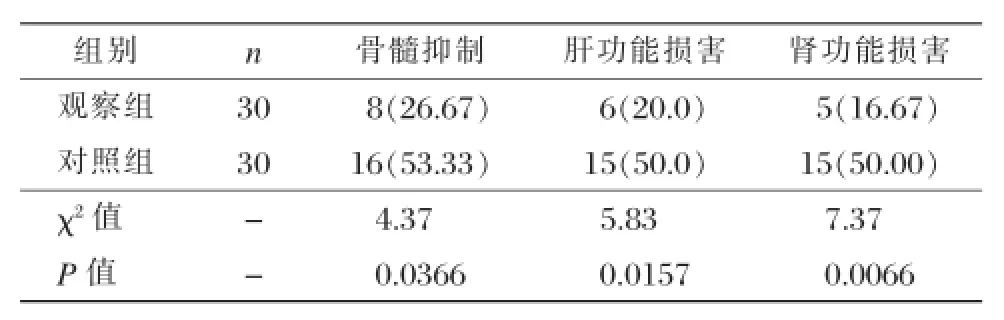
表2 两组毒副反应比较[n(%)]
表3 两组治疗前后免疫功能比较±s,%)
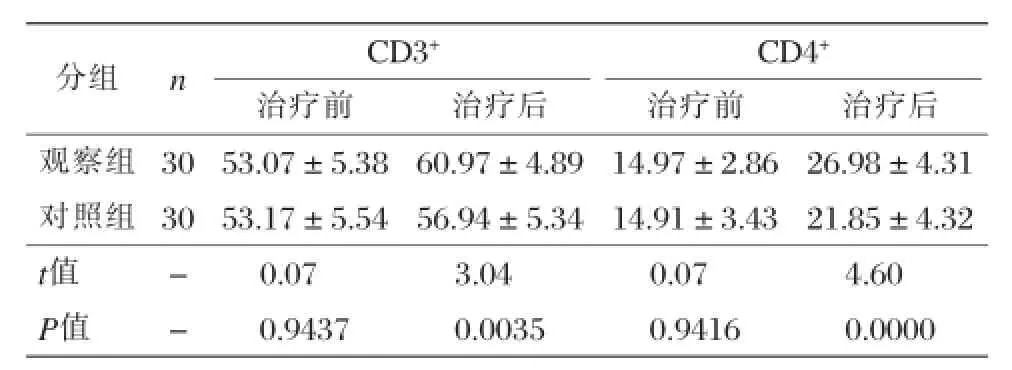
表3 两组治疗前后免疫功能比较±s,%)
分组nCD3+CD4+治疗前治疗后治疗前治疗后观察组3053.07±5.3860.97±4.8914.97±2.8626.98±4.31对照组3053.17±5.5456.94±5.3414.91±3.4321.85±4.32 t值-0.073.040.074.60 P值-0.94370.00350.94160.0000
讨论
胃癌是临床消化道肿瘤中较为常见的一种,且大多数患者被确诊时已处于进展期,其致死率居我国恶性肿瘤死亡率首位,对患者生命安全造成严重威胁。胃癌发病机制目前还尚未完全阐明,但大多数研究认为饮食因素与外界环境是引发胃癌的主要因素之一[6]。胃癌患者在发病早期的临床症状不明显,当出现临床症状而入院治疗时已处于晚期,此时已丧失了最佳治疗时期,对治疗也提出了更高的要求。目前,手术切除联合化疗是临床治疗胃癌的主要方法。手术切除主要以D1、D2根治性切除术为主,对于无淋巴结转移的患者采用D2更有益于肿瘤的完全切除,因此,在临床更为常用。XELOX辅助化疗是目前胃癌术后患者首选的辅助化疗方案。在胃癌根除术后给予患者辅助化疗可杀灭术后的微病灶与脱落的癌细胞,以预防术后肿瘤细胞转移或复发,对提高治疗效果,改善患者生活质量具有重要意义[7-8]。
中医学将胃癌归于“反胃”、“积聚”、“血症”、“胃脘痛”等范畴,是由胃主受纳、消化,脾胃运化失职,导致气滞痰凝,日积月累成块而发病[9]。在本次研究中,观察组治疗效果不但优于对照组,且用药后出现毒副反应的情况少于对照组,差异具有统计学意义(P<0.05)。由此说明,在胃癌根治术联合化疗的基础上增加扶正清解方治疗,不但有助于手术与化疗顺利进行,使得临床疗效提高,而且还可减少毒副反应的发生。这是由于扶正清解方具有扶助正气,提高机体免疫力,使得机体对病邪的抵御与祛除能力增强,同时还可协调阴阳,使机体内环境得到改善,对肿瘤细胞的生长起到抑制作用[10];扶正清解方在抑制肿瘤细胞的同时,对肝胆、脾胃也起到了调理作用,具有补气活血、健脾化湿、益补脾胃的功效,从而减少了毒副反应的发生。在本次研究中,两组治疗后CD3+与CD4+值均较治疗前提高,但观察组治疗后CD3+与CD4+值高于对照组,差异具有统计学意义(P<0.05),这与何耀明等[11]的研究报道一致。说明对胃癌根治术后患者采用辅助化疗时增加扶正清解方治疗有助于患者机体免疫力的提高。扶正清解方的组方中含有黄芪,其具有抑制肿瘤细胞生长,调节免疫功能的作用;大黄与淫羊藿具有调节细胞免疫应答、改善体液免疫的功效,患者机体免疫力得到提高才能抵抗肿瘤细胞的生长[12]。
综上所述,在胃癌根治术联合化疗的基础上,增加扶正清解方辅助治疗不但能够缓解患者的临床症状,提高患者机体免疫力,而且还可降低毒副反应发生率,提高患者生活质量,安全性较高,值得临床推广并应用。
[1]Nam DH,Lee H,Park JC,et al.Long-term Statin Therapy Improves Oncological Outcome After Radical Gastrectomy for Stage II and III Gastric Cancer[J].Anticancer Res,2014,34(1):355-361.
[2]赫捷,赵平,陈万青.2012中国肿瘤登记年报[M].北京:军事医学科学出版社,2012:100-101.
[3]廖艺,杨祖立,向军,等.腹腔镜辅助下胃癌D2根治性远端胃大部切除术安全性与有效性的系统评价[J].中华胃肠外科杂志, 2010,13(11):825-830.
[4]Song KY,Park YG,Jeon HM,et al.A nomogram for predicting individual survival of patients with gastric cancer who underwent radical surgery with extended lymph node dissection[J].Gastric Cancer,2014,17(2):287-293.
[5]王鑫,金晶,李晔雄,等.局部晚期胃癌根治术后复发部位分析及对术后放疗意义的探讨[J].中华放射肿瘤学杂志,2011,20(2): 133-137.
[6]Fujiwara S,Noguchi T,Aizawa T,et al.Radical endoscopic resection is unsuitable for most synchronous,multiple and early gastric cancers[J].Hepatogastroenterology,2012,59(115):951-954.
[7]何胜,曾维政.胃癌组织中Bmi-1表达与胃癌分化、转移及临床预后的关系[J].现代消化及介入诊疗,2015,20(3):189-192.
[8]瞿利帅,陈世耀.CD4+CD25+调节性T细胞对胃癌免疫调节的作用[J].现代消化及介入诊疗,2007,12(4):263-265.
[9]崔玉忠,王洪敏,王永涛,等.Xelox方案治疗晚期胃癌62例分析[J].实用癌症杂志,2011,26(6):658-659.
[10]刘玮玮,顾康生.扶正舒肝方联合团体心理疗法对胃癌术后患者抑郁和生活质量的影响[J].中国实验方剂学杂志,2015,21(2): 204-208.
[11]何耀明,马娟.药物辅助胃癌根治术用于晚期胃癌治疗中对患者生活质量的影响[J].临床药物治疗杂志,2015,13(4):37-40.
[12]王海波,蔡慎初,徐晓峰,等.蔡氏扶正消癥汤联合奥沙利铂抑制胃癌生长的研究[J].医学研究杂志,2012,41(6):74-77.
(本文编辑:熊婧)
10.3969/j.issn.1672-2159.2016.02.019
443000湖北省宜昌市第二人民医院肿瘤医院放化疗四科
2016-01-13)
