HPLC/MS测定环孢素A单用及联用氟康唑的血药浓度
2016-09-09易林高吴明钗陈晓孩陆日鸣瑞安市人民医院药学部浙江温州3500温州医科大学仁济学院浙江温州35035
易林高,吴明钗,黄 鹏,陈晓孩,陆日鸣(.瑞安市人民医院药学部,浙江 温州 3500;.温州医科大学仁济学院,浙江 温州 35035)
HPLC/MS测定环孢素A单用及联用氟康唑的血药浓度
易林高1,吴明钗1,黄 鹏1,陈晓孩1,陆日鸣2
(1.瑞安市人民医院药学部,浙江 温州 325200;2.温州医科大学仁济学院,浙江 温州 325035)
目的:建立质谱法测定环孢素A(CsA)的血药浓度,并用其测定CsA单/联用氟康唑的血药浓度。方法:采用液质联用法测定单/联用氟康唑时CsA的血药浓度,色谱柱:Agilent Zorbax SB-C18柱,柱温50 ℃,流动相为乙腈-0.1%甲酸,流速0.5 mL·min-1;质谱条件:ESI(电喷雾离子源),正离子检测,雾化气压力设为20 psi。结果:CsA在100 ~ 20 000 ng·mL-1内线性关系良好(r = 0.999 6),日内、日间RSD均低于5%,平均萃取回收率为90%;联合使用氟康唑的CsA比单独使用CsA在第5天血药谷浓度平均高178.0%,峰浓度平均高161.3%。结论:本方法简便、专属、准确、灵敏度高,可用于CsA血药浓度测定及药动学的研究;正在联合使用CsA和氟康唑的患者,氟康唑会明显增高CsA的血药浓度,应减少CsA的用量,并密切监测CsA的血药浓度。
环孢素A;氟康唑;含量测定;血药浓度
环孢素A(cyclosporine A,CsA)因具有较强的免疫活性,已成为广泛用于器官移植术后抗排异反应的基础免疫抑制剂[1]。器官移植是治疗终末期器官衰竭的有效手段,CsA和激素是防止移植物丢失主要药物,易导致移植患者的真菌感染,临床上经常治疗性或预防性使用三唑类抗真菌药;而此类药物通常会抑制细胞色素P450酶,影响其它药物的代谢,进而影响CsA的血药浓度,为临床正在使用CsA又同时感染真菌患者的治疗带来困难[2]。本文研究了唑类抗真菌药氟康唑与CsA联合应用时,前者对后者血药浓度(峰浓度及谷浓度)的影响,为临床合理用药提供理论参考。
1 材料与方法
1.1仪器与试剂
Bruker Esquire系列HCT离子阱质谱仪,配有ESI离子源(德国Bruker公司);1200型HPLC色谱仪包括MWD检测器、四元泵、在线真空脱气机、自动进样器(美国Agilent公司);AB104-S电子分析天平(梅特勒-托利多上海仪器公司);XW-80旋涡混合器(上海医科大学仪器厂);GT16-3高速离心机(北京时代北利离心机有限公司)。CsA对照品(中国药品生物制品检定所,含量98.9%,批号30405-201103)。甲醇、乙腈(德国Merck公司),水为超纯水。
1.2实验动物
8只雄性清洁级SD大鼠,由温州医学院实验动物中心提供,动物合格证号SCXK(浙)2010-0044。所有动物实验的操作规程和协议都按照温州医学院动物保护和使用委员会颁布的《实验动物使用和保护指导守则》进行。随机将SD大鼠分为A、B两组,每组4只,采用统一的饲料和水喂养,温度控制在22 ℃。
1.3液质分析条件
色谱柱:Agilent Zorbax SB-C18柱(2.1 mm × 50 mm,5 μm),柱温50 ℃。流动相:乙腈-0.1%甲酸,流速0.5 mL·min-1,梯度洗脱:0 min,10%乙腈;2 min,90%乙腈;7 min,90%乙腈;8 min,10%乙腈;11 min,运行完成。进样量10 µL。
质谱条件:ESI(电喷雾离子源),正离子检测,雾化气压力设为20 psi;干燥气(N2)流速为6 L·min-1,干燥气温度为350 ℃。选择离子模式(SIM)方式定量,检测离子为 m/z 1248(环孢素)。
1.4标准液配制
CsA对照品溶液:精密称取CsA对照品适量,用甲醇溶解并稀释制得0.5 mg·mL-1的对照品储备液,置阴凉处保存。临用时用流动相稀释得各种浓度的CsA对照品溶液。
1.5血清样本处理
取大鼠全血500 μL,加入3 mL乙醚涡旋1 min,8000 r·min-1离心10 min,取上清液2.5 mL,氮气吹干,流动相100 μL复溶,20 μL进样。
1.6药动学实验
8只大鼠统一进食,在实验前一晚开始禁食,A组第1天CsA灌胃法给药,每只大鼠于早上(7∶30)和晚上(19∶30)进食前2 h给予CsA 24 mg·kg-1·d-1,连服5 d。每只大鼠在每天早上给药前及给药后1 h取血0.5 mL测定CsA全血浓度(峰浓度及谷浓度)。B组于早上(7∶30)和晚上(19∶30)进食前2 h给予CsA 24 mg·kg-1·d-1和氟康唑24 mg·kg-1·d-1,其它同A组。给药结束后,停药14 d。A组和B组交换,A组4只大鼠灌胃法给予CsA和氟康唑,B组4只大鼠灌胃法给予CsA,其它同前。将血样本储存在- 40 ℃冷冻柜。以建立的HPLC/MS法测定各时间点CsA的血药浓度。
2 结果
2.1专属性实验
CsA在ESI正离子全扫描方式下,主要生成[M+H]准分子离子峰,分别为m/z 1225和m/z 1248,其中m/z 1248稍高,故将其作为定量分析时的选择性检测离子。在上述试验条件下,CsA的保留时间分别为5.1 min,内源性物质无干扰。见图1。
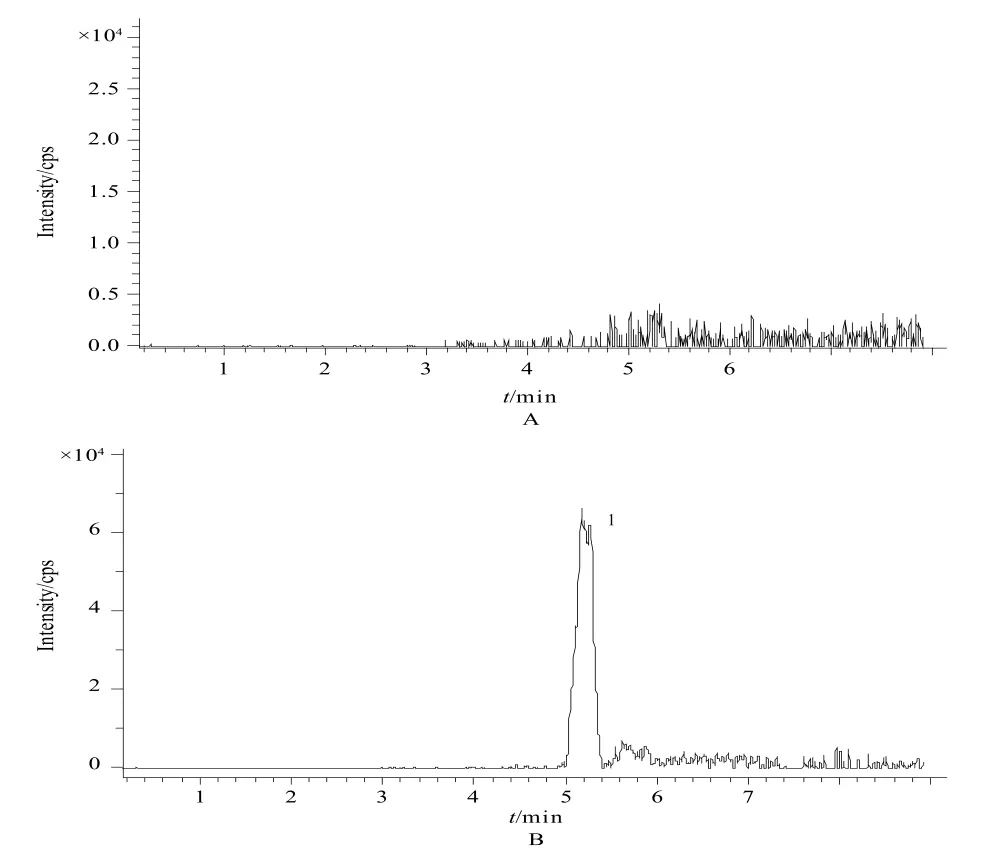
图1 环孢素A的色谱图A - 空白血清,B - 空白血清+ CsA;1 - 环孢素AFig 1 Chromatograms of CsAA - blank serum, B - blank serum + CsA;1 - CsA
2.2全血标准曲线制备
取空白全血450 μL,精密加入50 μL不同浓度的CsA对照品,使其浓度分别为100、200、500、1000、2000、5000、10 000、20 000 ng·mL-1,按“1.5”项下血样方法处理,按“1.3”项下色谱条件进样,记录色谱峰及峰面积。以CsA的峰面积(Y)对浓度(X)进行回归,得回归方程:Y = 3.606 6×103X + 1.306 4×104,最低检测浓度为16.9 ng·mL-1。结果显示CsA在100 ~20 000 ng·mL-1区域内有良好的线性关系(n = 5,r = 0.999 6)。
2.3精密度和回收率考察
取空白全血450 μL,按“2.2”项下方法制备低、中、高浓度(500、2000和10 000 ng·mL-1)含CsA的血清样品,每个浓度5份,考察回收率和精密度。每个浓度样品1 d内测定5次,计算回收率和日内RSD,每个浓度连续测定5 d,计算日间RSD。上述3种浓度测定结果的RSD均在5%范围内,详见表1。
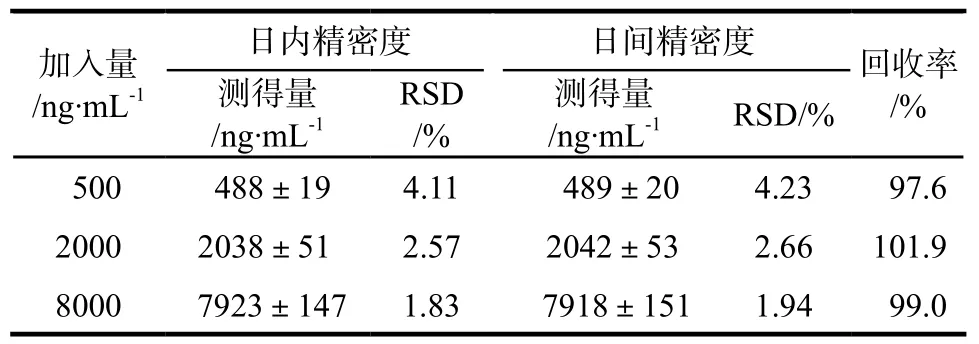
表1 全血CsA的精密度和回收率. x ± s,n = 5Tab 1 Precision and recovery of CsA in whole blood. x ± s ,n = 5
2.4萃取回收率测定
精密量取低、中、高浓度的CsA标准溶液500 μL,将溶剂挥干,用100 μL流动相溶解,记录样品离子流峰面积AS。用全血配制同样低、中、高3种不同浓度的样品,按“1.5”项下进行血样处理,按“1.3”项下色谱条件进样,记录样品离子流峰的面积AE,按下式计算萃取回收率。E% = AE/AS×6/5×100%。详见表2。

表2 全血CsA 的萃取回收率.x ± s,n = 5Tab 2 Extraction recovery of CsA in whole blood. x ± s ,n = 5
2.5应用
测定CsA单用及联用氟康唑后,从第1天到第5天CsA的血药浓度,第5天CsA单用的谷浓度(1176±194)ng·mL-1,合用的谷浓度(2093±255)ng·mL-1,平均升高178.0%;第5天CsA单用的峰浓度(1937±195)ng·mL-1,合用的峰浓度(3124±257)ng·mL-1,平均升高161.3%。具体见表3。
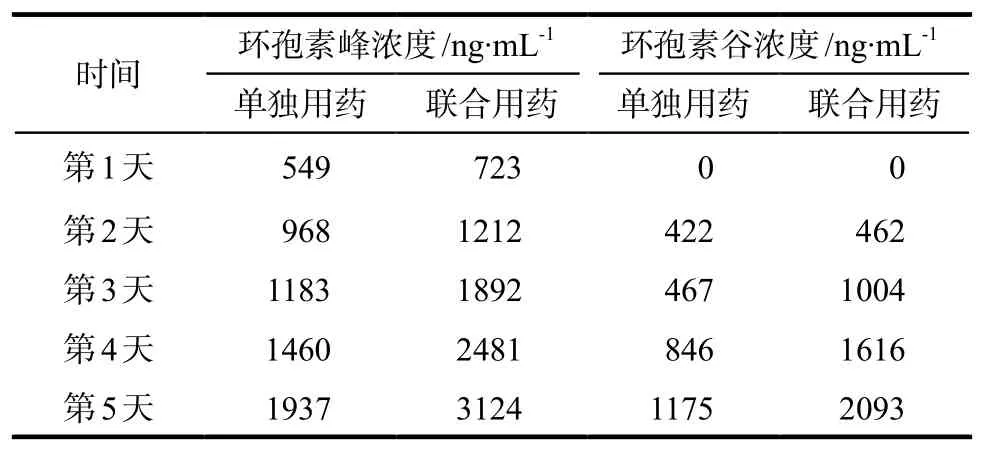
表3 CsA单用及联用氟康唑的峰谷浓度情况Tab 3 Peak trough concentration of CsA alone and in combination with fluconazole
3 讨论
3.1梯度洗脱
减少血液中杂质对CsA干扰,改善峰形,拟用不同浓度的甲醇或乙腈作为流动相,如80%甲醇、85%甲醇、70%乙腈、80%乙腈等,结果显示杂质对其有干扰或峰的形状不理想,改用梯度洗脱后,峰形和分离情况明显好转,利用0 ~ 2 min 10%乙腈冲洗杂质,然后改用90%的乙腈洗脱CsA,获得较好的峰形,且也与杂质能较好的分离。
3.2柱温选择
CsA分子量较大,洗脱难度较高,可提高柱温以改善CsA峰形,有报道选择柱温为60 ℃、55 ℃等[3-4],但柱温高对一般色谱柱损伤较大,明显减少其寿命,本实验经过梯度洗脱、萃取法去杂质等改良措施后用50 ℃的柱温也能达到较好效果。
3.3氟康唑对CsA的影响
CsA主要经肝脏细胞色素P450酶系中的CYP3A4、CYP3A5代谢[1,5],血药浓度可受许多药物的影响。因此,在使用CsA的同时,合用肝药酶抑制剂或诱导剂都会改变CsA的体内代谢过程,从而影响CsA的血药浓度[6-7]。
三唑类抗真菌药主要在肝脏内经CYP3A4代谢[8],如氟康唑会抑制细胞色素P450氧化酶同工酶CYP3A4的活性,从而影响CsA在肝内的代谢,使其血药浓度升高,增强毒性。氟康唑对真菌依赖的细胞色素P450酶具有高度特异性的抑制作用,同时对人体细胞色素P450酶也有抑制作用。而CsA主要依赖肝细胞及肠壁细胞的P450酶代谢,所以氟康唑可影响CsA的代谢而使其血药浓度升高,因此对于肾移植患者在应用氟康唑时应注意调整CsA的剂量,以免因CsA血药浓度过高导致患者的肝肾功能损害。
综上,本研究结果显示,联合使用氟康唑的CsA比单独使用CsA血药谷浓度在第5天平均高178.0%;峰浓度在第5天平均高161.3%。因此,正在使用CsA的患者,联用氟康唑时会明显提高CsA的血药浓度,增强其毒性,应减少CsA的用量,并监测其血药浓度。
本方法操作简便、专属性强、准确度及灵敏度高,可用于CsA血药浓度测定及药动学的研究。
[1] 石秀锦,魏国义,林阳,等.PXR基因多态性与心脏移植术后稳定期环孢素血药浓度的相关性[J].中国药物应用与监测,2014,11(3):152-155.
[2] Sachewsky N, Hunt J, Cooke MJ, et al. Cyclosporin A enhances neural precursor cell survival in mice through a calcineurinindependent pathway[J]. Dis Model Mech, 2014, 7(8): 953-961.
[3] 王淑民,李鹏飞,赵秀丽,等.LC-MS/MS法测定人全血中环孢素A浓度及环孢素眼用乳剂健康人体药代动力学研究[J].质谱学报,2010,31(1):53-58.
[4] 梁晓丽,刘蕾,陈崸,等.HPLC-MS/MS和FPIA法测定全血中环孢素浓度的比较方法学[J].中国药学杂志,2009,44(24):1904-1908.
[5] 徐亚飞,董瑞华,曲恒燕,等.CYP3A和MDR1基因多态性对环孢素A药代动力学的影响[J].国际药学研究杂志,2015,42(2):148-151.
[6] Zavaglia C, Airoldi A, Mancuso A, et al. Adverse events affect sorafenib efficacy in patients with recurrent hepatocellular carcinoma after liver transplantation: experience at a single center and review of the literature[J]. Eur J Gastroenterol Hepatol, 2013, 25(2): 180-186.
[7] 胡雪敏.环孢素A血药浓度的影响因素[J].山西医药杂志,2012,41(10):1025-1026.
[8] 李纯璞,李斑斑,滕清良,等.环孢素A在再生障碍性贫血及异基因造血干细胞移植中的有效血药浓度检测的影响因素[J].中华临床医师杂志,2014,8(1):128-131.
Determination of the blood concentration of cyclosporine A alone and in combination with fluconazole by HPLC/MS
YI Lin-gao1, WU Ming-chai1, HUANG Peng1, CHEN Xiao-hai1, LU Ri-ming2
(1. Department of Pharmacy, Ruian People's Hospital, Wenzhou 325200, China; 2. Renji College of Wenzhou Medical University, Wenzhou 325035, China)
Objective: To establish a mass spectrometry method for determination of blood concentration of cyclosporine A (CsA), and determine the blood concentration of cyclosporine A alone and in combination with fluconazole. Methods: The blood concentration of cyclosporine A in rats was detected and compared when cyclosporine alone and combined with fluconazole by using liquid chromatography-mass spectrometry. Chromatographic column Agilent Zorbax SB-C18was used. Column temperature was 50 ℃. Mobile phase was acetonitrile-0.1% formic acid. Flow rate was 0.5 mL·min-1. Mass spectrometry condition was as follows: ESI (electrospray ion source) was used, positive ion detection was used, atomizing gas pressure was set to 20 psi. Results: The linear relationship of CsA was good in the range of 100 - 20 000 ng·mL-1(r = 0.999 6). Intra-day RSD and inter-day RSD were less than 5%. The average extraction recovery was 90%. The average blood trough concentration of CsA when CsA combined with fluconazole was higher (by 178.0%) than just cyclosporine alone in five days, and the peak concentration in combined utilization was higher (by 161.3%) than that of alone use. Conclusion: The method is simple, specific, accurate and high sensitivity,which can also be used for the determination of CsA blood concentration and pharmacokinetics study. Patients who are using CsA and fluconazole will obviously have high blood concentrations of CsA, should reduce the dosage of CsA, and monitor the blood concentration.
Cyclosporine A; Fluconazole; Content determination; Blood drug concentration
R917
A
1672 - 8157(2016)04 - 0211 - 03
浙江省药学会医院药学专项科研资助项目(2013ZYY14)
易林高,男,副主任药师,主要从事临床药学工作。E-mail:626794417@qq.com
2016-02-27
2016-05-20)
