枯草芽胞杆菌M15101强化内源微生物驱油模拟实验
2016-09-07李燕淑高配科代学成田会梅刘雪莲李国强
李燕淑,李 彦,高配科,代学成,田会梅,刘雪莲,常 宁,李国强,马 挺
(1.南开大学生命科学学院分子微生物学与技术教育部重点实验室,天津300071;2.新疆油田实验检测研究院,新疆克拉玛依834000;3.大庆油田责任有限公司第二采油厂第一作业区,黑龙江大庆150000)
枯草芽胞杆菌M15101强化内源微生物驱油模拟实验
李燕淑1,李彦1,高配科1,代学成2,田会梅1,刘雪莲3,常宁3,李国强1,马挺1
(1.南开大学生命科学学院分子微生物学与技术教育部重点实验室,天津300071;2.新疆油田实验检测研究院,新疆克拉玛依834000;3.大庆油田责任有限公司第二采油厂第一作业区,黑龙江大庆150000)
以分离自油藏环境的产脂肽枯草芽胞杆菌M15-10-1为研究对象,探究了外源表面活性剂产生菌强化油藏内源微生物驱油过程中的原油乳化分散效果和菌群间的相互作用。配伍性实验表明,该菌株与油藏常见采油功能菌——迪茨氏菌、红球菌和肠杆菌具有良好的配伍性。荧光定量PCR和高通量测序分析结果表明,枯草芽胞杆菌M15-10-1对内源菌群结构无不利影响。摇瓶激活实验和气象色谱分析结果显示,枯草芽胞杆菌M15101能够显著改善内源菌群激活初期油相乳化分散效果,促进原油降解,为后续广泛应用于现场试验提供基础。
枯草芽胞杆菌;生物强化;内源微生物;微生物驱油;原油乳化
油藏是一个缺氧、寡营养的极端环境,但其中蕴含丰富的微生物群落[1-2]。内源微生物采油技术就是通过注入营养剂,激活油藏微生物的生长和代谢,产生生物表面活性剂、生物聚合物、有机酸和气体等物质,改善原油流动性,提高石油采收率[3-4]。由于油藏的极端环境,营养物质对内源微生物的激活需要一个漫长过程,这极大地制约了油藏内源微生物的作用效果[5]。如果将营养物质和由其他油田分离的高效采油功能菌一同注入油藏储层中,外源采油功能菌的快速生长和驱油物质的迅速生成是否会对油藏内源微生物的激活和代谢产生较大促进作用?
据此,本文中,笔者以分离自油藏环境的1株产脂肽枯草芽胞杆菌M15-10-1为研究对象,首先探究了该菌株的生长和代谢对油藏常见采油功能菌——红球菌、迪茨氏菌、肠杆菌的影响,然后将菌株M15-10-1用于强化激活油藏内源微生物驱油实验,进而从原油乳化分散、原油降解组分和菌群结构变化等角度探究了枯草芽胞杆菌M15-10-1强化激活油藏内源微生物的驱油效果,以期为微生物驱油现场试验提供参考。
1 材料与方法
1.1材料
1.1.1油水样采集与分析
实验所用油水样采集自新疆陆梁油田中温水驱油藏3037采油井。该油藏深度约为1 200 m,地层温度40℃。地层压力为10.2 MPa,孔隙度达29.9%。油水样的理化性质经分析,其中氮、磷营养盐含量极低,分别为12.7和18.1 mg/L,是制约油藏内源微生物生长代谢的主要限制性营养因子。
1.1.2菌种
枯草芽胞杆菌M15-10-1分离自大庆油田二厂某区块采出液;红球菌M、迪茨氏菌ZQ-4和肠杆菌T-1来源于笔者所在实验室保藏菌种。
1.1.3培养基
LB培养基(g/L):酵母粉5,蛋白胨10,NaCl 10。
无机盐培养基(g/L):Na2HPO40.6,KH2PO40.2,NaNO34,CaCl20.01,FeSO40.01,MgSO40.3,酵母粉0.2,pH 7.2;
以上培养基均用蒸馏水配制,调pH至7.2后121℃灭菌30 min。
激活实验培养基(g/L):(NH4)2HPO4·3H2O 2,NaNO34,原油20,葡萄糖、甘油、糖蜜或玉米浆2;pH 7.2。采用产出水配制培养基,不必灭菌。
1.2实验方法
1.2.1枯草芽胞杆菌M15-10-1的鉴定
提取纯化菌株的基因组DNA,以基因组DNA为模板,利用27F和1541R引物进行PCR扩增反应。PCR产物经琼脂糖凝胶电泳检测,切胶纯化后送至华大基因公司进行测序。测序结果采用BLAST软件分析,与GenBank中16S rRNA基因进行同源性比对。应用MEGA 5.0软件计算遗传距离,通过Neighbor-Joining距离距阵法构建系统发育树状图[6]。以基因组DNA为模板,利用srfA F和srfA R引物扩增产脂肽基因srfA,利用以上方法建立srfA基因的系统发育树状图。
枯草芽胞杆菌M15-10-1强化内源微生物驱油进行模拟实验后,使用JK99B型全自动界面张力仪测量表面张力,通过与激活培养前产出水中表面张力大小的对比,进一步确定菌株M15-10-1是否可产生表面活性剂——脂肽。
1.2.2油藏微生物群落微环境的建立
人工模拟枯草芽胞杆菌M15-10-1、红球菌M、迪茨氏菌ZQ-4、肠杆菌T-1微生物共生菌群。首先制备上述4种菌的种子液,在含有5 mL LB培养基的试管中培养4种菌,40℃、180 r/min条件下过夜培养。然后取1 mL菌液接入含有100 mL LB培养基的250 mL锥形瓶中扩大培养12 h。将4种菌的种子液分别以相同接种量接入含有100 mL LB培养基和100 mL无机盐培养基的250 mL锥形瓶中。实验组一:4种菌接种量1 mL;实验组二:4种菌接种量10 μL;对照组:在LB培养基和BSM培养基中分别单独培养枯草芽胞杆菌M15101,接种量为100 μL,每组做2个平行。实验在40℃条件下振荡培养15 d,转速为120 r/min。分别在8、17、28、72、168、264和336 h保存菌液1 mL。使用磁珠研磨法提取基因组,利用实时荧光定量PCR方法定量群落丰度。
1.2.3枯草芽胞杆菌M15-10-1强化内源微生物驱油模拟实验
选用以葡萄糖、甘油、糖蜜和玉米浆为碳源的激活实验培养基,实验水样选用陆梁油田3073井的产出水。枯草芽胞杆菌M15-10-1首先在含2 g/L葡萄糖的无机盐培养基中培养16 h,然后按5%(体积分数)接种量接入含6 g/L葡萄糖的无机盐培养基中培养。将液体离心收集菌体后用等体积不含原油的无机盐培养基重悬制得菌剂。根据产出水中微生物浓度确定枯草芽胞杆菌M15101的加入量,将菌剂接入含100 mL激活实验培养基的250 mL锥形瓶中,锥形瓶用胶塞封口以保持缺氧环境,置于40℃、180 r/min条件下振荡培养。培养后保存菌液,使用磁珠研磨法提取基因组DNA,以备后续进行荧光定量PCR反应和高通量测序。
1.2.4基因组的提取
基因组提取使用磁珠研磨法。菌液在12 000 r/min条件下离心1 min,沉淀的菌体用600 mL裂解缓冲液悬浮沉淀后加入研磨管,在研磨管中加入0.2 g磁珠。利用研磨机进行研磨,冰浴交替3 min。再加入1 mg/mL溶菌酶50 μL,40℃水浴1 h,之后加入120 μL 100 g/L SDS,65℃水浴1 h。接着使用AxyPrepTM基因组DNA小提试剂盒完成操作。所提基因组保存于-80℃条件下,以便进行后续分析。
1.2.5实时荧光定量PCR
荧光定量PCR反应所用引物如表1所示。经检测,枯草芽胞杆菌M15-10-1、红球菌M、迪茨氏菌ZQ-4和肠杆菌T-1这4对引物具有特异性,只对目的菌具有特异性扩增。细菌分子标记16S rRNA基因被用来检测激活实验培养基中油藏内源微生物总菌群丰度,分子标记alkB基因用来评估烃降解菌菌群丰度。荧光定量PCR标准曲线由重组质粒建立。将引物扩增的PCR产物纯化后,连接于T1载体上,转化至大肠杆菌中,挑取转化后平板上的白色单克隆提取质粒DNA,测序确定插入片段正确。测定质粒DNA浓度,绘制标准曲线。针对不同基因构建相对应的重组质粒[7]。将重组质粒梯度稀释至102~108,以稀释样品作为模板进行荧光定量PCR反应,标准偏差(SD)和变异系数(CV,%)在规定范围内,且标准曲线具有较好的精确度和良好的重复性。利用此标准品进行荧光定量PCR反应,经过数据分析,得出最终定量结果。荧光定量PCR程序在95℃变性2 min,接着94℃反应30 s,退火30 s,72℃延伸30 s,共进行30个循环。荧光采集在72℃延伸阶段进行。

表1 实时荧光定量PCR引物Table 1 Real-time fluorescent quantitative PCR primers
1.2.6高通量测序
高通量测序样品提取基因组DNA,采用微生物通用引物515f(GTGCCAGCMGCCGCGGTAA)和806r(GGACTACHVGGGTWTCTAAT)扩增细菌16S rRNA基因的V4区(300~350 bp)。PCR反应条件参照文献[8]。PCR产物经纯化后送至北京诺禾致源有限公司的Illumina MiSeq平台上进行测序,序列数据存储于National Center for Biotechnology Information。
数据分析使用专门进行微生物群落分析的QIIME软件,该软件用于分析和解释真菌、病毒、细菌和古细菌群落核酸数据。利用软件对测序数据进行总体过滤,再利用UPARSE pipeline将序列进行聚类分析,OTUs相似度大于97%归为一类,使用RDP classifier进行物种注释,确定序列对应微生物的分类学地位,用柱状图表示每个样品的构成。
1.2.7石油烃组分GC-MC气质色谱分析
参照GB/T 18606—2001《气相色谱质谱法测定沉积物和原油中生物标志物》对微生物作用前后的石油烃组分进行分析。对于残油的处理按照文献所描述方法进行[9]。残余原油经氯仿萃取2次后,使用硅胶氧化铝层析柱将残油分为饱和烃、芳香烃、沥青质和非烃物质。使用Agilent7890-5975c气相色谱质谱联用仪进行后续分析。
2 结果与讨论
2.1枯草芽胞杆菌的鉴定
图1是枯草芽胞杆菌系统发育进化树。由图1可知,菌株M15-10-1的16S rRNA与枯草芽胞杆菌相似度达99%。经鉴定该菌含有srfA——产脂肽基因,表明菌株M15-10-1是1株含有srfA的枯草芽胞杆菌。
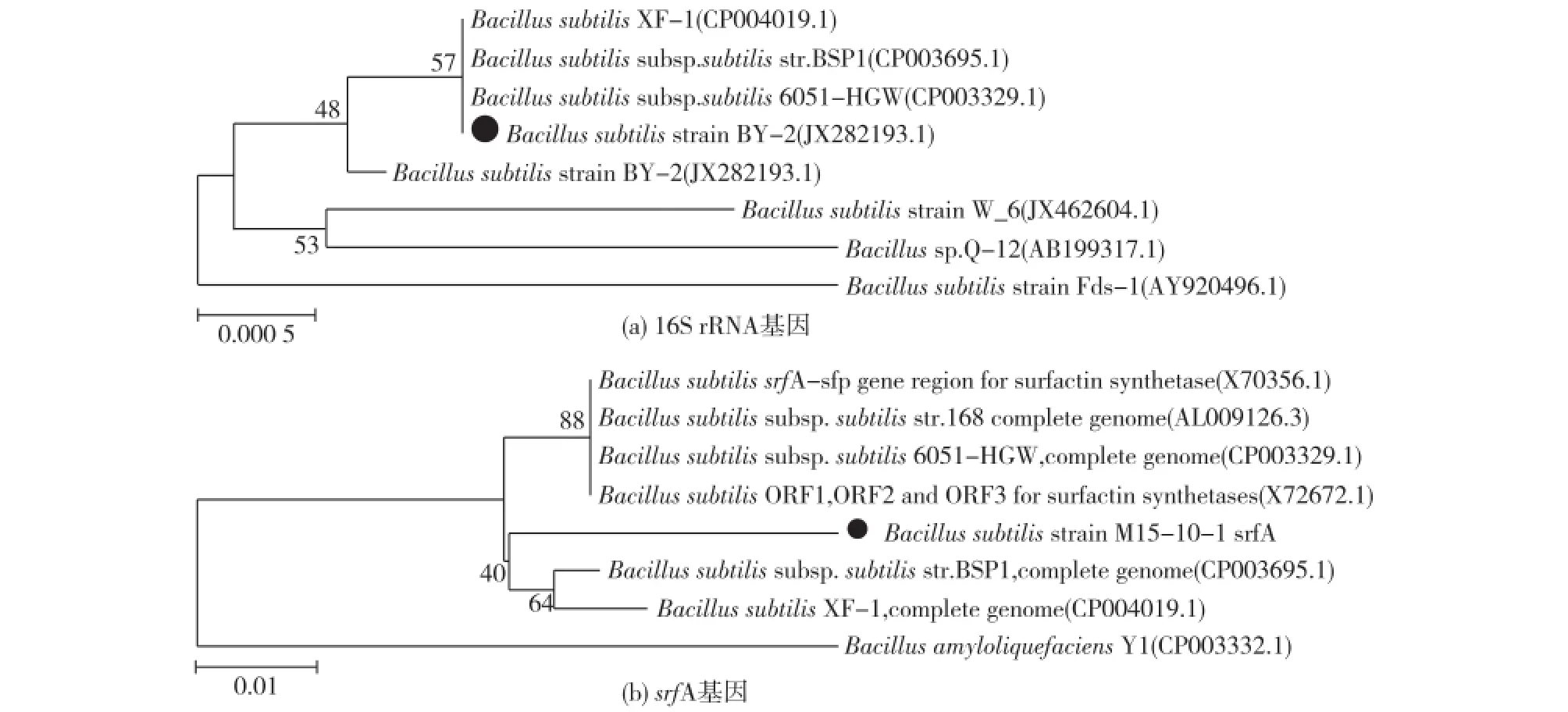
图1 枯草芽胞杆菌M15-10-1系统发育分类图及srfA系统发育分类图Fig.1 Phylogenetic relationship based on the 16S rDNA gene and srfA gene sequences between the Bacillus subtilis M15-10-1 strain and related species
通过测定激活前后油水样的表面张力变化,确定枯草芽胞杆菌M15-10-1可产生表面活性剂——脂肽,结果如表2所示。由表2可知:产出水经过激活培养后,表面张力从60.3 mN/m降至32.9 mN/m,而单独发酵培养枯草芽胞杆菌M15-10-1,所得发酵液表面张力经测得为29.5 mN/m。由此可知M15-10-1在生长过程中可产生表面活性剂——脂肽。
2.2枯草芽胞杆菌M15-10-1对模拟微生物群落的影响
实时荧光定量PCR结果如图2所示。由图2可知:在LB培养基中,对照组中枯草芽胞杆菌M15-10-1的生长曲线与实验组4种菌混合培养时的生长曲线基本一致,表明菌株M15-10-1的生长不受油藏3种功能菌[10](红球菌M、迪茨氏菌ZQ-4[11]和肠杆菌T-1)的影响,且对其他3种菌的生长无抑制效应。在BSM培养基中,尽管枯草芽胞杆菌M15-10-1不能利用原油生长,通过图2可知,在4种菌混合培养时,其菌量有所增加,表明菌株M15-10-1可以利用其他3种菌所产代谢产物生长。4种菌混合培养结果说明,枯草芽胞杆菌M15-10-1的生长及代谢产物对其他3类油藏功能菌的生长影响甚微,且可利用其他烃降解菌的代谢产物在含油培养基中生长。

表2 激活前后油水样表面张力变化Table 2 Surface tension change in the water samples stimulated by nutrients or in combination with Bacillus subtilis M15-10-1

图2 4种典型的采油微生物混合培养生长曲线Fig.2 Growth curves of Bacillus subtilis M15-10-1,Dietzia sp.ZQ-4,Rhodococcus sp.M,and Enterobacter cloacae FY-07
2.3外源菌与营养剂协同作用对石油乳化和降解的影响
根据产出水中微生物浓度确定外源菌——枯草芽胞杆菌M15-10-1的加入量为5 g/L(图3)。由图3可知:在AG组和BG组中原油乳化效果,以葡萄糖为碳源,可以激活内源微生物的生长(AG),但对于提高原油的乳化却无明显效果(BG),但当加入枯草芽胞杆菌M15-10-1后,能很好地改善原油乳化分散效果(CG)。以玉米浆为碳源的实验组,不仅可以激活油藏内源微生物的生长(AC),还可明显促进石油的乳化分散(BC),但是仍存在原油挂壁现象。加入菌株M15-10-1后(Cc),乳化分散原油效果进一步得到改善,油水样均匀,分层现象消失。该组实验结果表明外加枯草芽胞杆菌M15-10-1能够有效强化内源微生物激活过程中原油的乳化分散。
图4是利用气相色谱质谱联用仪分析原油烃降解组分。由图4可知:以葡萄糖为碳源(BG)的体系不能有效降解原油烃,枯草芽胞杆菌M15-10-1(CG)的加入起到加速原油烃的降解作用,烃含量明显减少,且图3的CG组结果同样证实该作用。而在玉米浆为碳源的条件下,添加营养物质(Bc)可达到原油烃降解的效果,但是枯草芽胞杆菌M15-10-1的加入不仅使脂肪烃明显降解(Cc),对于姥鲛烷和植烷烃的降解同样起到促进作用,两者含量下降。实验结果表明利用油田常用的廉价碳源玉米浆,结合外源表面活性剂产生菌—枯草芽胞杆菌M15-10-1的生长和代谢,两者协同作用可进一步定向激活油藏内源菌的生长以及对原油的乳化和降解。

图3 外源菌强化激活摇瓶实验Fig.3 Oil emulsification during stimulation with nutrients or in combination
2.4枯草芽胞杆菌M15-10-1对油藏微生物群落的响应
以葡萄糖、甘油、糖蜜和玉米浆为碳源的激活实验培养基中菌群实时荧光定量PCR结果如图5所示。由图5可知:各实验组中16S rRNA拷贝数都达到108数量级以上,高于对照组中16S rRNA拷贝数,表明营养物质可以激活油藏内源微生物生长[12]。虽然以葡萄糖和甘油为碳源可以激活内源微生物生长,但由于该营养不能使内源菌产生大量表面活性剂,因此需要外加菌株M15-10-1,利用其生长和代谢作用促进原油的乳化。而油田常用廉价碳源糖蜜和玉米浆,不仅可以激活内源微生物生长,加入外源菌枯草芽胞杆菌M15-10-1后,还可增加表面活性剂的产生,进一步协同作用定向加速原油的乳化和降解。并且,枯草芽胞杆菌M15-10-1的加入对内源菌的生长也并未产生不利影响。
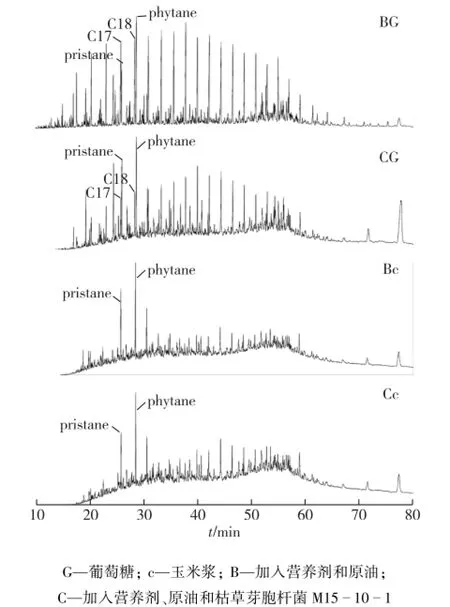
图4 激活前后原油气相色谱图Fig.4 Gas chromatography profile of total hydrocarbonduring stimulation with nutrients or in combination
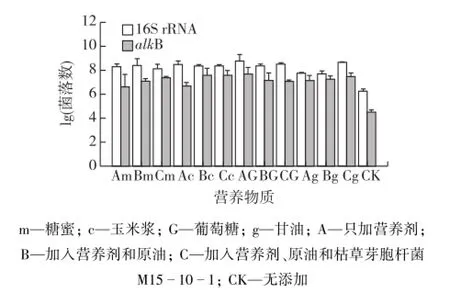
图5 16S rRNA和alkB荧光定量PCR基因拷贝数柱状图Fig.5 Copy numbers and average copy numbers of 16S rRNA and alkB genes detected in the water samples stimulated by nutrients or in combination
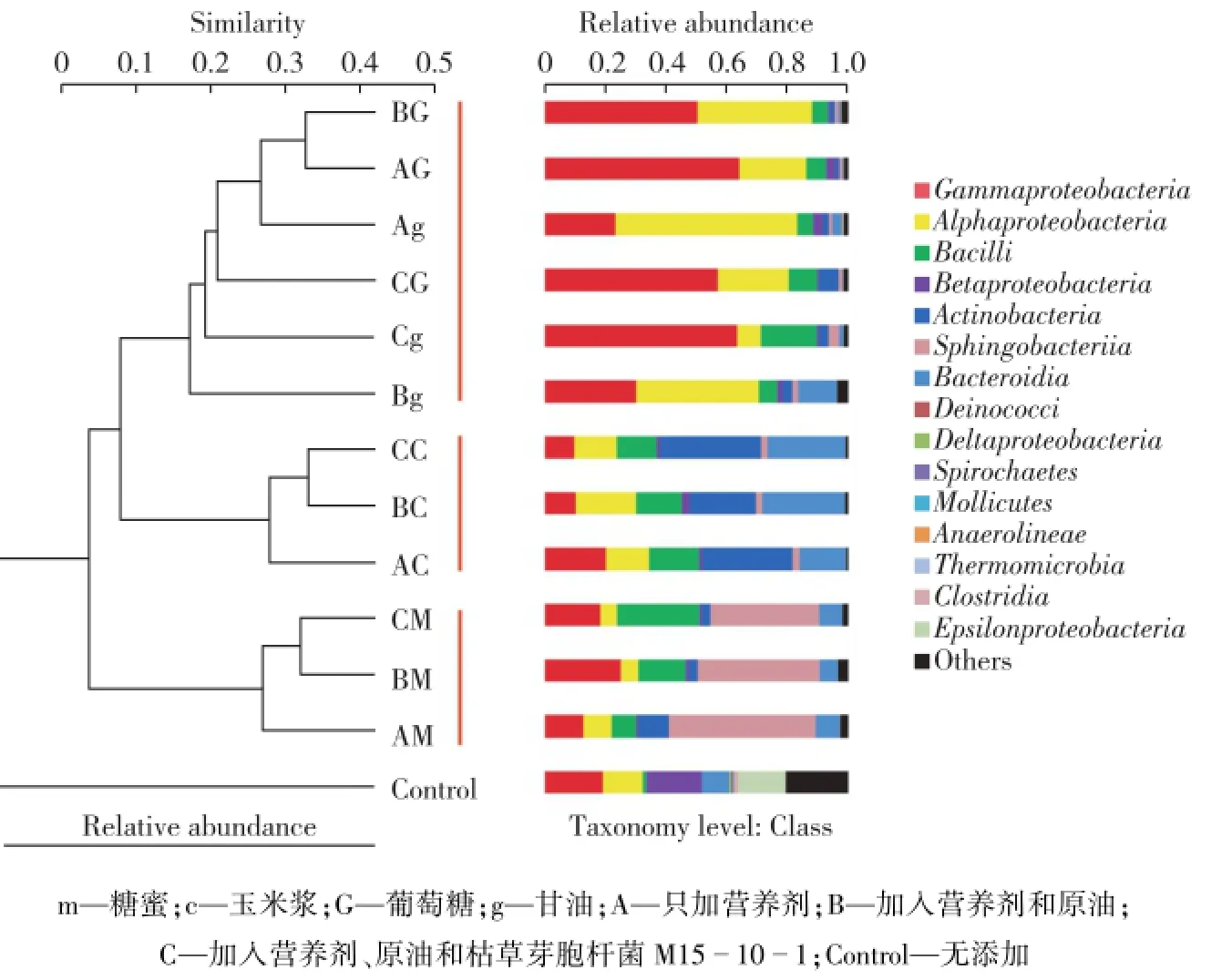
图6 Lu3073井采出液激活实验聚类分析图Fig.6 Clustering and histogram analysis of the microbial communities in Lu3073 water samples stimulated by nutrients or in combination
高通量测序结果进行聚类分析,同样反映出在不同碳源条件下枯草芽胞杆菌M15-10-1对油藏微生物群落的响应。图6为油藏微生物群落的系统发育进化树。由图6可知:不同碳源条件下,微生物菌群多样性和丰度有差异。与对照组相比,加入营养物质(AG、Ag、AC、AM)可激活内源微生物生长,使微生物群落结构多样性出现变化。在此基础上,外加原油烃实验组(BG、Bg、BC、BM)和枯草芽胞杆菌M15-10-1实验组(CG、Cg、CC、CM)中微生物群落的组成和丰度变化较小。荧光定量PCR反应和高通量测序结果说明枯草芽胞杆菌M15-10-1的生长及代谢所产表面活性剂脂肽对于油藏内源微生物无抑制作用。相反地,枯草芽胞杆菌M15-10-1通过其生长和代谢促进原油烃的乳化,乳化后的原油可作为碳源与营养物质协同定向激活油藏内源微生物,增强对原油乳化和降解作用,有利于提高原油采收率。
3 结论
在实验室条件下,以分离自油藏环境的产脂肽菌——枯草芽胞杆菌M15-10-1为研究对象,探究了枯草芽胞杆菌M15-10-1强化油藏内源微生物驱油过程中的原油乳化分散效果和菌群间相互作用。配伍性实验表明,枯草芽胞杆菌M15-10-1可与其他三类内源菌共同生长;荧光定量PCR和高通量测序分析表明该菌对内源菌群无不利影响;摇瓶激活实验和气象色谱分析结果说明枯草芽胞杆菌M15-10-1能够显著改善内源菌群激活初期油相乳化分散效果,促进原油烃降解,促进油藏内源烃降解菌的生长。该方法为后续广泛应用于现场试验提供基础。
[1] SHE Y H,ZHANG F,XIA J J,et al.Investigation of biosurfactantproducing indigenous microorganisms that enhance residue oil recovery in an oil reservoir after polymer flooding[J].Appl Biochem Biotechnol,2011,163(2):223-34.
[2] GAO P K,LI G Q,TIAN H M,et al.Differences in microbial community composition between injection and production water samplesofwaterfloodingpetroleumreservoirs[J]. Biogeosciences,2015,12(11):3403-3414.
[3] 郑承纲.微生物提高采收率技术研究[D].北京:中国科学院研究生院,2010.
[4] 乐建君,柏璐璐,王蕊,等.聚合物驱后油藏内源微生物驱油研究与试验[J].生物工程学报,2015,31(7):1129-1138.
[5] 朱维耀,夏小雪,郭省学,等.高温高压条件下油藏内源微生物微观驱油机理[J].石油学报,2014,35(3):528-535..
[6] TAMURA K,DUDLEY J,NEI M,et al.MEGA4:molecular evolutionary genetics analysis(MEGA)software version 4[J].分子生物学进展医学期刊,2008,24(8):1596-1599.
[7] LI G,GAO P,WU Y,et al.Microbial abundance and community compositioninfluenceproductionperformanceinalowtemperature petroleum reservoir[J].Environ Sci Technol,2014,48(9):5336-5344.
[8] CAPORASO J G,GORDON J I.Global patterns of 16s rrna diversity at a depth of millions of sequences per sample[J]. PNAS,2011,108(25):4516-4522.
[9] GAO P,LI G,DAI X,et al.Nutrients and oxygen alter reservoir biochemicalcharactersandenhanceoilrecoveryduring biostimulation[J].World J Microbiol Biotechnol,2013,29(11): 2045-2054.
[10] GAO P,TIAN H,LI G,et al.Microbial diversity and abundance in the Xinjiang Luliang long-term water-flooding petroleum reservoir[J].Microbiologyopen,2015,4(2):332-342.
[11] 曹美娜.新疆油田解烃菌性能分析及内源微生物激活效果评价[D].天津:南开大学,2012.
[12] 伍晓林,赵玲侠,马挺,等.大庆油田聚驱后油藏内源微生物激活剂的筛选和效果评价[J].南开大学学报(自然科学版),2012(4):105-111.
(责任编辑 荀志金)
Enhancement of indigenous microbial flooding by exogenous Bacillus subtilis
LI Yanshu1,LI Yan1,GAO Peike1,DAI Xuecheng2,TIAN Huimei1,LIU Xuelian3,CHANG Ning3,LI Guoqiang1,MA Ting1
(1.Key Laboratory of Molecular Microbiology and Technology of the Ministry of Education,College of Life Sciences,Nankai University,Tianjin 300071,China;2.Institute of Experiment and Detection,Xinjiang Oil Field Company,Karamay 834000,China;3.The 1stWorking District,Second Oil Production Plant,Daqing Oil Field Limited Company,Daqing 150000,China)
We used Bacillus subtilis M15-10-1 as the research object.Bacillus subtilis M15-10-1 is separated from the reservoir environment and can produce lipopeptide.We explored the exogenous surfactant producing bacteria to strengthen endogenous microbial flooding reservoirs in the process of crude oil emulsion dispersion effect and the interaction among bacterial flora.Compatibility experiments showed that Bacillus subtilis M15-10-1 and the oil reservoir functional bacteria,Dietzia sp.ZQ-4,Rhodococcus sp.M,and Enterobacter cloacae T-1 has good compatibility.Fluorescence quantitative PCR and high-throughput sequencing analysis showed that Bacillus subtilis M15-10-1 was the structure of reservoir indigenous microorganism without adverse impact.Activation experiment in laboratory and meteorological chromatography analysis showed that Bacillus subtilis M15-10-1 could significantly improve the oil water activation in early oil phase emulsifying dispersion effect and promote the petroleum hydrocarbon degradation.This method provides the foundation for subsequent field test.
Bacillussubtilis;bio-augmentation;indigenousmicro-organisms;microbialflooding;oil emulsification
TE3
A
1672-3678(2016)03-0046-07
2016-02-04
国家高技术研究发展计划(863计划)(2013AA064402);国家自然科学基金(41373074)
李燕淑(1991—),女,河北雄县人,研究方向:石油微生物;马 挺(联系人),教授,E-mail:tingma@nankai.edu.cn
