鼠李糖脂产生菌M7-6在模拟油藏条件下的培养基优化
2016-09-07郑甜甜史荣久韩斯琴崔庆峰
郭 超,赵 峰,郑甜甜,史荣久,韩斯琴,崔庆峰,张 颖
(1.中国科学院沈阳应用生态研究所污染生态与环境工程重点实验室,辽宁沈阳110016;2.中国科学院大学,北京100049;3.中国石油勘探开发研究院廊坊分院渗流流体力学研究所,河北廊坊065007)
鼠李糖脂产生菌M7-6在模拟油藏条件下的培养基优化
郭超1,2,赵峰1,郑甜甜1,2,史荣久1,韩斯琴1,崔庆峰3,张颖1
(1.中国科学院沈阳应用生态研究所污染生态与环境工程重点实验室,辽宁沈阳110016;2.中国科学院大学,北京100049;3.中国石油勘探开发研究院廊坊分院渗流流体力学研究所,河北廊坊065007)
基于已筛选出的鼠李糖脂产生菌M7-6,在模拟油藏条件(温度、pH、矿化度及缺氧)下,对该菌株的激活剂配方进行了碳源、氮源、碳氮比(C/N)、无机盐等因素的优化,并考察了该菌株在模拟油藏条件下的最佳接种量;利用厌氧发酵罐对菌株M7-6进行了扩大培养,评价菌M7-6的原位代谢活性及与其他微生物类群的竞争作用。结果表明:以甘油为碳源、硝酸盐为氮源、C/N为14.4∶1时,最利于菌株M7-6在模拟油藏条件下生产鼠李糖脂,最小接种量为1%(体积分数)。在厌氧发酵罐中,菌株M7-6可以将培养体系的表面张力降至38.4 mN/m;并且体系中烃降解菌和产酸菌数量有所增加,而硫酸盐还原菌数逐渐减少。
鼠李糖脂;模拟油藏条件;厌氧激活剂;微生物采油
生物表面活性剂是由微生物生产的一类具有表面活性的物质,主要包括糖脂、脂肽以及中性磷脂等[1-4]。生物表面活性剂能有效降低油水界面张力、乳化原油、增溶和改变分子极性,在石油开采领域具有良好的应用潜力[5-8]。目前,关于利用生物表面活性剂进行微生物驱油(microbial enhanced oil recovery,MEOR)的实验室模拟研究和现场研究,已有大量文献报道[9-13]。
研究报道的生物表面活性剂产生菌绝大多数为好氧菌,在油藏缺氧环境下无法生存或不能产表面活性剂[14]。在微生物采油应用中,或者在地面发酵生产表活剂产品,或者需要向地下注入空气来维持其原位合成代谢活性,都存在成本高、操作性差、效果不稳定等问题[15],限制了好氧表面活性剂产生菌的应用。而厌氧表面活性剂产生菌能够在缺氧条件下产生表面活性剂,如果实现将菌种及其营养液注入油藏,使该微生物在油藏原位条件下生产表面活性剂来提高原油采收率,将在微生物采油应用中具有更广阔的应用前景[16]。
针对目标油藏,在模拟油藏条件(温度、pH、矿化度及缺氧)下,对厌氧表面活性剂产生菌进行培养基优化,可以提高菌株在油藏原位的表面活性剂产量,进而增强菌株的驱油效率。本研究中,笔者以实验室筛选的厌氧产鼠李糖脂表面活性剂的菌株M7-6为研究对象,在模拟新疆油田油藏条件下,对菌株M7-6的营养激活剂配方进行筛选与优化。利用厌氧发酵罐对菌株M7-6进行扩大培养,评价其最优培养基,并监测厌氧发酵罐中特定功能微生物类群及数量变化,为基于该菌株的微生物驱油现场试验提供室内评价数据。
1 材料与方法
1.1材料
1.1.1菌株
铜绿假单胞菌(Pseudomonas aeruginosa)M7-6由笔者所在重点实验室分离和保存,该菌株能够在厌氧条件下生产鼠李糖脂。
1.1.2培养基
1)基础厌氧培养基(g/L)[17]:甘油46.55、NaNO33.00、K2HPO4·3H2O 5.25、KH2PO45.71、MgSO4·7H2O 0.40、CaCl20.13、KCl 1.0,NaCl 1.0、酵母提取物2.69,所用水为油田采出水。
2)计数用培养基
①硫酸盐还原菌培养基(g/L):乳酸钠4.0、酵母膏1.0、MgSO4·7 H2O 0.2、NaCl 10.0、KH2PO40.5、维生素C 0.1。
②产酸菌培养基:蛋白胨10 g/L、NaCl 5 g/L、葡萄糖10 g/L、乳糖10 g/L、蔗糖10 g/L、2 g/L溴甲酚紫1~2 mL;pH 7.2~7.3,固体培养基加入琼脂。
③烃降解菌培养基(g/L):尿素1.0、KNO31.0、NH4Cl 1.0、KH2PO42.0、Na2HPO43.0、MgSO4·7H2O 0.2、CaCl20.01,FeSO4·7H2O 0.01;每升培养基中加微量元素液9 mL、维生素液5 mL。
3)菌体活化培养基选用LB液体培养基。
1.1.3主要仪器
Biofuge Primor型低温离心机,美国Thermo公司;GNP-9080型恒温培养箱,上海精宏实验设备有限公司;FLC-3型超净工作台,哈尔滨市东联公司;ZDX-35BI型座式自动电热压力蒸汽灭菌器,上海申安医疗器械厂;HZQ-X100型恒温振荡培养箱,太仓市实验设备厂;BZY-1型全自动表面张力仪,上海衡平仪器仪表厂;360EMC型厌氧发酵罐,英国Electrolab公司。
1.2方法
1.2.1测定方法与种子液制备
微生物计数方法:采用平板涂布计数法和最大或然数(most probable number,MPN)计数法[18-19]。菌体干质量测定方法:将样品在5 000 r/min条件下离心10 min后,收集菌体,将其干燥至恒质量,称量。表面张力测定:样品5 000 r/min条件下离心10 min后,上清液的表面张力值利用BZY1型全自动表面张力仪进行测定。
1.2.2碳源优化
选取葡萄糖、甘油、蔗糖、糖蜜、大豆油等常用碳源进行评价[17]。以基础厌氧培养基为初始发酵培养基,进行碳源的单因素分析实验。分别取含有不同碳源的培养基18 mL接入到25 mL厌氧管中,将菌株M7-6种子液离心,等体积生理盐水重悬后,以5%(体积分数)的接种量接入厌氧管中。每个实验组合设3个平行,实验数据取三者的平均值。厌氧管于39℃下静置培养7 d后,取样测定其排油圈直径与表面张力,确定最佳碳源。
1.2.3氮源优化
基于笔者实验室前期研究成果[15-17],分别以玉米浆粉、NaNO3、蛋白胨为待考察氮源,进行氮源优化实验。利用上述获得的最佳碳源作为碳源,分别使用以上氮源代替基础厌氧培养基中原有氮源,其他成分不变。将18 mL含不同氮源的培养基分装到25 mL的厌氧管中;其他处理同碳源优化。7 d后取样并测定其排油圈直径和表面张力,确定最佳氮源。
1.2.4碳氮比的选择
在最佳碳源和最佳氮源确定之后,将已获得的最佳碳源和最佳氮源,设置4∶1、8∶1、12∶1、14.4∶1、16∶1、20∶1、25∶1和30∶1的质量比例组合,在模拟油藏条件(温度、pH、矿化度及缺氧)下,筛选菌株生产鼠李糖脂的最适碳氮比。将8种不同碳氮比的培养基各取18 mL加入25 mL厌氧管中;接种5% M7-6菌体的生理盐水重悬液,并设定3组平行,39℃下厌氧静置培养,7 d后取样测定其排油圈直径与表面张力,确定最适碳氮比。
1.2.5最适无机盐
在确定最佳碳源、氮源及碳氮比后,研究2种无机盐缓冲对(钠盐缓冲对、钾盐缓冲对)以及MgSO4的有无对菌株M7-6在模拟油藏条件(温度、pH、矿化度及缺氧)下产鼠李糖脂的影响。设置实验组A(无钠、钾缓冲对)、B(Na2HPO4与NaH2PO4缓冲对)和C(K2HPO4与KH2PO4缓冲对)3组缓冲对实验。确定最佳无机盐缓冲体系后,其他成分不变;又设置实验组D(不添加MgSO4)和E(添加MgSO4)2组实验。接种量与培养条件等同碳源优化,培养第7天后,取样测定排油圈直径和表面张力,确定最适缓冲对以及MgSO4的取舍。
1.2.6最佳接种量的选择
用新疆油田采出水配制以上获得的最佳培养基,在模拟油藏条件(温度、pH、矿化度及缺氧)下,研究不同接种量对菌株M7-6产鼠李糖脂的影响,分别设置接种量为0.001%、0.01%、0.1%、1%和5%(体积分数)的5组实验,39℃下厌氧静置培养7 d后,取样测定各实验组的排油圈直径和表面张力,确定最适接种量。
1.2.7发酵罐试验
以新疆油田采出水配制上述获得的最优培养基4 L,在6 L的厌氧发酵罐中对鼠李糖脂产生菌株M7-6进行扩大培养,评价该菌株的最优培养基。培养的温度设为39℃,培养周期为15 d,每天取样测定菌体干质量、表面张力、排油圈直径和发酵液的原油乳化效果。在培养的第7天和第15天,测定硫酸盐还原菌、产酸菌和烃降解菌等与采油密切相关菌群的变化,从而了解菌株M7-6的竞争能力及所获得的最优培养基对本源功能微生物的激活情况。
鼠李糖脂产量测定方法[20]:将2 mL样品在5 000 r/min条件下离心10 min后,取上清液10 μL,测定其排油圈直径,以排油圈直径作为鼠李糖脂产量的间接表征。乳化性能测定[21]:取3 mL原油和3 mL菌株M7-6厌氧发酵液加入到带刻度试管中,涡旋振荡2 min,静置24 h,测定乳化系数EI24: EI24=(有机相高度/混合物总高度)×100%。
M7-6种子液制备:在已灭菌的超净工作台中,使用接种环,从M7-6菌株的斜面上,刮取一环M7-6菌体,并接种到装有100 mL已灭菌LB液体培养基的250 mL锥形瓶中,在恒温振荡培养箱中,在39℃、180 r/min条件下好氧培养24 h。
2 结果与讨论
2.1碳源对M7-6厌氧产鼠李糖脂的影响
考察不同碳源对M7-6厌氧发酵产鼠李糖脂的影响,结果如图1所示。由图1可知:以甘油为碳源,菌株M7-6可将发酵液表面张力从64.9 mN/m降至32.7 mN/m,是所考察的6种碳源中表面张力降低幅度最大的。然而,甘油和大豆油的排油圈直径均明显高于其他碳源,排油圈直径可以间接地反映菌株M7-6的鼠李糖脂产量。但是,以大豆油为碳源时,表面张力降低并不明显,并且大豆油与原油具有相似相容特性,所以,在取样过程中取出的少许大豆油残余会对后续排油圈直径的测定有很大的影响,导致排油圈直径偏大。此外,大豆油为疏水性碳源,在培养基中溶解不均匀,缺氧条件下也不易于菌体的吸收利用。然而,甘油可以与水以任意配比互溶,且菌体利用效率高,菌体对甘油的代谢也不受溶解氧的限制[22-23]。因此,甘油更利于菌株M7-6在缺氧条件下代谢生产鼠李糖脂。后续实验中选择甘油作为菌株M7-6在模拟油藏条件下生产鼠李糖脂的碳源。

图1 碳源对菌株M7-6厌氧产鼠李糖脂的影响Fig.1 Effects of carbon source on anaerobic production of rhamnolipid by strain M7-6
2.2氮源对M7-6厌氧产鼠李糖脂的影响
考察不同氮源对M7-6厌氧产鼠李糖脂的影响,结果见图2。由图2可以看出:以NaNO3作为氮源时,菌株M7-6发酵液表面张力下降幅度最大,可从60 mN/m下降至27 mN/m。考察的3种氮源中,以NaNO3为氮源的发酵液排油圈直径最大,达到了15 mm。在模拟油藏条件(温度、pH、矿化度及缺氧)下,缺氧导致菌体为了生长代谢,而进行厌氧呼吸。硝酸盐可以作为细菌在厌氧条件下生长代谢的电子受体,维持菌株在厌氧条件下的生长和生产鼠李糖脂。因此,以硝酸盐为氮源时,发酵液的表面张力降低幅度最大,且排油圈直径也最大。并且,也有很多文献报道硝酸盐是生物表面活性剂生产的最优氮源[24-26]。综合上述因素,选择NaNO3作为菌株M7-6在模拟油藏条件下生产鼠李糖脂的最适氮源。
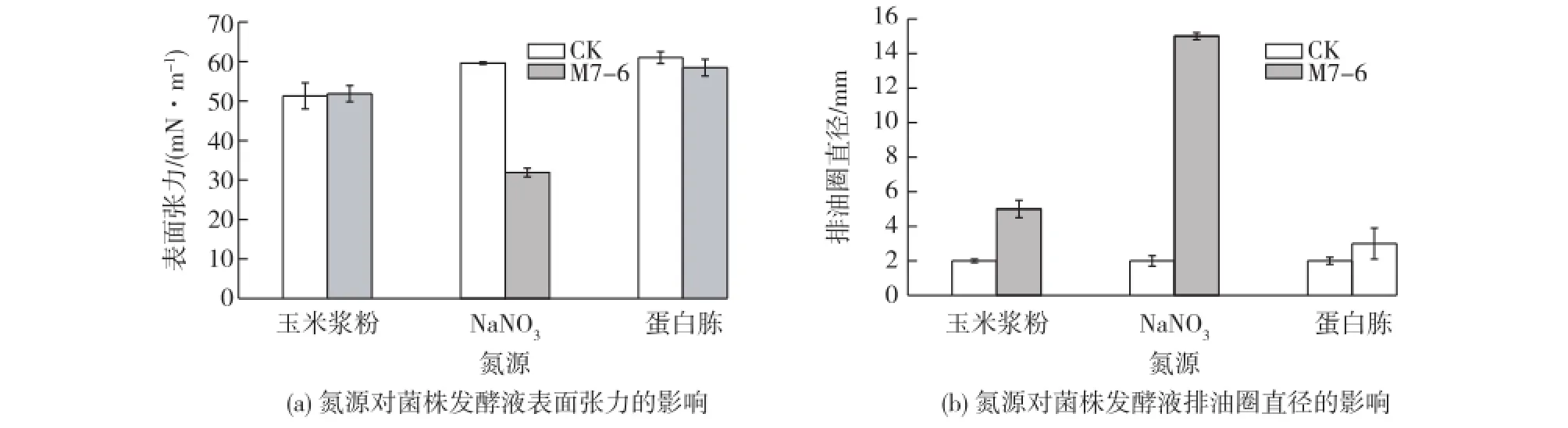
图2 氮源对菌株M7-6厌氧产鼠李糖脂的影响Fig.2 Effects of nitrogen source on anaerobic production of rhamnolipid by strain M7-6
2.3碳氮比(C/N)选择
以甘油和NaNO3为最优碳源和氮源,进行了菌株M7-6培养基的碳氮比优化,结果如图3所示。由图3可以看出,当C/N为14.4∶1时,菌株M7-6可将发酵液的表面张力降至30 mN/m以下,并且排油圈直径可以达到30 mm。在此基础上继续增加氮源的量(减小碳氮比),菌株产鼠李糖脂的变化幅度并不明显。合适的C/N对鼠李糖脂的合成具有重要的调节作用。据文献[27-28]报道,限制氮源,更利于鼠李糖脂的生产。培养基中氮源被耗尽时,由氮决定的生物合成便受到限制,然而,碳源仍可以源源不断地运入细胞内部,用于生物合成次生代谢产物鼠李糖脂[28]。但是,在厌氧条件下,菌体的生长代谢需要一定量的硝酸盐(氮源)作为电子受体。因此,对于厌氧产鼠李糖脂来说,氮源的量既不能太高,也要满足菌体厌氧呼吸的需要。综上所述,选择14.4∶1作为菌株M7-6在模拟油藏条件(温度、pH、矿化度及缺氧)下的最优碳氮比。
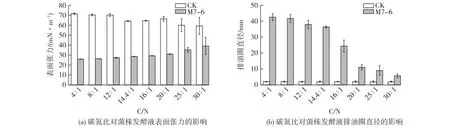
图3 碳氮比对菌株M7-6厌氧产鼠李糖脂的影响Fig.3 Effects of the C/N ratio on anaerobic production of rhamnolipid by strain M7-6
2.4无机盐的优化
为进一步简化所获得的培养基,在上述研究的基础上,进行了无机盐优化实验,结果如图4所示。由图4可知:Na2HPO4与NaH2PO4缓冲对在表面张力降低和鼠李糖脂产量方面都略好于K2HPO4与KH2PO4缓冲对,可能是Na+对菌株产生鼠李糖脂的过程更有利一些,且两者的价格相当,所以,选择Na2HPO4与NaH2PO4缓冲对作为最适的无机盐缓冲对。由图4还可以看出,MgSO4·7H2O的添加与否对表面张力影响较小,二者的表面张力值均在30 mN/m以下。但是,对鼠李糖脂的产量有较大的影响,两者的排油圈直径差值达到了19 mm,这说明MgSO4·7H2O是菌株生产鼠李糖脂的关键因子,不可简化。

图4 无机盐对菌株M7-6厌氧产鼠李糖脂的影响Fig.4 Effects of mineral salt on anaerobic production of rhamnolipid by strain M7-6
2.5接种量对M7-6的影响
除培养基外,接种量的大小同样是影响菌株发酵效果的重要因素之一,接种量对M7-6厌氧产鼠李糖脂的影响结果见图5。由图5可知:接种量为0.001%和0.01%的实验组,既没有明显的表面张力降低,也没有较好的鼠李糖脂产量。说明在较低的接种量下,菌株M7-6的生长差,产生鼠李糖脂较少。接种量为0.1%的实验组在鼠李糖脂产量和表面张力降低方面有较大提升,但距离预期值仍有一定差距。接种量为1%和5%的实验组表面张力可降至30 mN/m以下,且鼠李糖脂产量明显优于0.1%接种量的实验组,排油圈直径可达30 mm。由于接种量为1%和5%的实验组之间的鼠李糖脂产量相当,考虑到经济因素,选取1%作为菌株M7-6在模拟油藏条件下产鼠李糖脂的最适接种量。
2.6厌氧发酵罐的扩大培养
结合以上实验,最终确定菌株M7-6在模拟油藏条件(温度、pH、矿化度及缺氧)下的最优培养基配方(g/L):甘油70.3、NaNO34.87、Na2HPO4·3H2O 6.9、NaH2PO45.49和MgSO4·7H2O 0.4。菌株的最小接种量为1%。基于以上数据,对菌株M7-6进行了厌氧发酵罐的扩大培养实验,结果见图6。
由图6可知:发酵液的表面张力在第5天达到了最低值38.4 mN/m,但并未达到在厌氧管中的效果,可能是因为培养体系扩大之后,对菌体造成了一些不稳定影响,例如:热量传递和质量传递慢,局部位置更容易形成与整体不同的微环境等因素,都可能对菌株产生鼠李糖脂有不利影响。
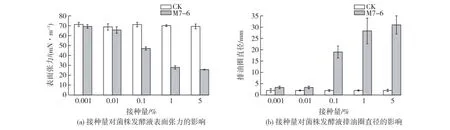
图5 接种量对M7-6厌氧产鼠李糖脂的影响Fig.5 Effects of the inoculum amount on anaerobic production of rhamnolipid by strain M7-6
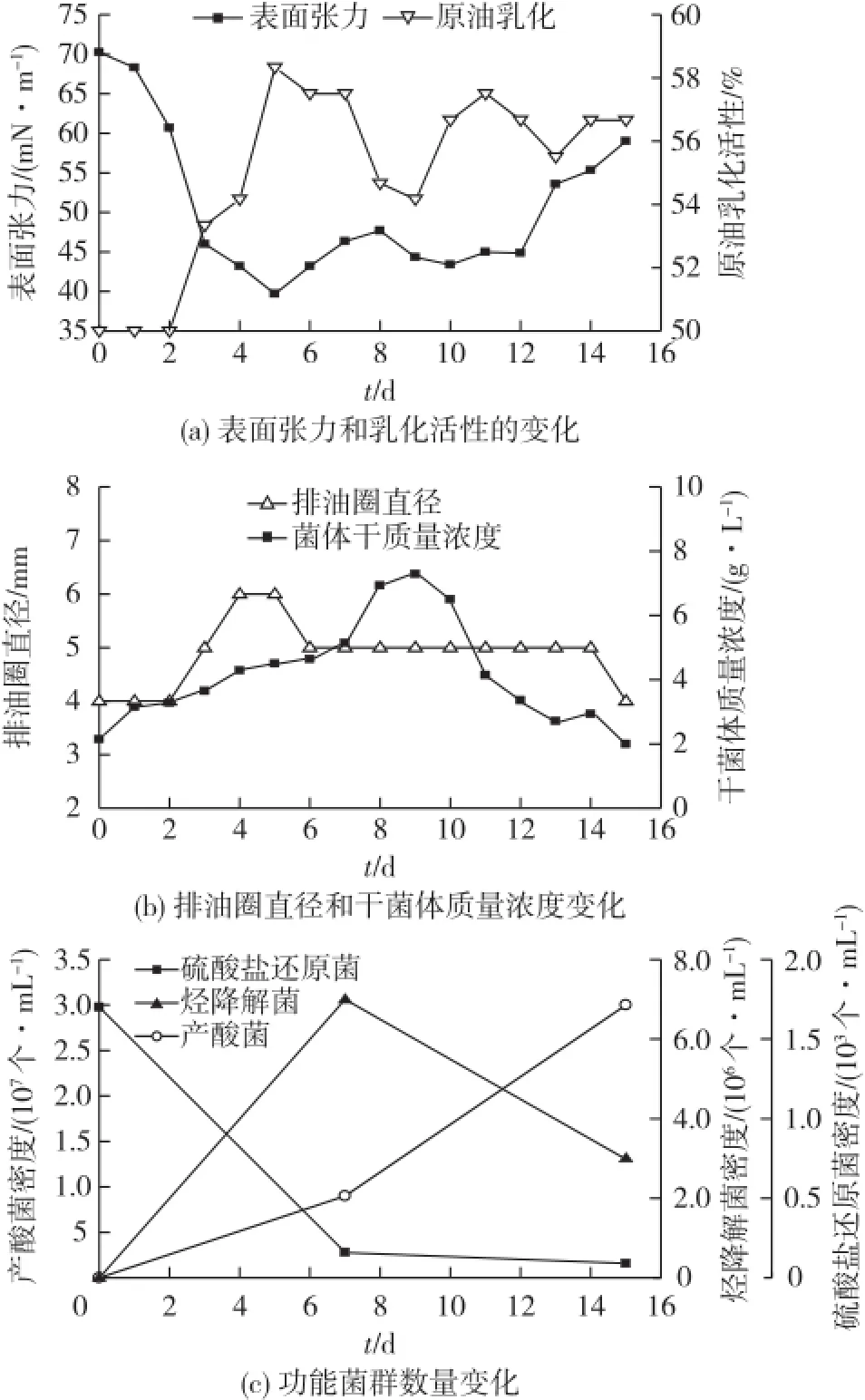
图6 菌株M7-6在厌氧发酵罐中的生长代谢Fig.6 Growth and metabolism of strain M7-6 in the anaerobic fermenter
在第5天,发酵液的鼠李糖脂产量达到最高值,且原油乳化指数达到了60%,说明在扩大培养之后,菌株M7-6仍有较好的驱油潜力。Ghojavand等[29]从伊朗的一油井盐水样品中分离出一株菌,在厌氧条件下产脂肽类表活剂,对烃类物质的乳化系数EI24为53%~70%;王靖等[30]从含油土样中筛选出一株铜绿假单胞菌,其产生的鼠李糖脂类表面活性剂对几种碳氢化合物的EI24为60%~70%。表明菌株M7-6发酵液也具有良好的乳化活性。
此外,通过对培养过程中的菌群计数发现,采油相关有益功能菌(产酸菌和烃降解菌)的数量有显著的上升(P<0.05),由102升至106~107个/mL。有害功能菌(硫酸盐还原菌)的数量略有降低,由103降至102个/mL。功能菌群计数结果表明,所获得的最优培养基在模拟油藏条件下可以激活有益的油藏本源功能微生物。综上所述,说明菌株M7-6对油藏原位采油具有重大应用潜力。
3 结论
以鼠李糖脂产生菌M7-6为研究对象,在模拟油藏条件(温度、pH、矿化度和缺氧)下进行了培养基配方的优化。最优培养基配方(g/L)为甘油70.3、NaNO34.87、Na2HPO4·3H2O 6.9、NaH2PO45.49和MgSO4·7H2O 0.40。菌株M7-6在此培养基中高效生产鼠李糖脂的最适接种量为1%。用此培养基配方对菌株M7-6进行了发酵罐的扩大培养,菌株M7-6可以将培养体系的表面张力降至38.4 mN/m;发酵罐中的有益功能菌(烃降解菌、产酸菌)丰度有所增加,而有害功能菌(硫酸盐还原菌)在不断减少。该研究结果为菌株M7-6的油田现场应用提供了参考数据。
[1] 张金秋.生物表面活性剂对稠油化学降黏增效作用的研究[J].精细石油化工进展,2014,16(1):36-40.
[2] 赵国文,张丽萍,白利涛.生物表面活性剂及其应用[J].日用化学工业,2010,40(4):293-295.
[3] 杜瑾,郝建安,张晓青,等.微生物合成鼠李糖脂生物表面活性剂的研究进展[J].化学与生物工程,2015,32(4):5-11.
[4] 李俊峰,刘丽.脂肽类生物表面活性剂的研究进展[J].化学与生物工程,2015,32(1):12-15.
[5] 吴柏志,李宜强.PBS菌的趋化性与提高原油采收率理解[J].环境科学,2005,26(5):132-136.
[6] 赵玲莉,高雁,张涛,等.微生物驱油技术在克拉玛依油田的应用[J].石油化工应用,2015,34(9):40-42.
[7] 王冠,崔延杰,张凯,等.弱凝胶驱后高含水稠油油藏微生物提高采收率技术研究及应用[J].长江大学学报(自科版),2015,12(11):74-79.
[8] 班允赫,张潆月,史荣久,等.一株快速产脂肽解淀粉芽孢杆菌的筛选及其产物特性[J].生态学杂志,2015,34(6): 1682-1688.
[9] 张清军,张敏,王京秀,等.稠油污水原位升级达标现场试验研究[J].化学与生物工程,2013,30(8):63-69.
[10] 冯海柱,程武刚,陈刚,等.生物表面活性剂提高采收率技术室内研究[J].当代化工,2015,44(2):243-244.
[11] 汪卫东,汪竹,耿雪莉,等.美国微生物采油技术现场应用效果分析[J].油气地质与采收率,2002,9(6):75-76.
[12] 乐建君,于盛鸿,崔长海,等.低渗透油田微生物采油现场试验研究[J].精细石油化工进展,2004,5(2):13-15.
[13] 伍晓林,赵玲侠,乐建君,等.大庆油田聚驱后油藏内源微生物激活剂的筛选和效果评价[J].南开大学学报(自然科学版),2012,45(4):105-110.
[14] 梁小龙,赵峰,史荣久,等.原生质体融合构建高效产脂肽工程菌[J].中国生物工程杂志,2014,34(11):76-84.
[15] 赵峰.厌氧产鼠李糖脂S2-氧化工程菌的构建及微生物驱油潜力评价[D].北京:中国科学院大学,2013.
[16] ZHAO F,SHI R,ZHAO J,et al.Heterologous production of Pseudomonas aeruginosa rhamnolipid under anaerobic conditions for microbial enhanced oil recovery[J].J Appl Microbiol,2015,118(2):379-389.
[17] ZHAO F,MANDLAA M,HAO J,et al.Optimization of culture medium for anaerobic production of rhamnolipid byrecombinant Pseudomonas stutzeri Rhl for microbial enhanced oil recovery[J]. Lett Appl Microbiol,2014,59(2):231-237.
[18] 李万峰,颜学军.大肠菌群最大可能数(MPN)的数学推导与计算机程序的应用[J].中国现代医学杂志,2009,19(6): 923-925.
[19] 刘淑艳,马惠蕊,蒋丹,等.最可能数的精确计算及其在食品微生物检验中的应用[J].中国卫生统计,201l,28(10): 516-519.
[20] YOUSSEF N H,DUNCAN K E,NAGLE D P,et al.Comparison of methodstodetectbiosurfactantproductionbydiverse microorganisms[J].J Microbiol Methods,2004,56:339-347.
[21] 孙琳,蒲万芬,吴雅丽.表面活性剂高温乳化性能研究[J].油田化学,2011,28(3):275-279.
[22] ZHAO F,ZHANG J,SHI R,et al.Production of biosurfactant by a Pseudomonas aeruginosa isolate and its applicability to in situ microbial enhanced oil recovery under anoxic conditions[J].RSC Adv,2015,45(5):36044-36050.
[23] 顾生辉,朱莉,詹晓北,等.以甘油为底物鼠李糖脂高产菌株的诱变选育[J].生物加工过程,2015,13(1):54-59.
[24] 孙全莲.铜绿假单胞菌的筛选及产鼠李糖脂发酵条件的研究[D].西安:西北大学,2014.
[25] 夏文杰,董汉平,俞理.鼠李糖脂发酵条件优化和采油应用研究[J].深圳大学学报(理工版),2010,27(4):482-489.
[26] 梁生康,王修林,单宝田.假单胞O-2-2利用油脂废水生产鼠李糖脂研究[J].现代化工,2005,25(增刊1):192-196.
[27] WU J Y,YEH K L,LU W B,et al.Rhamnolipid production with indigenous Pseudomonas aeruginosa EM1 isolated from oilcontaminated site[J].BioresourTechnol,2008,99(5): 1157-1164.
[28] SOBERON-CHAVEZ G,LEPINE F,DEZIEL E.Production of rhamnolipids by Pseudomonas aeruginosa[J].Appl Microbiol Biotechnol,2005,68(6):718-725.
[29] GHOJAVAND H,VAHABZADEHF,AZIZMOHSENIF.A halotolerant,thermotolerant,andfacultativebiosurfactant producer:identificationandmolecularcharacterizationofa bacterium and evolution of emulsifier stability of a lipopeptide biosurfactant[J].Biotechnol Bioproc Eng,2011,16:72-80.
[30] 王靖,章厚名,安明泉,等.高效产表面活性剂菌株(Lz2-1)的筛选及其特性研究[J].石油化工高等学校学报,2009,23(3):33-36.
(责任编辑 荀志金)
Optimization of culture medium for rhamnolipid producing bacterial strain M7-6 under simulated oil reservoirs conditions
GUO Chao1,2,ZHAO Feng1,ZHENG Tiantian1,2,SHI Rongjiu1,HAN Siqin1,CUI Qingfeng3,ZHANG Ying1
(1.Key Laboratory of Pollution Ecology and Environmental Engineering,Institute of Applied Ecology,Chinese Academy of Sciences,Shenyang 110016,China;2.University of Chinese Academy of Sciences,Beijing 100049,China;3.Institute of Porous Flow&Fluid Mechanics,PetroChina Research Institute of Exploration and Development(Langfang),Langfang 065007,China)
Based on a rhamnolipid producing bacterial strain Pseudomonas aeruginosa M7-6,medium(carbon source,nitrogen source,C/N ratio,and mineral factors)was optimized for efficiently producing rhamnolipid under simulated oil reservoir conditions(temperature,pH and absence of oxygen).Using the optimized medium,effect of different inoculums amount on anaerobic production of rhamnolipid by M7-6 was studied.Strain M7-6 was cultured in a 6-L anaerobic fermentor using oilfield production water to prepare medium,to evaluate the rhamnolipid production by M7-6 under simulated conditions and study the competitive activity of M7-6 with other native microorganisms.M7-6 could efficiently produce rhamnolipid under simulated conditions with glycerol as carbon source and nitrate as nitrogen source.Theoptimum C/N ratio is 14.4∶1,and the least inoculums amount is 1%(V/V).Strain M7-6 can reduce surface tension of culture system to 38.4 mN/m in the anaerobic fermenter.Moreover,the numbers of oil degrading bacteria and acid producing bacteria were increased,and the number of sulfate reducing bacteria was decreased.
rhamnolipid;simulated oil reservoir conditions;anaerobic activator;microbial enhanced oil recovery
10.3969/j.issn.1672-3678.2016.03.013
Q939.97;TE357
A
1672-3678(2016)03-0068-07
2016-01-08
国家高技术研究发展计划(863计划)(2013AA064402)
郭 超(1992—),男,黑龙江伊春人,研究方向:微生物采油;张 颖(联系人),研究员,E-mail:yzhang@iae.ac.cn
