201型不锈钢在酸性食物模拟环境中的腐蚀行为
2016-09-07黄蓉芳李谋成
黄蓉芳,李谋成
(上海大学 材料研究所,上海 200072)
201型不锈钢在酸性食物模拟环境中的腐蚀行为
黄蓉芳,李谋成
(上海大学 材料研究所,上海 200072)
采用沸腾的4%(质量分数,下同)HAc和4% HAc+0.4% NaCl溶液来模拟酸性食物环境,研究了201型Cr-Mn系不锈钢的腐蚀行为与金属元素的溶出特征。电化学阻抗谱、ICP-AES(电感耦合等离子体原子发射光谱)和XPS测量结果表明,试样在这两种模拟环境中均处于钝化腐蚀状态,金属元素铁和锰在浸泡初期会发生优先腐蚀溶出而形成保护性富铬钝化膜;金属元素的稳定溶出速率从大到小顺序为:Fe>Mn>Cr>Ni,但溶出速率值均很小。酸性食物环境中添加适量Cl-对金属元素的稳定腐蚀与溶出速率的作用很小。
不锈钢;酸性食物;醋酸;腐蚀;溶出
不锈钢厨具在食品和饮料行业的应用已有八十多年历史,不锈钢锅、碗、热水壶等用品深受人们喜爱。然而,当其与食物接触时(尤其是食物烹饪时),不锈钢制品可能会腐蚀溶出少量金属离子,过多摄入这些金属离子会危害人体的健康[1]。因此,厨具不锈钢的安全问题引起了社会各界的广泛关注。对于食品用不锈钢,我国标准(GB9684)中以沸腾的4%醋酸(HAc)溶液作为酸性食物模拟环境来评价不锈钢金属元素的腐蚀溶出性能。Herting等研究了430铁素体不锈钢和420马氏体不锈钢在模拟食物溶液(3% HAc)中的腐蚀行为,发现合金元素在浸泡初始阶段的溶出量相对较大[2-3]。陈惠波等测定了304、410和430等多种不锈钢在4% HAc溶液中的铬溶出量,结果表明不锈钢表面粗糙、溶液温度升高、HAc含量升高都会增加铬元素的溶出量[4]。但是,不锈钢厨具在实际烹饪过程中会经受醋、酱油、食盐等调味料与食物的共同作用,尤其是Cl-的引入会影响不锈钢的钝态性能与金属元素的溶出量[5-6]。显然,未涉及Cl-作用的沸腾醋酸溶液试验方法,难以真实地反映不锈钢锅等厨具的腐蚀特征与金属元素溶出性能。
由于我国镍资源比较缺乏,随着不锈钢产业的快速发展,目前以锰、氮代镍型和节镍型不锈钢得到了应用[7],但是降低镍含量会带来不锈钢耐蚀性下降的风险[5]。Cr-Mn系不锈钢也常被用于制造厨具用品,但文献对其在沸腾的含Cl-醋酸溶液中的腐蚀行为尚鲜有报道。本工作以GB9684标准方法为基础,在沸腾醋酸溶液中引入适量Cl-,对比研究了两种溶液环境中201型不锈钢的腐蚀电化学行为与金属元素溶出特征。
1 试验
1.1试验材料与溶液
试验材料为商用201型不锈钢,其化学成分(质量分数/%)如下:C 0.05,P 0.019,S 0.003,Si 0.43,Cr 16.25,Mn 6.14,Ni 4.23,Cu 1.70。试样尺寸为30 mm×20 mm,用碳化硅水磨砂纸逐级打磨其表面,然后用丙酮擦洗除油,酒精和蒸馏水清洗,热风吹干备用。
测试介质为4% HAc溶液和4% HAc+0.4% NaCl溶液,试验时均保持在沸腾状态,温度约为100 ℃,同时采用冷凝回流装置以防止溶液蒸发损失。每次试验溶液的体积为100 mL。
1.2电化学测量
试验采用三电极体系:工作电极为不锈钢试样,辅助电极为铂片,参比电极为饱和甘汞电极(SCE)。文中电位若无特指,均相对于SCE。试验时,试样半浸泡在沸腾溶液中,于浸泡时间为1,3,5,7,9,11,13 h时进行腐蚀电位与电化学阻抗谱(EIS)测量。测量系统为PAR4000电化学工作站及相应控制软件。EIS谱测试频率范围为10 mHz~99 kHz,测量均在腐蚀电位下进行,交流激励信号幅值为10 mV,测定结果采用ZSimpWin软件进行解析。
1.3金属元素溶出量测量
将试样完全浸泡于沸腾测试溶液中,当浸泡时间达到1,3,5,7,9,11 h时更换新的溶液,并分别取0~1 h、1~3 h、3~5 h、5~7 h、7~9 h、9~11 h、11~13 h时间段的浸泡液10 mL,测量金属元素铁、铬、镍和锰的溶出量,并计算金属元素在相应时间的溶出速率。测量采用7300D-10003491型电感耦合等离子体原子发射光谱(ICP-AES)仪器。
1.4表面分析
取出浸泡13 h后的试样,并用蒸馏水清洗、吹干,然后用ESCALAB 250Xi光电子能谱仪对试样表面钝化膜进行分析。测量前表面溅射5 s以降低污染物的影响。X射线激发源为铝(1 486.6 eV),用碳结合能(284.8 eV)对测得的谱峰进行校正,测试结果用XPSPEAK41进行分析。
2 结果与讨论
2.1腐蚀电位与电化学阻抗谱
由图1可见,不锈钢在两种溶液中的腐蚀电位均随着浸泡时间延长而逐渐升高;但在4% HAc溶液中的腐蚀电位在浸泡3 h后上升速率变得很缓慢,即达到相对稳定的腐蚀状态,浸泡13 h时腐蚀电位为-22 mV;而在4% HAc+0.4% NaCl溶液中的腐蚀电位在浸泡7 h后才达到相对稳定状态,13 h时腐蚀电位为-72 mV。这些结果表明,试样表面在沸腾溶液中均可逐渐形成保护性钝化膜,使得腐蚀电位升高;但是,溶液中添加NaCl会减缓钝化膜的形成与生长,使腐蚀电位达到稳定的时间延长,并导致浸泡13 h时稳定电位值下降约50 mV。
由图2可见,试样在两种溶液中的Nyquist图均由一段曲率半径很大的容抗弧组成,并且两条容抗弧几乎重合在一起,说明它们的曲率半径差别较小。由于腐蚀电位与阻抗值均较高,试样表面钝化膜与电荷转移过程的时间常数差别较小,故而两种溶液中阻抗谱均呈现简单容抗特征,可用等效电路Rs(Qf(Rf(QdlRt)))对图2中阻抗谱进行解析,其中Rs为溶液电阻,Rf和Rt分别为试样表面钝化膜电阻和电荷转移电阻,Qf和Qdl分别为钝化膜电容和双电层电容的常相位元件。电容元件Q的阻抗表达式为:
ZQ=1/[Y0(jω)α]
(1)
式中:Y0为Q导纳的模;α为弥散系数。
表1为该等效电路中各参数的拟合值,表中极化电阻Rp为Rf与Rt之和[8],因在拟合过程中难以将Rf与Rt的值准确地分离,所以表中仅给出Rp值。

表1 EIS等效电路的拟合结果
由表1可见:①无论溶液中是否引入Cl-,不锈钢试样表面均可形成保护性钝化膜,使得极化电阻Rp在13 h浸泡后高达105Ω·cm2,当然Cl-的引入也会使极化电阻降低约20%;②沸腾HAc溶液中添加0.4% NaCl会增强溶液的电导率,使得溶液电阻Rs明显降低;③溶液中引入Cl-使Y0,f与Y0,dl均变大,即钝化膜和双电层电容均增大,根据点缺陷模型[9],这主要与钝化膜吸收溶液中的Cl-而导致钝化膜缺陷增多有关。
2.2试样表面钝化膜的XPS
由图3可见,两种溶液中形成的钝化膜有较强的铁、铬、锰、氧和碳元素响应峰(其中碳来自于污染物),而镍、铜元素响应峰十分微弱。铁和铬响应峰的组成根据文献[10]可知,钝化膜主要由铁、铬的氧化物或/和氢氧化物等物质组成。对于含NaCl的溶液,钝化膜中还检测到氯元素,说明Cl-被吸收进入了钝化膜。
运用CasaXPS软件进行计算可获得钝化膜中金属元素的含量,表2列出了计算得到的原子数比值。为了比较,表中给出了不锈钢基体中金属元素的原子数比值。与钢基体相比,在两种溶液中浸泡13 h后形成的钝化膜具有更低的Fe/Cr和Mn/Cr比,但Mn/Fe的比值却更高。这些数据表明201不锈钢表面的铁和锰在沸腾溶液中发生了优先腐蚀而形成了富铬钝化膜[11],并且铁比锰更易被腐蚀溶解。在4% HAc溶液中添加0.4% NaCl会导致试样表面钝化膜Fe/Cr和Mn/Cr的比值均降低,说明Cl-对不锈钢表面铁和锰的腐蚀溶解具有一定的加速作用[11],尤其是铁因被加速腐蚀而使Mn/Fe的比值从0.20略微升高到0.23,这些结果与表1中Rp值的降低相一致。
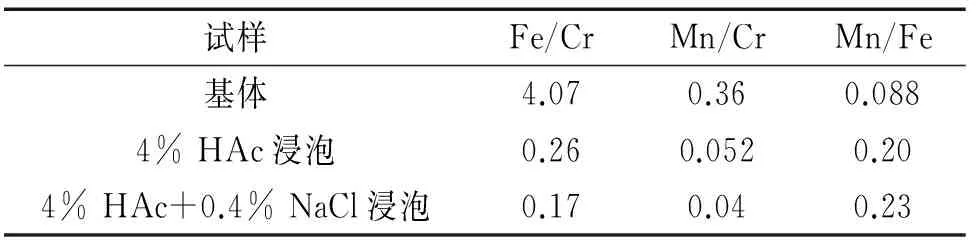
表2 试样基体及浸泡13 h后表面钝化膜的原子数比值
2.3金属元素的溶出速率
由图4可知,各元素在2种溶液中浸泡1 h的溶出速率均较大,尤其是铁和锰,这是因为试样刚浸入溶液时具有新鲜的表面,尚无阻挡金属元素溶出的表面覆盖层。随着浸泡时间的延长,试样表面富铬钝化膜逐渐形成,对各元素的腐蚀溶出均具有抑制作用,使得各元素的溶出速率降低并逐渐趋于稳定。试样在4% HAc溶液中浸泡3 h后,各元素溶出速率基本达到稳定,而在4% HAc+0.4% NaCl溶液中,铁和锰的溶出速率在浸泡7 h时才基本达到稳定,这与图1中腐蚀电位的稳定过程一致。
试样浸泡13 h后,铁、铬、锰和镍元素在4% HAc和4% HAc+0.4% NaCl溶液中的稳定溶出速率分别为依次0.28,0.17,0.20,0.13 μg·cm-2·h-1和0.34,0.17,0.29,0.13 μg·cm-2·h-1。显然,两种溶液中各金属元素的稳定溶出速率的顺序相同,从大到小依次为:Fe>Mn>Cr>Ni,但两种溶液中各元素的溶出速率都很低,钝化膜的生长和溶解基本达到动态平衡状态。此外,溶液中添加0.4% NaCl使得铁和锰的稳定溶出速率稍有增大,但铬和镍的稳定溶出速率几乎没有变化。
由于浸泡初期金属元素的溶出速率相对较高,国家标准(GB9684)采用试样在沸腾溶液中浸泡0.5 h的溶出量作为指标,规定餐/厨具用不锈钢的铬与镍元素溶出量分别小于4,1 μg·cm-2,锰元素溶出量尚未有明确的限定。从图4可见,201型不锈钢经1 h浸泡后,在4% HAc沸腾溶液中的铬与镍元素溶出量分别为0.23,0.17 μg·cm-2,而在4% HAc+0.4% NaCl沸腾溶液中的铬与镍元素溶出量为0.29,0.19 μg·cm-2。由此可知,两种溶液中铬与镍元素的溶出量均远小于标准规定值,说明201型不锈钢在食物环境中具有良好的耐蚀性。
3 结论
(1) 在4% HAc和4% HAc+0.4% NaCl沸腾溶液中,201型Cr-Mn系不锈钢均处于稳定钝化腐蚀状态,其表面能形成保护性富铬钝化膜,使极化电阻达105Ω·cm2。
(2) 两种沸腾溶液中,不锈钢中的金属元素铁和锰在浸泡初期会发生优先腐蚀,其初期溶出速率相对较高,但随浸泡时间延长,腐蚀电位和金属元素的溶出速率均趋于稳定。金属元素的稳定溶出速率从大到小顺序为:Fe>Mn>Cr>Ni,但溶出速率值均很小。
(3) 在4% HAc沸腾溶液中添加0.4% NaCl对不锈钢的初期腐蚀具有较大影响,会促进铁与锰的腐蚀溶出,导致腐蚀电位下降,但腐蚀进入稳定状态后其影响较小,仅使腐蚀电位和极化电阻轻微下降、铁与锰的稳定溶出速率稍有增大,而对铬与镍的稳定溶出过程几乎没有影响。
[1]张卫国,黄秋婵,韦友欢. 浅谈不锈钢餐具与人体健康.微量元素与健康研究[J]. 2008,25(5):60-61.
[2]HERTING G,LINDSTROM D,WALLINDER I O. Multi-analytical investigation of stainless steel grade AISI 420 in simulated food contact[J]. Journal of Food Engineering,2009,93:23-31.
[3]HERTING G,WALLINDER I O,LEYGRAF C. Corrosion-induced release of chromium and iron from ferritic stainless steel grade AISI 430 in simulated food contact[J]. Journal of Food Engineering,2008,87:291-300.
[4]陈惠波,江乙逵,魏敏生. 不锈钢餐厨具中铬离子迁移量的影响因素及质量控制[J]. 现代食品科技,2010,26(2):1309-1313.
[5]庞晋山,邓爱华,彭晓俊,等. 高锰低镍不锈钢在含氯介质中重金属迁移行为研究[J]. 食品与机械,2012,28(5):94-95.
[6]齐达,李晶,董力,等. 节镍型不锈钢的耐腐蚀性能比较[J]. 腐蚀与防护,2010,31(10):756-759.
[7]严旺生. 200系列(锰系)不锈钢发展前景[J]. 中国锰业,2004,22(2):9-12.
[8]XIN S S,LI M C. Electrochemical corrosion characteristics of type 316 stainless steel in hot concentrated seawater[J]. Corrosion Science,2014,81:96-101.
[9]MACDONALD D D. The point defect model for the passive state[J]. Journal of the Electrochemical Society,1992,139(12):3434-3449.
[10]FREDRIKSSON W,MALNGREN S,GUSTAFSSON T. Full depth profile of passive films on 316L stainless steel based on high resolution HAXPS in combination with ARXPS[J]. Applied Surface Science,2012,258:5790-5797.
[11]ALEKSANDRA K,CRTOMIR D,MONIKA J. Electrochemical and XPS studies of the passive film formed on stainless steels in borate buffer and chloride solutions[J]. Corrosion Science,2007(49):2083-2098.
Corrosion Behavior of Type 201 Stainless Steel in Simulated Acidic Food Environment
HUANG Rong-fang, LI Mou-cheng
(Institute of Materials, Shanghai University, Shanghai 200072, China)
The boiling solutions of 4% (mass) HAc and 4% (mass) HAc + 0.4% (mass) NaCl were used to simulate acidic food environments. The corrosion behavior and metallic element release of type 201 Cr-Mn stainless steel were investigated in both solutions. Electrochemical impedance spectroscopy (EIS), ICP-AES (inductively coupled plasma-atomic emission spectrometry) and XPS results indicated that specimens were in passive state. Metallic elements Fe and Mn preferentially dissolved in the initial immersion stage, which resulted in forming protective Cr-rich passive films on specimen surfaces. The steady release rate of metallic elements decreased in the order of Fe>Mn>Cr>Ni, but the rates were very small. An appropriate amount of Cl-had insignificant effect on the steady corrosion and release of metallic elements in the acidic food environment.
stainless steel; acidic food; acetic acid; corrosion; release
10.11973/fsyfh-201601003
2015-01-15
高等学校博士学科点专项科研基金(20133108110019)
李谋成(1970-),博士,研究员,从事腐蚀电化学相关工作,021-56334167,mouchengli@shu.edu.cn
TG172
A
1005-748X(2016)01-0012-04
