血清中骨质疏松相关蛋白分子标志物的筛选研究
2016-09-05赵卓杰胡雅茜杨柳罗卓荆
赵卓杰 胡雅茜 杨柳 罗卓荆
·实验研究论著·
血清中骨质疏松相关蛋白分子标志物的筛选研究
赵卓杰胡雅茜杨柳罗卓荆
目的通过蛋白芯片筛选血清中反映早期绝经后骨质疏松症发生、发展的标志性分子。方法3月龄雌性SD大鼠20只,随机分为卵巢切除(ovariectomized,OVX)组和假手术(sham operation,Sham)组,每组10只,分别进行卵巢去势手术和假手术处理。术后2、4、6、8周对两组大鼠进行活体显微CT扫描,测量股骨远端骨密度及相关松质骨形态计量学动态参数;同时经内眦静脉取血,利用蛋白芯片检测血清中不同蛋白因子的含量。结果显微CT检测结果显示OVX组大鼠骨密度(BMD)、相对骨体积(BV/TV)、骨小梁厚度(Tb.Th)、骨小梁数目(Tb.N)从第4周开始下降,骨小梁分离度(Tb.Sp)开始上升,Sham组未见明显变化;到第8周各指标在OVX组与Sham组之间差异有统计学意义(P<0.05)。蛋白芯片检测结果显示OVX组中干扰素⁃γ(IFN⁃γ)、β神经生长因子(b⁃NGF)分别从术后4周和6周后开始升高,同Sham组比较均至第8周具有明显差异(P<0.05)。结论IFN⁃γ和b⁃NGF水平在绝经后骨质疏松早期开始增高,可考虑作为诊断早期绝经后骨质疏松症发生的新型蛋白分子。
大鼠;骨质疏松;早期诊断;干扰素γ;神经生长因子类
骨质疏松症(osteoporosis,OP)是一种以低骨量和骨组织微结构破坏为特征,以骨质脆性增加为临床表现的全身性骨代谢性疾病[1]。骨质疏松可分为原发性和继发性两类:原发性骨质疏松是指不伴引起本病的其他疾患而发生的骨质疏松,绝经后骨质疏松和老年性骨质疏松是原发性骨质疏松的主要类型;继发性骨质疏松则是指由任何影响骨代谢的疾病、药物或器官移植等引起的骨质疏松。此外,按发生部位亦可分为局限性或泛发性骨质疏松。骨质疏松发病率位于中老年骨科常见病之首[2],我国是骨质疏松患者最多的国家,并且随着人均预期寿命的延长,其发病率将不断上升[3]。骨质疏松不仅是严重危害我国人民健康的公共卫生问题,其高昂的治疗费用也给国家和社会带来沉重的经济负担。因此,加深对骨质疏松发病机理的认识,寻找影响其发病的关键因子,探索可能的早期干预靶点和干预方式,将成为骨质疏松的研究热点。
双能X线骨吸收测量仪(DXA)测定骨密度(BMD)是目前临床诊断骨质疏松的金标准[4],但此方法存在仪器携带困难、检测费用高昂等缺点,其结果只能反映单位投影面积的骨矿盐含量,无法提示骨基质和骨组织的微结构状况,因而无法区分骨质软化、局部骨质破坏和骨质疏松;此外,用骨密度评价治疗反应的周期至少需要半年[5]。因此寻找便捷、经济的骨质疏松检测方法成为目前研究的热点。
蛋白芯片技术是一种高通量、微型化和自动化的蛋白质分型技术,其依据抗原抗体特异性结合的原理,首先以生物素标记样本中的蛋白,然后加入捕获抗体,再加入链亲和素,通过扫描获得荧光值,从而实现对相关蛋白的定量检测[6]。利用蛋白组学技术环磷酰胺(CTX)和Ⅰ型胶原氨基端前肽(PINP)等可作为骨形成和骨吸收特异性标记物的蛋白因子陆续被发现[7]。近年来随着蛋白组学技术的发展,发现了一些新的骨代谢特异性血清标志物,如优先定位于骨膜组织的蛋白骨膜素[8,9]、鞘氨醇-1-磷酸[10]、血清组织蛋白酶K[11]、DKK⁃1[12]、硬化蛋白[13]和FGF⁃23[14],这些生物标志物和绝经后妇女、老年男性骨折风险均有关联。研究表明循环微小RNA也可以作为新的骨质疏松生物标志物[15]。但上述血清标记物在骨质疏松发生早期的变化尚未明确[2]。
本研究选择的RayBiotech蛋白芯片已被应用于临床研究,Huang等[16]曾对卵巢癌人群及正常人群进行血清检测,筛选出6个区分卵巢癌患者和健康人群的生物标志物;Ray等[17]则对阿尔兹海默病组和健康对照组进行血清检测,筛选出18个区分阿尔兹海默病和健康人群的蛋白分子。这都显示利用该蛋白芯片可能筛选出对早期骨质疏松诊断有效的生物标志物。因此,本研究的目的是采用蛋白组学技术筛选绝经后骨质疏松症发病早期血清中含量发生显著性变化的蛋白标志物,为便捷、经济地诊断早期骨质疏松症提供新的可能。
材料与方法
一、实验动物
清洁级3月龄健康雌性SD大鼠20只,体重平均为(293±20)g,由第四军医大学实验动物中心提供。
二、实验仪器
荧光扫描仪(Genepix4100A,Molecular Devices公司,美国)、显微CT(Inveon,Siemens公司,德国)、离心机(55415D,Eppendorf)、-80℃冰箱(DW⁃86L386,海尔,青岛)、电热恒温孵育箱(DPX⁃9052B⁃1,福玛,上海)。
三、试剂
样品稀释液、20×洗液Ⅰ、20×洗液Ⅱ、标准品混合物、检测抗体混合物、Cy3⁃链酶亲和素、玻片清洗干燥器、大鼠细胞因子定量抗体芯片(QAR⁃CYT⁃3),以上物品均由美国RayBiotech公司提供。
四、实验步骤
(一)实验动物分组
本研究的20只SD大鼠按随机表法随机分为卵巢切除(ovariectomized,OVX)组和假手术(sham op⁃eration,Sham)组,每组10只。所有大鼠均在室温20℃~25℃、相对湿度60%~80%的清洁环境中,分笼适应性饲养7 d。
(二)骨质疏松模型建立
OVX组:2%戊巴比妥钠(40 mg/kg)腹腔内注射麻醉,俯卧位固定,常规备皮、消毒,分别在腹背部肋缘下1 cm、脊柱两侧各1.5 cm交界处,切2个约1 cm切口,进入腹腔,寻找并切除双侧卵巢。术后每只大鼠肌注青霉素40万U/d、连续3 d,预防感染。Sham组:不切除双侧卵巢、仅切除卵巢周围等体积的脂肪,其他处理与OVX组相同。
(三)血清样本提取
对两组大鼠于卵巢切除术后2、4、6、8周采用内眦静脉取血法取血1.5 ml存于EP管中,各批血液标本在4℃冰箱内静置4 h后离心5 min(3 000 r/min),提取血清,保存于-80℃冰箱备用。
(四)显微CT检测
卵巢切除术后2、4、6、8周利用显微CT扫描两组活体大鼠股骨。扫描方法:对大鼠采用2%戊巴比妥钠(40 mg/kg)腹腔内注射麻醉,而后固定扫描。扫描结束后,选取股骨远端位置相同体积的感兴趣区域(ROI)、设定骨的阈值(阈值=1 200),利用In⁃veon Research Workplace 2.2软件(Inveon,Siemens公司,德国)进行骨小梁的三维重建及相关结构参数的计算。
(五)蛋白芯片检测
①按照说明书中的方法梯度稀释标准品;②抽取100 μl的样品稀释液作为阴性对照;③向芯片各孔中加入100 μl的样品稀释液,室温震荡孵育1 h以封闭定量抗体芯片;④抽去各孔中的缓冲液,并添加100 μl样品,4℃震荡孵育过夜;⑤按说明书中的方法对各孔进行清洗,离心检测抗体混合物小管,然后加入1.4 ml样品稀释液,混合均匀后快速离心;⑥各孔添加80 μl检测抗体,室温震荡孵育2 h;⑦清洗各孔后,向各孔中添加80 μl Cy3⁃链霉亲和素,室温条件下避光、震荡孵育1 h;⑧清洗各孔后,将芯片放置于芯片清洗管中,添加30 ml洗液Ⅰ,室温震荡15 min,弃去洗液Ⅰ,添加30 ml洗液Ⅱ,室温震荡5 min;⑨去除洗液,将芯片放置于芯片干燥管中,按1 000 r/min离心3 min;⑩利用荧光扫描仪获取信号,QAR⁃CYT⁃3的数据分析软件进行数据分析。
五、统计学分析
采用SPSS 13.0软件(SPSS公司,美国)进行统计学分析,所有计量数据均用表示。OVX组与Sham组间的骨密度、松质骨形态计量学动态参数和蛋白芯片结果比较均采用单因素重复测量数据方差分析;OVX组大鼠骨密度与阳性因子采用相关性分析。P<0.05差异具有统计学意义。
表1 OVX组与Sham组大鼠各时间点股骨远端BMD值,mg/cm2)

表1 OVX组与Sham组大鼠各时间点股骨远端BMD值,mg/cm2)
注:与同时间点的Sham组比较*P<0.05;组内与第2周末比较△P<0.05
组别OVX组Sham组n 10 10 2周末453.7±3.7 457.3±3.8 4周末396.3±4.0*△457.7±2.5 6周末385.0±2.0*△458.3±3.5 8周末335.7±4.1*△456.0±5.3
表2 OVX组与Sham组大鼠各时间点松质骨形态计量学动态参数情况)
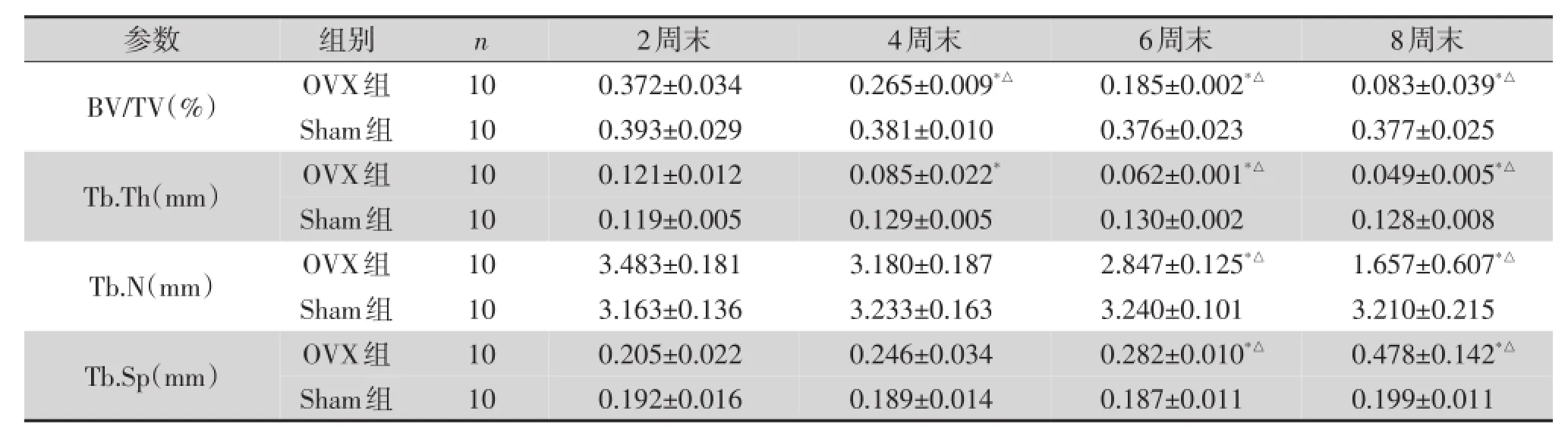
表2 OVX组与Sham组大鼠各时间点松质骨形态计量学动态参数情况)
注:与同时间点的Sham组比较*P<0.05;组内与第2周末比较△P<0.05
参数BV/TV(%)Tb.Th(mm)Tb.N(mm)Tb.Sp(mm)组别OVX组Sham组OVX组Sham组OVX组Sham组OVX组Sham组n 10 10 10 10 10 10 10 10 2周末0.372±0.034 0.393±0.029 0.121±0.012 0.119±0.005 3.483±0.181 3.163±0.136 0.205±0.022 0.192±0.016 4周末0.265±0.009*△0.381±0.010 0.085±0.022*0.129±0.005 3.180±0.187 3.233±0.163 0.246±0.034 0.189±0.014 6周末0.185±0.002*△0.376±0.023 0.062±0.001*△0.130±0.002 2.847±0.125*△3.240±0.101 0.282±0.010*△0.187±0.011 8周末0.083±0.039*△0.377±0.025 0.049±0.005*△0.128±0.008 1.657±0.607*△3.210±0.215 0.478±0.142*△0.199±0.011
结果
一、骨密度与松质骨形态计量学动态参数检测
卵巢切除后2、4、6、8周四个时间点对各组大鼠股骨进行扫描,如表1所示,OVX组大鼠骨密度从第4周开始逐渐减少,BMD值为(396.3±4.0)mg/cm2,第8周明显降低,BMD值为(335.7±4.1)mg/cm2(图1);Sham组未见明显变化(图2)。OVX组与Sham组相比骨密度下降差异具有统计学意义(P=0.012,图3)。另外,如表2所示,OVX组大鼠松质骨形态计量学动态参数在相对骨体积(BV/TV)(P=0.000)、骨小梁厚度(Tb.Th)(P=0.001)、骨小梁数目(Tb.N)(P= 0.014)较Sham组均有降低;OVX组大鼠骨小梁分离度(Tb.Sp)较Sham组明显增高(P=0.037,图4)。
二、蛋白芯片结果
蛋白芯片共检测6个蛋白分子,包括干扰素γ (IFN⁃γ)、B神经生长因子(b⁃NGF)、白细胞介素1b (IL⁃1b)、白细胞介素4(IL⁃4)、肿瘤坏死因子a(TN⁃Fa)、血管内皮生长因子(VEGF)等。如表3所示,OVX组大鼠血清中b⁃NGF浓度从第6周开始升高,到第8周升高显著,与Sham组相比差异有统计学意义(P=0.014);IFN⁃γ含量从第4周开始升高,到第8周升高显著,与Sham组相比差异有统计学意义(P= 0.001,图5)。所检测其他蛋白分子含量未见明显差异(P>0.05,图6)。
三、OVX组大鼠骨密度与阳性因子相关性分析
根据OVX组大鼠骨密度变化结果和IFN⁃γ、b⁃NGF变化结果做骨密度与IFN⁃γ、b⁃NGF的相关性分析,发现骨密度与IFN⁃γ(P=0.045)、b⁃NGF(P= 0.034)均可见显著性相关(图7)。
讨论
本研究利用蛋白组学方法,检测骨质疏松模型大鼠及正常大鼠的血清学指标,发现IFN⁃γ和b⁃NGF两项指标在实验组与对照组中存在显著差异。通过对四个时间点骨密度、松质骨形态计量学动态参数和蛋白芯片的数据观测发现,随着时间的推移,OVX组大鼠骨密度、BV/TV、Tb.Th和Tb.N逐渐降低;Tb.SP逐渐增大;而血清中IFN⁃γ和b⁃NGF浓度分别在第4、6周开始升高;相关性分析发现OVX组大鼠骨密度变化趋势与血清中IFN⁃γ和b⁃NGF浓度变化趋势具有一定相关性。这表明IFN⁃γ和b⁃NGF可能与早期骨质疏松症的发生和发展有密切联系。而IFN⁃γ和b⁃NGF含量在大鼠卵巢切除术后4周开始出现变化,这表明IFN⁃γ和b⁃NGF与其他因子相比在诊断早期骨质疏松方面具有优势。
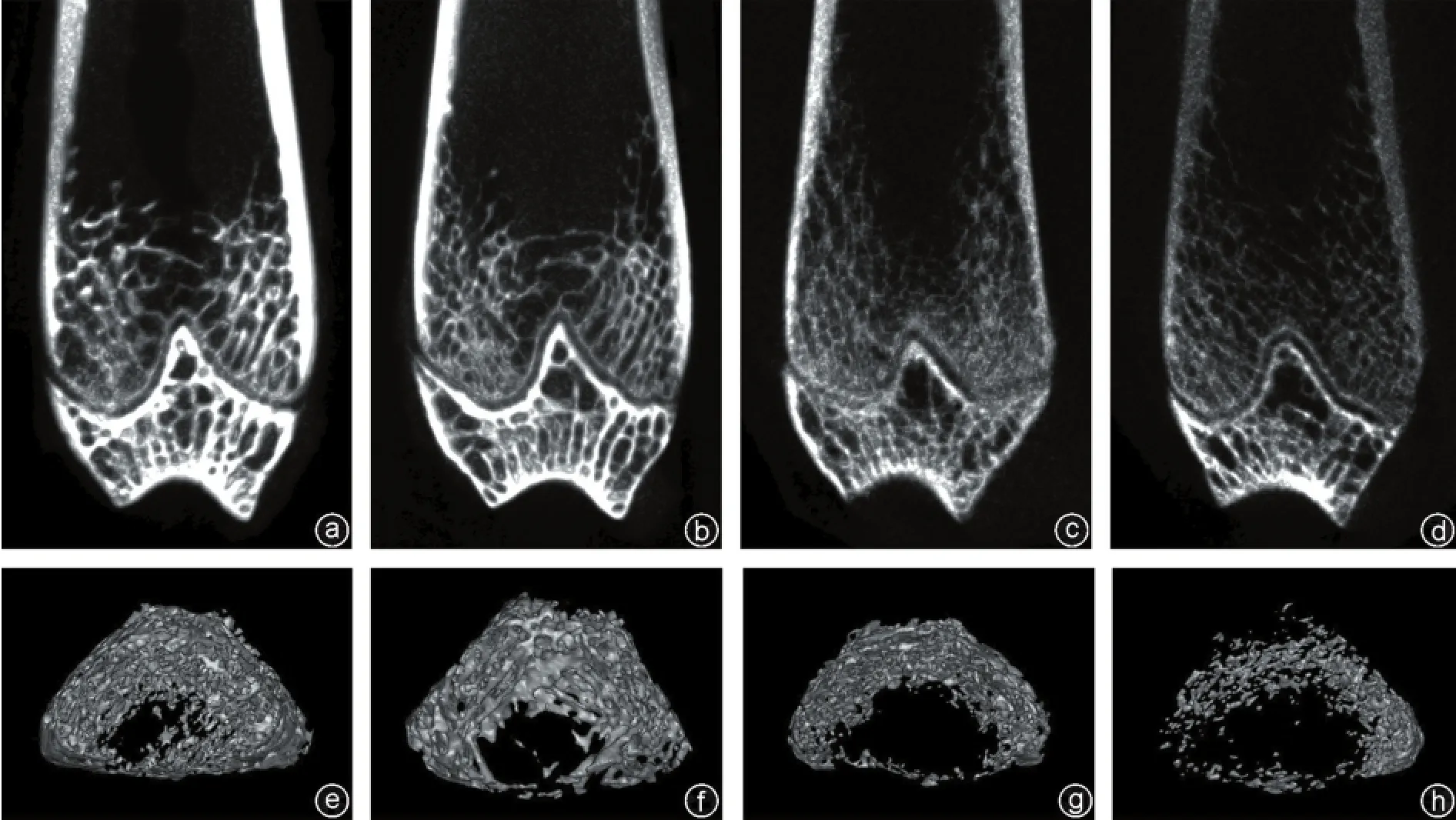
图1 OVX组大鼠显微CT片 a~d:术后2、4、6、8周矢状面图;e~h:术后2、4、6、8周横截面图;均可见骨小梁逐渐开始断裂,排列逐渐稀疏,形态结构完整性差,说明大鼠骨密度逐渐下降
IFN⁃γ由活化T细胞和自然杀伤细胞产生。它具有抗病毒、免疫调节及抗肿瘤特性。有研究表明免疫衰老引起的雌激素含量改变可使IFN⁃γ含量改变[18]。而IFN⁃γ和TNF⁃α可以激活NF⁃κB通路,导致破骨细胞凋亡的减少和骨吸收增加[19]。通过全基因组关联分析发现包括IFN⁃γ在内的一些基因可能对成骨细胞或破骨细胞起重要作用;IFN⁃γ还在老年妇女中有助于骨表型和Ⅱ类MHC表达,从而在骨质疏松症的发病过程中起作用[20];有文献报道其与脊柱关节病如骶髂关节炎、轴向不动和周边关节病有关[21]。IFN⁃γ可能通过炎症反应参与骨质疏松的发生、发展[22]。b⁃NGF是神经系统最重要的生物活性分子之一,对调节神经元的生长、发育、分化、存活及损伤神经的再生修复具有重要作用,并且参与维持神经、免疫和内分泌系统之间的平衡。针对b⁃NGF的研究工作自Levi⁃Montalcini和Humburg发现起至今已有50余年,多用于外周神经损伤、周围神经病、视神经损伤和阿尔茨海默病等疾病的治疗[23]。免疫衰老引起的雌激素含量改变可使b⁃NGF含量改变[18]。b⁃NGF可能通过免疫和内分泌系统参与骨质疏松症的发生和发展。故IFN⁃γ和b⁃NGF既参与骨质疏松的发生和发展,亦可由免疫衰老引起的雌激素含量改变而改变。
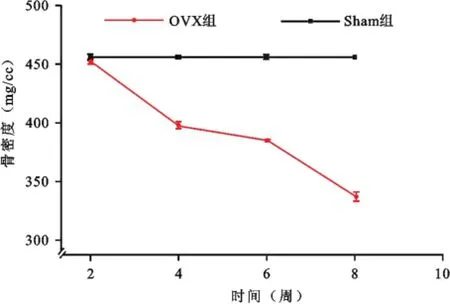
图3OVX组与Sham组大鼠骨密度变化对比图 可见OVX组大鼠骨密度随时间变化而逐渐降低,到第8周骨密度降幅超过25%,而Sham组大鼠骨密度未见明显变化
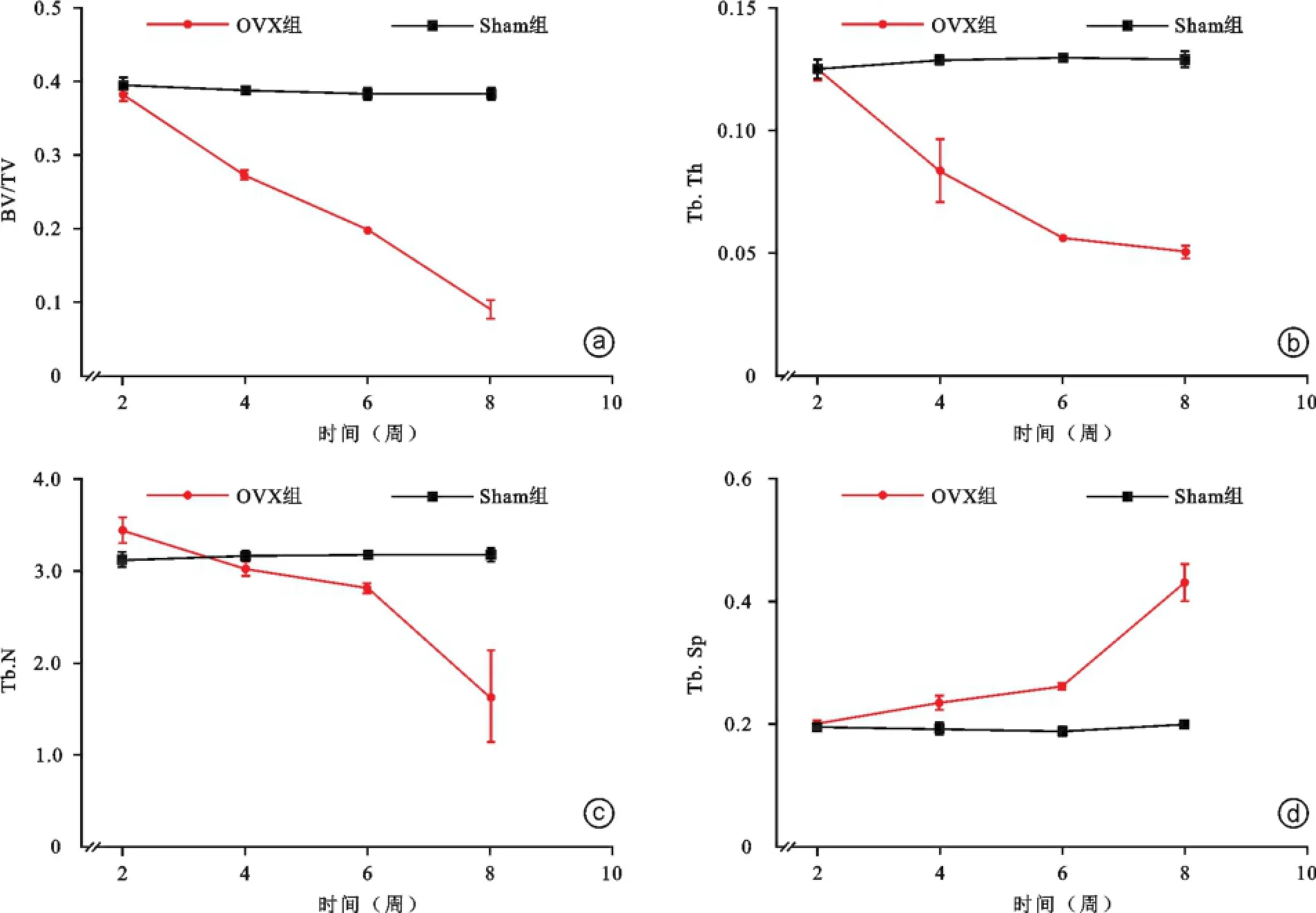
图4 OVX组与Sham组大鼠松质骨形态计量学动态参数变化对比图 OVX组大鼠BV/TV(a)、Tb.Th(b)、Tb.N(c)从第4周开始明显下降,而Sham组未见明显变化;OVX组大鼠Tb.SP(d)从第4周开始增大,从第6周开始增大明显,而Sham组未见明显变化
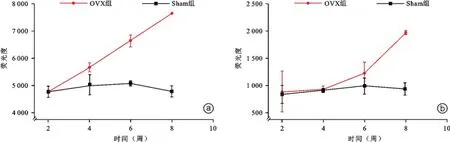
图5 阳性蛋白因子对比图 OVX组IFN⁃γ(a)从第4周开始升高,到第8周显著增高,Sham组未见明显变化;OVX组b⁃NGF(b)从第6周开始升高,到第8周显著增高,Sham组未见明显
表3OVX组与Sham组大鼠各时间点血清IFN⁃γ、b⁃NGF情况
,pg/ml)
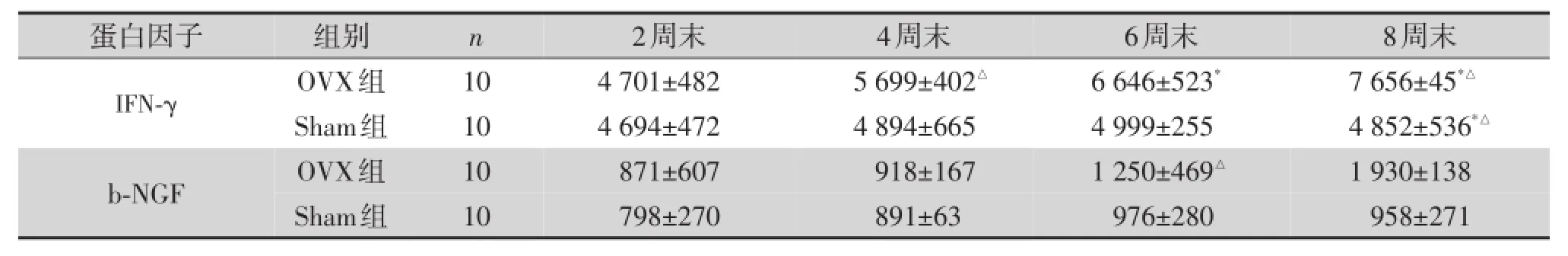
注:与同时间点的Sham组比较*P<0.05;组内与第2周末比较△P<0.05
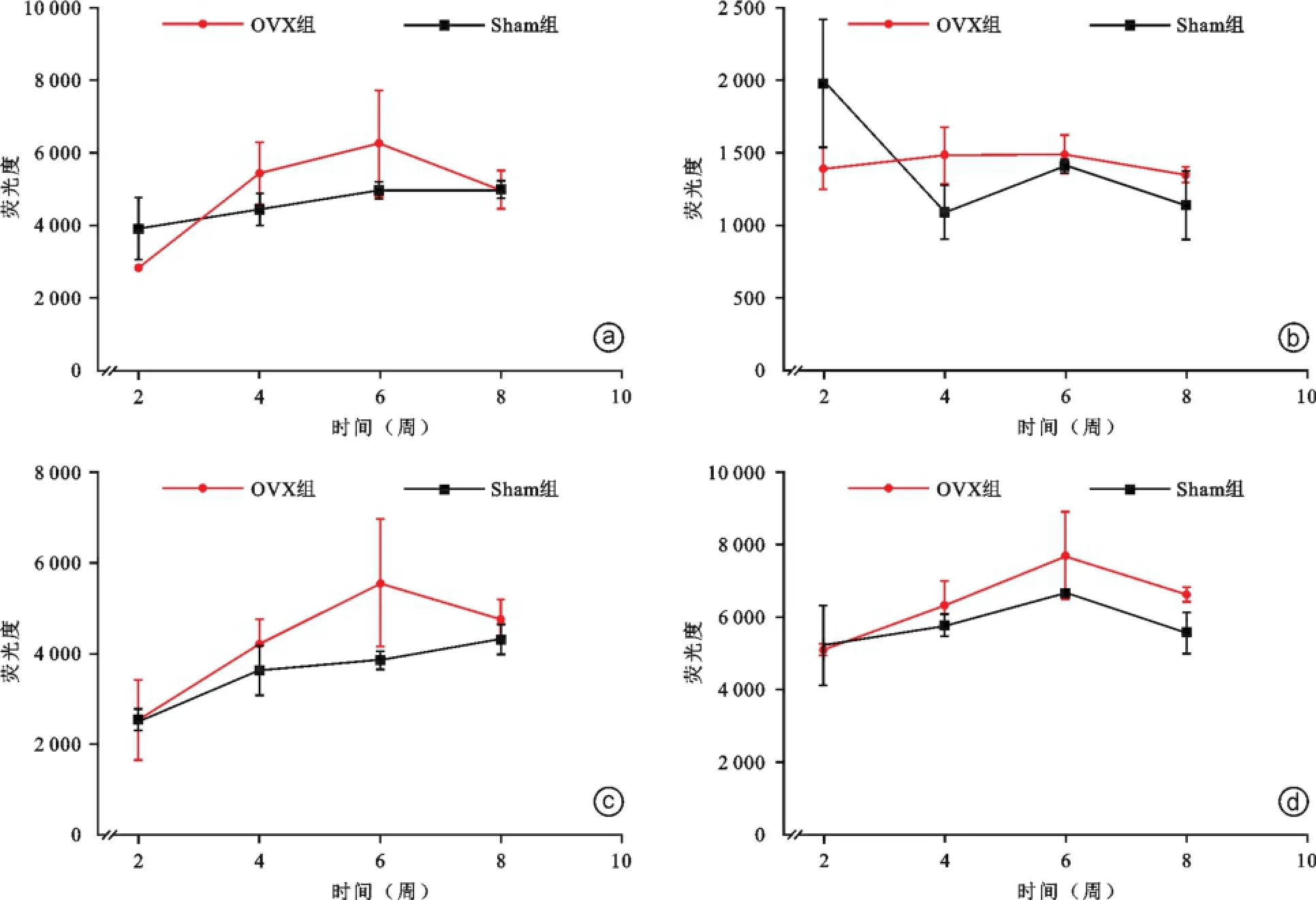
图6 阴性蛋白因子对比图 a为TNFa;b为VEGF;c为IL⁃1b;d为IL⁃4;上述4个因子在OVX组与Sham组之间未见明显差异
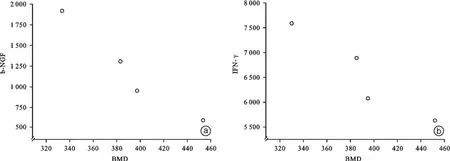
图7 OVX组大鼠骨密度与阳性因子相关性分析图 a、b分为骨密度与b⁃NGF、IFN⁃γ相关性分析结果,可见骨密度与b⁃NGF、IFN⁃γ有一定负性相关性
本研究主要利用蛋白芯片技术,筛选血清中与早期骨质疏松发病相关的蛋白因子。由于样本量有限,检测的血清生物学指标较少,血清标本反复冻融等原因,此次所检测出的因子对临床的指导意义还有待进一步的研究验证。下一步研究将增加所检测的血清生物学指标,扩大样本量,并通过骨质疏松患者血清进一步验证所得因子,最终的目标是制备出应用于临床诊断早期骨质疏松的便捷、经济的蛋白芯片,为临床诊断早期骨质疏松症提供一种新的思路和手段。
[1]NIH consensus development panel on osteoporosis prevention diag⁃nosis,and therapy.Osteoporosis prevention,diagnosis,and thera⁃py[J].JAMA,2001,285(6):785⁃795.
[2]Garnero P.New developments in biological markers of bone metab⁃olism in osteoporosis[J].Bone,2014,66:46⁃55.
[3]Zhu H,Fang J,Luo X,et al.A survey of bone mineral density of healthy Han adults in China[J].Osteoporos Int,2010,21(5):765⁃772.
[4]Burgers TA,Williams BO.Regulation of Wnt/β⁃catenin signaling within and from osteocytes[J].Bone,2013,54(2):244⁃249.
[5]Delgado⁃Calle J,Sañudo C,Sánchez⁃Verde L,et al.Epigenetic regulation of alkaline phosphatase in human cells of the osteoblas⁃tic lineage[J].Bone,2011,49(4):830⁃838.
[6]Templin MF,Stoll D,Schrenk M,et al.Protein microarray tech⁃nology[J].Trends Biotechnol,2002,20(4):160⁃166.
[7]Vasikaran S,Eastell R,Bruyère O,et al.Markers of bone turnover for the prediction of fracture risk and monitoring of osteoporosis treatment:a need for international reference standards[J].Osteo⁃poros Int,2011,22(2):391⁃420.
[8]Kii I,Nishiyama T,Li M,et al.Incorporation of tenascin⁃C into the extracellular matrix by periostin underlies an extracellular mesh⁃work architecture[J].J Biol Chem,2010,285(3):2028⁃2039.
[9]Rousseau JC,Sornay⁃Rendu E,Bertholon C,et al.Serum periostin is associated with fracture risk in postmenopausal women:a 7⁃years prospective analysis of the OFELY study[J].J Clin Endocri⁃nol Metab,2014,99(7):2533⁃2539.
[10]Kim BJ,Koh JM,Lee SY,et al.Plasma sphingosine 1⁃phosphate levels and the risk of vertebral fracture in postmenopausal wom⁃en[J].J Clin Endocrinol Metab,2012,97(10):3807⁃3814.
[11]Meier C,Meinhardt U,Greenfield JR,et al.Serum cathepsin K concentrations reflect osteoclastic activity in women with post⁃menopausal osteoporosis and patients with Paget’s disease[J]. Clin Lab,2006,52(1⁃2):1⁃10.
[12]Butler JS,Murray DW,Hurson CJ,et al.The role of Dkk1 in bone mass regulation:correlating serum Dkk1 expression with bone min⁃eral density[J].J Orthop Res,2011,29(3):414⁃418.
[13]Mirza FS,Padhi ID,Raisz LG,et al.Serum sclerostin levels nega⁃tively correlate with parathyroid hormone levels and free estrogen index in postmenozausal women[J].J Clin Endocrinol Metab,2010,95(4):1991⁃1997.
[14]Lane NE,Parimi N,Corr M,et al.Association of serum fibroblast growth factor 23(FGF23)and incident fractures in older men:the Osteoporotic Fractures in Men(MrOS)study[J].J Bone Miner Res,2013,28(11):2325⁃2332.
[15]Seeliger C,Karpinski K,Haug AT,et al.Five freely circulating miRNAs and bone tissue miRNA are associated with osteoporotic fractures[J].J Bone Miner Res,2014,29(8):1718⁃1728.
[16]Huang R,Jiang W,Yang J,et al.A biotin label⁃based antibody ar⁃ray for high⁃content profiling of protein expression[J].Cancer Ge⁃nomics Proteomics,2010,7(3):129⁃141.
[17]Ray S,Britschgi M,Herbert C,et al.Classification and prediction of clinical Alzheimer’s diagnosis based on plasma signaling pro⁃teins[J].Nat Med,2007,13(11):1359⁃1362.
[18]Priyanka HP,Sharma U,Gopinath S,et al.Menstrual cycle and re⁃productive aging alters immune reactivity,NGF expression,antioxi⁃dant enzyme activities,and intracellular signaling pathways in the peripheral blood mononuclear cells of healthy women[J].Brain Behav Immunm,2013,32:131⁃143.
[19]Wang L,Liu S,Zhao Y,et al.Osteoblast⁃induced osteoclast apopto⁃sis by fas ligand/FAS pathway is required for maintenance of bone mass[J].Cell Death Differ,2015,22(10):1654⁃1664.
[20]Zhang L,Guo YF,Liu YZ,et al.Pathway⁃based genome⁃wide asso⁃ciation analysis identified the importance of regulation⁃of⁃autopha⁃gy pathway for ultradistal radius BMD[J].J Bone Miner Res,2010,25(7):1572⁃1580.
[21]Swanberg M,McGuigan FE,Ivaska KK,et al.Polymorphisms in the inflammatory genes CIITA,CLEC16A and IFNG influence BMD,bone loss and fracture in elderly women[J].PLoS One,2012,7(10):e47964.
[22]Apalset EM,Gjesdal CG,Ueland PM,et al.Interferon(IFN)⁃γ⁃me⁃diated inflammation and the kynurenine pathway in relation to bone mineral density:the Hordaland Health Study[J].Clin Exp Immunol,2014,176(3):452⁃460.
[23]Seidel MF,Herguijuela M,Forkert R,et al.Nerve growth factor in rheumatic diseases[J].Semin Arthritis Rheum,2010,40(2):109⁃126.
Screening of osteoporosis⁃related protein markers in serum.
ZHAO Zhuojie,HU Yaqian,YANG Liu,LUO Zhuojing.Department of Orthopaedics,Xijing Hospital,the Fourth Military Medical University,Xi’an 710032,China
LUO Zhuojing,E⁃mail:zjluo@fmmu.edu.cn
ObjectiveTo screen the serum markers which can reflect the development of early stage of postmenopausal osteoporosis through protein chip.MethodsTwenty 3⁃month⁃old female SD rats were ran⁃domly divided into sham operation control group(Sham)and ovariectomy group(OVX),n=10 each.The bone mineral density(BMD)of distal femur and dynamic parameters of cancellous bone morphology of the two groups were measured by micro CT at the end of 2,4,6,8 weeks after operation.The blood of the two groups was taken from angular vein at the same time.The protein microarray was used to detect the concentration of 27 protein factors.ResultsMicro⁃CT examination showed that BMD,BV/TV,Tb.Th,Tb.Sp in OVX group began to de⁃crease and Tb.N began to increase at the end of 4 weeks,but there were no obvious changes in Sham group. There was significant difference between OVX and Sham groups by 8th weeks(P<0.05).Through the detection of protein chip we found that IFN⁃gamma in OVX group increased at 4th week and b⁃NGF increased at 6th week after operation,and there was significant difference between OVX and Sham groups by 8th weeks(P<0.05).ConclusionThe concentrations of IFN⁃gamma and b⁃NGF began to increase at the early stage of post⁃menopausal osteoporosis.Both of them are likely to be used as new type of molecular markers in the diagnosis of the early stage of postmenopausal osteoporosis.
Rats;Osteoporosis;Early diagnosis;Interferon⁃gamma;Nerve growth factors
10.3969/j.issn.1674⁃8573.2016.02.010
国家重点基础研究发展计划(2011CB964703)
710032西安,第四军医大学西京医院骨科
罗卓荆,E⁃mail:zjluo@fmmu.edu.cn
(2015⁃11⁃03)