兔VX2肿瘤组织与正常组织微血管构筑形态研究*
2016-09-05黄泽君孙建森重庆市肿瘤研究所超声科40000第三军医大学西南医院超声科重庆40008第三军医大学基础部解剖教研室重庆40008
黄泽君,李 锐,孙建森,丁 俊(.重庆市肿瘤研究所超声科40000;.第三军医大学西南医院超声科,重庆40008;.第三军医大学基础部解剖教研室,重庆40008)
兔VX2肿瘤组织与正常组织微血管构筑形态研究*
黄泽君1,李锐2△,孙建森3,丁俊2(1.重庆市肿瘤研究所超声科400030;2.第三军医大学西南医院超声科,重庆400038;3.第三军医大学基础部解剖教研室,重庆400038)
目的观察兔VX2肌肉肿瘤与正常肌肉组织微血管构筑的形态特征。方法采用隧道组织块包埋法建立VX2肌肉肿瘤模型。通过电镜和微血管铸型方法观察兔VX2肌肉肿瘤与正常肌肉组织微血管构筑形态特征。结果(1)采用隧道组织块包埋法成功建立了VX2肌肉肿瘤模型兔,成功率为100%。(2)电镜下观察正常肌肉组织微血管内径较均匀,基底膜厚度均匀、内膜完整,内皮细胞及周细胞与基底膜黏附紧密。而肌肉肿瘤组织微血管管径不均匀,管腔大多扩张呈囊性变,基底膜变薄、厚薄不均,内皮细胞与基底膜黏附松散,部分分离。(3)微血管铸型使正常肌肉组织和肌肉肿瘤组织微血管的三维结构可视化。正常肌肉组织的微血管密度较稀疏,分布均匀,走行自然,呈树枝状;而肌肉肿瘤组织微血管密集、结构紊乱,分布不均,多数走行迂曲呈蛇形,部分囊状扩张,部分迂曲狭窄,或二者并存吻合成复杂的血管网、血管团等。结论兔VX2肌肉肿瘤组织与正常肌肉组织的微血管构筑形态存在显著差异。
肿瘤,肌组织;肿瘤,实验性;肿瘤/病理学;组织包埋;毛细血管/超微结构;微血管构筑;兔
肿瘤新生血管是恶性肿瘤生长、浸润及转移必须依赖的条件[1]。肿瘤的血流在时间及空间上出现异质性原因在于肿瘤微血管构筑表型(T-MAP)的异常,继而导致肿瘤微环境改变,T-MAP的异常不仅影响肿瘤的侵袭性及预后,同时也是抗肿瘤血管生成治疗疗效存在显著差异的重要因素之一[2]。过去几十年来,人们对血管和血管生成在癌症中重要性的认识已逐渐深入,而且肿瘤血管结构评估用于体内监测治疗反应也越来越重要[3]。本研究拟通过对比兔VX2肌肉肿瘤组织与正常肌肉组织微血管结构和三维分布的特征,了解其微血管构筑表型分别具有的特点并分析其差异,为兔肌肉肿瘤组织治疗后微血管构筑表型的正常化研究打下一定的实验基础。
1 材料与方法
1.1材料由第三军医大学附属大坪医院动物实验中心提供健康新西兰大白兔6只,雌雄不限,体质量1.7~2.4 kg,平均(2.1±0.5)kg。VX2肿瘤组织由第三军医大学新桥医院超声科惠赠。Acuson Sequoia 512型彩色多普勒超声诊断仪(西门子公司),OLYMPUS BX51型光学显微镜,数码成像系统DP-50,PHILIPS TECNAI-10透射电镜。
1.2方法
1.2.1动物模型的建立对6只兔采用隧道组织块包埋法[1]建立右侧腿部VX2兔肌肉移植瘤模型。从患有VX2肿瘤的种兔体内取出靠近边缘为灰白色鱼肉样有活力的肌肉肿瘤组织,修剪成体积约1 cm3,置于盛适量生理盐水的培养皿中。将预接种的实验兔用速眠新0.2 mL/kg体质量经肌内注射(肌注)麻醉后,依次切开兔皮肤、皮下及肌膜组织,用眼科镊在肌肉组织中分离出窦道,要求深约1 cm左右。每个窦道内植入1~2块肌肉肿瘤组织后局部加压止血,再按照肌层、肌膜、皮下组织和皮肤顺序缝合,从而制成荷瘤兔模型。详细记录每只实验兔编号及接种情况,单兔单笼喂养,术后前3天每只兔每天肌注40万U青霉素。接种2周后用于二维超声、电镜检查和微血管铸型等实验。
1.2.2二维超声检查动物麻醉,肿瘤处备皮后再涂上适量耦合剂,采用西门子512型超声诊断仪,使用15L8W高频探头(频率14 MHz、深度40 mm)观察肌肉肿瘤组织的二维超声情况,选择能清晰显示并直径大于10 mm的肿瘤作为研究对象,用彩色记号笔标明肿瘤位置及超声观察切面方向。
1.2.3电镜检查将3只荷瘤兔麻醉固定后迅速取出部分肌肉肿瘤组织和对侧对称肌肉组织,立即放在石蜡台上(石蜡表面滴有3%戊二醛溶液),将其修剪为大小约1mm3的组织数块,置于3%戊二醛溶液中固定48 h,1%锇酸恒温4℃固定2 h,再逐级丙酮脱水,环氧树脂Epon812包埋,之后60℃固化,定位后作超薄切片,再用透射电镜观察肌肉肿瘤组织和正常肌肉组织中的微血管超微结构情况。
1.2.4微血管铸型方法采用解剖学技术,将3只荷瘤兔的肌肉肿瘤组织和对侧对称的肌肉组织制成微血管铸型标本,步骤如下。(1)配制填充剂:乙酸乙酯溶液内加入适量的丙烯腈-丁二烯-苯乙烯共聚物(ABS)分别配制成10%、20%的ABS乙酸乙酯液,加入红色油画颜料并搅拌均匀,备用。(2)取材和插管:选取速眠新麻醉荷瘤兔将其仰卧固定于木板上,打开胸腔及腹腔,依次暴露心脏,打开左心室,导管从左心室插入并进入升主动脉,将除降主动脉分支动脉以外的血管结扎,与此同时剪开右心房并观察流出的液体情况。(3)灌注:首先使用含有肝素钠的生理盐水灌注心脏至右心房流出的液体清亮后方停止,然后灌注10%的ABS乙酸乙酯液,当右心房流出灌注液时表明灌注成功,随即灌注20%的ABS乙酸乙酯液,直至ABS乙酸乙酯液不能再灌入后方停止。(4)补灌:于初次灌注后第2、3天分别根据情况补充灌注ABS乙酸乙酯液,灌注结束后取出血管插管同时结扎各灌注管道。将荷瘤兔模型置于清水中2周硬固。(5)腐蚀、修整:待铸型剂固化后,将标本浸泡于25%盐酸溶液腐蚀,时间为7~10 d,然后根据具体情况进行冲洗,使铸型标本干净、完整显示。最后修整标本,并将定型的模型封存入盛有5%甲醛的有机玻璃标本盒中长期保存。
2 结 果
2.1肿瘤种植结果接种种植成功VX2肌肉肿瘤兔6只,成功率为100%,共有9个肿瘤结节,其中直径大于10 mm肿瘤结节6个,5~9 mm肿瘤结节3个。二维超声检查显示,肿瘤结节呈分叶状或类圆形、低回声,边缘多清晰,部分有包膜形成,包膜下可见丰富的血管网(图1)。

图1 肌肉肿瘤组织二维超声图像
2.2电镜观察结果
2.2.1正常肌肉组织的微血管结构表现微血管内径大小相近,管腔规则,基底膜完整、厚度均匀,周细胞及内皮细胞与基底膜黏附紧密(图2)。

图2 正常肌肉组织电镜下微血管病理图(12 500×)
2.2.2肌肉肿瘤组织的微血管结构表现微血管内径粗细不一,管腔形态不规则,多呈囊性扩张,基底膜厚薄不均,周细胞及内皮细胞与基底膜黏附松散,部分分离(图3)。
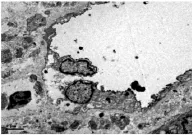
图3 肌肉肿瘤组织电镜下微血管病理图(6 200×)
2.3微血管铸型结果3只肿瘤兔中铸型失败1只,铸型成功2只。微血管铸型可直观显示正常肌肉和肌肉肿瘤组织微血管的三维分布特征。正常肌肉组织微血管表现为密度较稀疏,分布较均匀,管径均一,走行自然,呈树枝状(图4)。肌肉肿瘤组织微血管表现为密集,血供丰富;走行紊乱,大多数走行迂曲呈蛇形,排列紊乱,杂乱无章,分布不均,血管管径粗细不均,同时可见部分微血管囊状扩张,部分迂曲狭窄或闭塞,从而构成相互吻合的复杂的血管网、血管丛或血管团等(图5)。

图5 肌肉肿瘤组织微血管铸型图
3 讨 论
微血管生长的正、负调节因子的平衡决定了正常组织和肿瘤组织的血管形成[4]。肿瘤血管新生化的主要方式包括血管发生(vasculogenesis)、血管生成(angiogenesis)、淋巴管生成(lymphangiogenesis)和套叠式生长(intussusceptive growth)。血管的生成过程即微血管床上由内皮细胞芽生而产生微血管,缺氧刺激引发促血管生成因子与抑血管生成因子之间的失衡是主要的始动环节,其导致内皮细胞增殖、迁移、管型形成,最终新生微血管形成[5-6]。肿瘤组织新生微血管数目、微血管密度均增多,结构上异常表现为微血管扭曲、扩张、囊性变,以及吻合异常,三维空间分布异常等,以上变化即称为T-MAP的差异。在肿瘤发展中瘤细胞异质性不断增加,T-MAP也呈现多样性,差异性更为明显。T-MAP异质性即是通常所见的T-MAP的多样性和差异性的统称[7]。
本研究结果显示,肿瘤组织和正常组织微血管构筑表现为以下两方面:(1)在结构和组成方面,从电镜观察结果显示,正常肌肉组织微血管基底膜完整,由正常的内皮细胞围成,而肌肉肿瘤组织微血管基底膜不完整,由单个幼稚内皮细胞围成,缺乏周细胞或含有复层化的基底膜和增生的周细胞。Huang等[2]研究也显示了肿瘤组织微血管的相应改变。在形态结构上,正常组织血管内皮层完整光滑,管腔规则,分布均匀,但肿瘤血管内皮层缺失或不完整,基底膜缺乏或中断,肿瘤血管扭曲变形、动静脉瘘及盲端形成等血管结构异常多见,可呈腔隙状、窦状及树枝样等改变[8]。(2)在形态学方面,本研究通过血管铸型技术对肌肉肿瘤组织和正常肌肉组织三维结构进行了观察,血管铸型技术是标本制作的一项解剖学的专门技术[9],能理想显示肿瘤及正常组织微血管的二维和三维模型,使微血管结构可视化[10-11]。其方法为向所研究脏器的血管管腔中注入特殊的填充物质,待其硬化后将除血管管腔以外的组织分解清除,仅留下管腔的填充物,其能立体、直观、清晰地显示血管的形态、结构、走行的空间立体复杂关系。本研究发现,正常肌肉组织微血管表现较稀疏,呈树枝状,走行自然,管径均一,分布较均匀;而肌肉肿瘤组织微血管密集,走行及排列紊乱、杂乱无章,大多数走行迂曲呈蛇形,血管内径粗细不等,可同时存在囊状扩张与迂曲狭窄甚至闭塞的血管,从而构成复杂吻合的血管网及血管团等。本研究结果与Pabst等[10]研究中显示的口腔鳞状细胞癌小鼠移植瘤模型的肿瘤微血管形态结果一致,同时与Siemann等[12]描述的肿瘤血管结构是混乱的,缺乏层次结构,血管密度异常,血管轮廓不规则,有的曲折,有的扩张、有的细长的结论一致。有研究表明,缺乏为肿瘤细胞提供氧及营养物质的正常血管结构可导致肿瘤的浸润性生长,使肿瘤细胞群启动其自己的结构和功能异常血管网[13]。
本研究应用血管铸型技术获得了兔VX2肌肉肿瘤组织和正常肌肉组织的微血管特异性三维构筑模型,为了解其特征性图像找到了解剖形态学依据,证明兔VX2肌肉肿瘤组织与正常肌肉组织的微血管构筑存在显著差异,通过电镜及微血管铸型可以清晰地显示和识别,对兔肌肉肿瘤组织微血管构筑表型治疗后正常化研究打下了一定的实验基础。
[1]刘利平,鲁琴,张炎晶,等.兔脂肪肝及正常肝内VX2移植瘤血管生成的比较及超声造影参数与其相关性研究[J].中华超声影像学杂志,2014,23(4):340-344.
[2]Huang X,Wei X,Sang T,et al.Genome-wide association studies of 14 agronomic traits in rice landraces[J].Nat Genet,2010,42(11):961-967.
[3]Emblem KE,Farrar CT,Gerstner ER,et al.Vessel calibre—a potential MRI biomarker of tumour response in clinical trials[J].Nat Rev Clin Oncol,2014,11(10):566-584.
[4]PauI I,Bhattacharya S,Chatterjee A,et al.Current understanding on EGFR and Wnt/β-Catenin signaling in glioma and their possible crosstalk[J]. Genes Cancer,2013,4(11/12):427-446.
[5]卞修武.对肿瘤血管生成研究之肿瘤微血管构筑表型异质性的思考[J].中华病理学杂志,2006,35(3):129-131.
[6]徐宏光,丁国正,陈小虎,等.血管内皮生长因子165重组质粒pcDNA/V促兔椎体终板血管生成的实验观察[J].中华医学杂志,2012,92(7):491-495.
[7]Aird WC.Endothelial cell heterogeneity[J].Cold Spring Harb Perspect Med,2012,2(1):a006429.
[8]Hu JZ,Wu TD,Zhang T,et al.Three-dimensional alteration of microvasculatureinaratmodeloftraumaticspinal cord injury[J].J Neurosci Methods,2012,204(1):150-158.
[9]潘雪梅,周军.人体血管铸型技术的研究进展[J].中华解剖与临床杂志,2012,17(2):169-172.
[10]Pabst AM,Ackermann M,Wagner W,et al.Imaging angiogenesis:perspectives and opportunities in tumour research——a method display[J]. J Craniomaxillofac Surg,2014,42(6),915-923.
[11]Ackermann M,Konerding MA.Vascular casting for the study of vascular morphogenesis[J].Methods Mol Biol,2015,1214:49-66.
[12]Siemann DW,Horsman MR.Modulation of the tumor vasculature and oxygenation to improve therapy[J].Pharmacol Ther,2015,153:107-124.
[13]杨巧丽,李蓉芬,游箭.肿瘤血管构筑表型的研究进展[J].中国介入影像与治疗学,2014,11(11):760-763.
Study on microvasculature morphology from rabbit VX2 tumor tissue and normal tissue*
Huang Zejun1,Li Rui2△,Sun Jiansen3,Ding Jun2(1.Department of Ultrasonography,Chongqing Municipal Tumor Research Institute,Chongqing 400030,China;2.Department of Ultrasonography,Southwest Hospital,Third Military Medical University,Chongqing 400038,China;3.Teaching and Researching Section of Anatomy,Department of Basic,Third Military Medical University,Chongqing 400038,China)
ObjectiveTo observe the morphological characteristics of microvasculature in rabbit VX2 muscle tumor and normal muscular tissue.MethodsThe VX2 muscle tumor model was established by the canalled tissue mass embedding method. The electron microscopy and microvascular casting techniques were used to observe the microvascular morphologic characteristics of normal muscular and muscle tumor.Results(1)The VX2 muscle tumor model rabbit was successfully established by the canalled tissue mass embedding method with a success rate of 100%.(2)The microvascular inner diameter of normal muscular tissue observed by the electron microscopy was more uniform,the thickness of basement membrane was uniform with intact intima,the endothelial cells and perithelial cells were tightly adhered with the basement membrane.However,the microvascular diameter in tumor tissue was uneven,the vessel lumen was mostly expanded with cystic change,thin and uneven basement membrane,loose attachment between endothelial cells and basement membrane,and partial separation.(3)The microvascular casting directly showed the three-dimensional microvascular features of the normal muscle and tumor tissue.The microvascular density in normal muscle tissue was relatively sparse with uniform distribution and natural course like branches,whereas the microvessels in the tumor tissue were intensive with structural distortion and ununiform distribution,the majority of courses showed tortuous with snakelike and distributed unevenly,the part showed the cystic dilation,the part was tortuous and narrow,or the both coexisted and anastomosed into complex vascular network and vascular mass.ConclusionThe morphological characteristics of microvasculature from rabbit VX2 muscle tumor tissue and normal muscle tissue have a significant difference.
Neoplasms,muscle tissue;Neoplasms,experimental;Neoplasms/pathology;Tissue embedding;Capillaries/ultrastructure;Microvascular architecture;Rabbits
10.3969/j.issn.1009-5519.2016.13.004
A
1009-5519(2016)13-1964-03
国家自然科学基金资助项目(30770563)。
黄泽君(1981-),硕士研究生,主治医师,主要从事肿瘤超声诊断工作。
△,E-mail:raylee-7991@yahoo.com.cn。
(2016-03-03)
