免疫杀伤细胞治疗对恶性肿瘤患者调节性T细胞的影响*
2016-09-05韩兆东阮月芹韩晓通梁葵香孙其静滨州医学院附属医院中心实验室检验科疼痛科产科山东滨州5660
韩兆东,阮月芹,韩晓通,梁葵香,孙其静,李 卫(滨州医学院附属医院:.中心实验室;.检验科;.疼痛科;.产科,山东滨州5660)
免疫杀伤细胞治疗对恶性肿瘤患者调节性T细胞的影响*
韩兆东1,阮月芹2△,韩晓通3,梁葵香4,孙其静2,李卫1
(滨州医学院附属医院:1.中心实验室;2.检验科;3.疼痛科;4.产科,山东滨州256603)
目的探讨免疫杀伤细胞治疗对恶性肿瘤患者CD4+CD25+CD127LOW、CD8+CD28-调节性T细胞的影响。方法选择2011年5月至2014年4月该院肿瘤内科收治的接受免疫杀伤细胞治疗的恶性肿瘤患者50例作为研究对象(肿瘤组),同时选择该院健康体检者30例为对照组。采用流式细胞术检测所有受检对象治疗前后外周血CD4+CD25+CD127LOW和CD8+CD28-调节性T细胞的含量。结果肿瘤组治疗前外周血CD4+CD25+CD127LOW/CD4+、CD8+CD28-/CD8+(11.48%±1.44%、19.69%±5.01%)明显高于对照组(4.65%±0.75%、15.35%±4.71%),差异有统计学意义(P<0.05)。肿瘤组治疗后外周血CD4+CD25+CD127LOW/CD4+、CD8+CD28-/CD8+(5.55%±0.81%、16.15%±4.61%)明显低于治疗前,差异均有统计学意义(P<0.05);略高于对照组,但差异无统计学意义(P>0.05)。结论免疫杀伤细胞治疗恶性肿瘤,能够降低肿瘤患者外周血CD4+CD25+CD127LOW、CD8+CD28-调节性T细胞水平,纠正机体免疫失衡状态,提高免疫功能。
杀伤细胞;T淋巴细胞,调节性;肿瘤;抗原,CD4;抗原,CD8;抗原,CD28;流式细胞术
调节性T细胞是一类具有免疫负调控功能的T细胞亚群,该类细胞通过细胞直接接触和分泌调节性细胞因子发挥抑制效应,逃避自身免疫反应[1-3],从而使少量的恶变细胞逃避免疫监视和免疫防御,导致肿瘤的发生、发展[4]。有研究发现,肿瘤患者外周血中的CD4+CD25+调节性T细胞(CD4+CD25+regulatory T cells,CD4+CD25+Treg)明显增多,而且CD4+CD25+细胞水平越高,预后越差[5]。目前认为,CD4+CD25+CD127LOW是更有价值的特异性检测Treg的分子表面标记,CD8+CD28-T细胞是近年来被证实的另一种重要的调节性T细胞,这种T细胞在肿瘤患者的外周血中也大量增多,体内外实验均证实,其具有较强的免疫抑制作用,可抑制机体产生保护性抗体。然而,完全清除具有免疫抑制作用的调节性T细胞会引起各种严重的自身免疫反应[6]。因此,纠正患者机体内环境的免疫失衡,降低肿瘤患者体内调节性T细胞水平,保持机体免疫稳态,是治疗肿瘤的关键之一。目前,免疫杀伤细胞在临床上被广泛应用于肿瘤的治疗,但少见免疫杀伤细胞治疗恶性肿瘤与Treg关系的报道。本研究旨在通过免疫杀伤细胞治疗肿瘤,研究患者治疗前后CD4+CD25+CD127LOW和CD8+CD28-调节性T细胞的变化,为免疫杀伤细胞治疗肿瘤提供理论依据。
1 资料与方法
1.1一般资料选择2011年5月至2014年4月本院肿瘤内科收治的不适合手术的转移或复发中晚期恶性肿瘤患者50例作为研究对象。其中男28例,女22例;年龄16~76岁,平均(46.0±0.5)岁;肺癌7例,结直肠癌8例,肝癌4例,乳腺癌10例,肾癌4例,恶性黑色素瘤3例,鼻咽癌2例,膀胱癌4例,胃癌8例。WHO生存质量评分0~3分,未进行化疗和放疗治疗。白细胞计数均在4.0×109L-1以上,肝肾功能、心电图、凝血功能无异常;无自身免疫性疾病及糖尿病,无癫痫病史。本研究经医院伦理委员会审核批准,受试者均签署知情同意书。另选择同期在本院体检的健康人30例作为对照组,其中男16例,女14例;年龄20~70岁,平均(45.0±0.4)岁。
1.2仪器与试剂FC-500大型流式细胞仪、Q-PREP溶血制备仪均为美国贝克曼库尔特公司生产。小鼠抗人单克隆抗体CD4-藻红蛋白(CD4-PE)、CD25-异硫氰酸荧光素(CD25-FITC)、CD127-PC5、CD8-FITC、CD28-PC5及同型对照 IgG2a-FITC、IgG2a-PC5均购于美国CALTAG Laboratories公司;免疫杀伤细胞试剂购于德国慕尼黑大学免疫治疗中心;全血溶血试剂购自美国Coulter公司。
1.3方法
1.3.1患者单个核细胞采集用血细胞分离机采用单个核细胞采集程序。循环血量为1 000~1 500 mL,需要30~40 min(按照40 mL/min计算),得到外周血单个核细胞体积为30~40 mL,细胞数约10×108个。
1.3.2淋巴细胞纯化 将白细胞分离产物(30~40 mL)用RPMI1640培养基稀释至200 mL。将25 mL淋巴细胞悬液小心置于 13 mL淋巴细胞分层液上,840 r/min离心23 min,小心吸出淋巴细胞层并置于50mL离心管中,加RPMI1640培养基至总体积50 mL,750 r/min离心12 min。弃去上清液,用45 mL RPMI1640重悬淋巴细胞,并平均分装于2支50 mL离心管中,取样计数,离心去上清液,用48 mL无血清培养基将细胞重悬。其中一管用于免疫杀伤细胞第一步激活,另一管用于免疫杀伤细胞二次激活。
1.3.3免疫杀伤细胞制备将纯化得到的单个核细胞进行链式激活和诱导培养,得到免疫杀伤细胞(约2.0× 109个),其主要效应细胞为CD4+T细胞、CD8+T细胞、自然杀伤T细胞(NKT细胞)、自然杀伤细胞(NK细胞)和树突状细胞(DC细胞)。
1.3.4免疫杀伤细胞的收获及冻存将细胞培养产物750 r/min离心8 min去上清液,并用生理盐水重悬计数,同时取样送质量控制组检测。细胞750r/min离心8 min,去上清液并用20 mL冷冻液A(含10%人血清清蛋白磷酸盐缓冲液),置于冰上,缓慢加入20 mL预冷的冷冻液B(含20%二甲基亚砜磷酸盐缓冲液)充分混匀,分装于20支冷冻管(体积1.8 mL)中。细胞保存于-80℃低温冰箱中待用。
1.3.5质量控制取细胞冻存前的离心上清液进行微生物检测,均未检出普通厌氧、需氧菌,乙型肝炎病毒,丙型肝炎病毒,梅毒螺旋体,人类免疫缺陷病毒,内毒素及真菌。取细胞冻存前的细胞悬液进行细胞表型检测,细胞表型符合下列要求:CD4+T细胞 50.0%±5.1%、CD8+T细胞35.0%±3.2%、NKT细胞30.0%±2.1%、NK细胞7.0%±1.0%、DC细胞1.0%±0.2%。
1.3.6免疫杀伤细胞的复苏将需复苏的细胞冷冻管于37℃恒温水浴中化冻,并移入预置10 mL细胞复苏液(95 mL无菌生理盐水中加入5 mL人血清清蛋白后,用0.1 μm一次性滤器过滤)的离心管中,离心,并用10 mL生理盐水重悬,离心,重复以上步骤3次。取样,进行台盼蓝染色并计数。用2 mL细胞复苏液重悬,并转移到100 mL生理盐水中(含1%人血清清蛋白),准备回输。
1.3.7免疫杀伤细胞回输每个疗程20次,每天1次,连续20 d。
1.3.8标本采集及处理患者于治疗开始前和治疗结束后第3天分别静脉常规采血2 mL置于含EDTA-K2防凝管中,室温保存,在12 h内检测分析。
1.3.9流式细胞仪分析(1)用Flow-check进行光路和流路校准,使所有荧光信号变异系数(CV)<2%。(2)在标有同型对照试管1中分别加入CD4-PE试剂及IgG2a-FITC、IgG2a-PC5同型对照各20 μL,在标有同型对照试管2中分别加入CD8-FITC试剂和IgG2a-PC5同型对照各20 μL,各管分别再加入健康人EDTA-K2防凝血100 μL(5×105个细胞)混匀,室温避光15 min后,在标本制备仪上溶血、固定上机。以CD4-PE及侧向散射光(SSC)设门A于CD4+细胞群或以CD8-FITC及SSC设门A于CD8+细胞群。分析A门细胞,调节电压使CD25 和CD127及CD28细胞群位于阴性区,并进行颜色补偿。(3)在标有测试管1中加入单克隆抗体CD4-PE、CD25-FITC、CD127-PC5各20 μL,在标有测试管2中加入单克隆抗体CD8-FITC、CD28-PC5各20μL;分别加入各实验组或对照组EDTA-K2防凝血100 μL(5×105个细胞)混匀,室温避光15 min后,在标本制备仪上溶血、固定上机,检测每个样本CD4+CD25+CD127LOW/CD4+、CD8+CD28-/ CD8+的含量。
1.4统计学处理应用SPSS11.0统计软件进行数据分析,计量资料以±s表示,采用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1流式细胞仪检测肿瘤患者免疫细胞治疗前后外周血CD4+CD25+CD127LOW/CD4+、CD8+CD28-/CD8+细胞分析见图1、2。

图1 调节性T细胞CD4+CD25+CD127LOW分析图
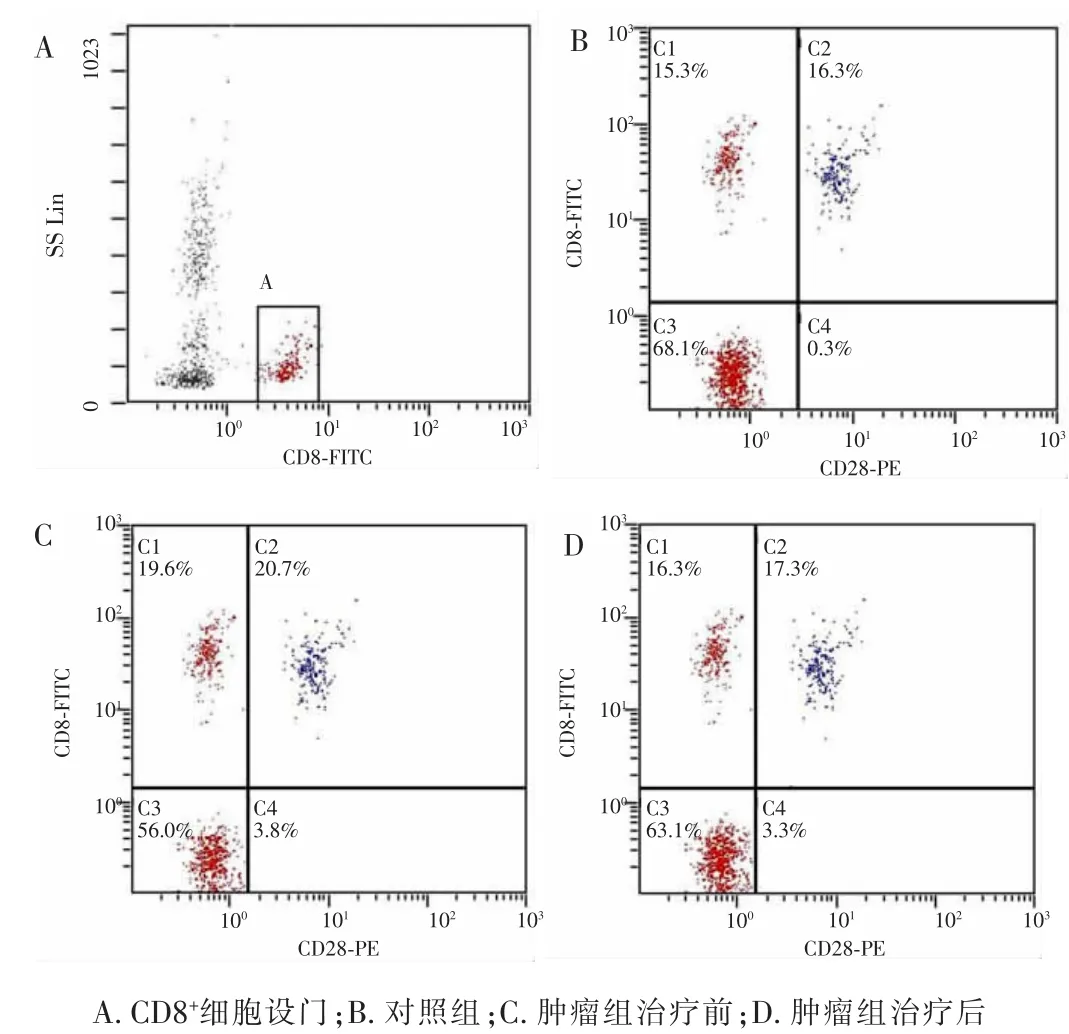
图2 调节性T细胞CD8+CD28-分析图
2.2检测结果肿瘤组治疗前外周血CD4+CD25+CD127LOW/CD4+、CD8+CD28-/CD8+含量明显高于对照组,差异有统计学意义(P<0.05)。肿瘤组治疗后外周血CD4+CD25+CD127LOW/CD4+、CD8+CD28-/CD8+含量明显低于治疗前,差异有统计学意义(P<0.05);肿瘤组治疗后外周血CD4+CD25+CD127LOW/CD4+、CD8+CD28-/CD8+含量略高于对照组,但差异无统计学意义(P>0.05)。见表1。
表1 两组外周血CD4+CD25+CD127LOW/CD4+、CD8+CD28-/CD8+含量比较(±s,%)

表1 两组外周血CD4+CD25+CD127LOW/CD4+、CD8+CD28-/CD8+含量比较(±s,%)
注:-表示无此项;与对照组和治疗后比较,aP<0.05。
组别n CD4+CD25+CD127LOW/CD4+ CD8+CD28-/CD8+对照组肿瘤组治疗前治疗后30 50 4.65±0.75 15.35±4.71 19.69±5.01a16.15±4.61 --11.48±1.44a5.55±0.81
3 讨 论
肿瘤免疫治疗中自体细胞免疫治疗在国内经历了长时间的应用,并已证明该方法的有效性,显示出其在未来肿瘤治疗中的前景。研究显示,自体细胞免疫治疗恶性肿瘤能提高患者外周血CD4+、CD8+数量及CD4+/ CD8+比值,改善机体的免疫功能[7-9]。但自体细胞免疫治疗恶性肿瘤与患者调节性T细胞的关系研究鲜见报道。本研究中,应用链式激活和诱导的免疫杀伤细胞治疗50例中晚期恶性肿瘤患者,结果显示肿瘤组治疗前外周血CD4+CD25+CD127LOW/CD4+、CD8+CD28-/CD8+含量明显高于对照组,差异有统计学意义(P<0.05),与文献[10-12]报道一致。肿瘤组治疗后外周血CD4+CD25+CD127LOW/CD4+、CD8+CD28-/CD8+明显低于治疗前,差异有统计学意义(P<0.05);略高于对照组,但差异无统计学意义(P>0.05)。说明链式激活和诱导的免疫杀伤细胞能降低患者CD4+CD25+CD127LOW、CD8+CD28-调节性T细胞,并接近健康人水平,改善机体免疫失衡状态。本研究结果显示,肿瘤组免疫杀伤细胞治疗后,患者CD4+CD25+CD127LOW、CD8+CD28-调节性T细胞水平明显降低与免疫杀伤细胞的效应细胞主要为激活和诱导的CD4+T细胞占50.0%±5.1%、CD8+T细胞占35.0%±3.2%有密切关系,CD4+T细胞能分泌大量的细胞因子调节细胞失衡和辅助抑制性T细胞杀伤肿瘤细胞[13],调节免疫失衡状态。
综上所述,链式激活和诱导的免疫杀伤细胞治疗恶性肿瘤,能降低患者CD4+CD25+CD127LOW、CD8+CD28-调节性T细胞水平,并使之接近健康人的水平,使失衡的免疫状态得到纠正,为患者进一步综合治疗奠定了基础。
[1]王会平,翟志敏,张爱梅,等.CD4+CD25+CD127low识别人外周血CD4+CD25+调节性T细胞的优势[J].中国免疫学杂志,2008,24(12):1059-1062.
[2]黄庆梅,覃锦耀.CD4+CD25+细胞和CD8+CD28-调节性T细胞在原发性肝癌患者外周血中的水平变化[J].检验医学,2010,25(9):705-707.
[3]Nishikawa H,Tsuji T,Jäger E,et al.Induction of regulatory T cell-resistant helper CD4+T cells by bacterial vector[J].Blood,2008,111(3):1404-1412.
[4]Battaglia M,Stabilini A,Draghici E,et al.Induction of tolerance in type 1 diabetes via both CD4+CD25+T regulatory cells and T regulatory type 1 cells[J].Diabetes,2006,55(6):1571-1580.
[5]刘莉,姚军霞,丁乾,等.胃癌和食管癌外周血CD4+CD25+调节性T细胞检测及其临床意义[J].中国现代医学杂志,2007,17(3):301-304.
[6]Paust S,Cantor H.Regulatory T cells and autoimmune disease[J].Immunol Rev,2005,204(4):195-207.
[7]王文祥,范文强,董学彩,等.DC-CIK细胞免疫治疗联合化疗对卵巢癌免疫功能的影响[J].山西医科大学学报,2014,45(12):1193-1196.
[8]刘艳华,孙三元,孙丽,等.DC-CIK治疗晚期恶性肿瘤的研究[J].医学信息,2014,27(9):225.
[9] 阮月芹,韩晓通,王敏,等.免疫杀伤细胞治疗对恶性肿瘤患者T淋巴细胞免疫功能的影响[J].中华生物医学工程杂志,2012,18(4):292-295.
[10]章圣辉,韩义香,吴建波,等.子宫颈癌患者外周血CD4+CD25+CD127low调节性T淋巴细胞的含量及肿瘤免疫水平检测[J].中华妇产科杂志,2007,42(6):419-420.
[11]方治.恶性肿瘤患者外周血T细胞CD8+CD28+CD8+CD28-及CD4+CD25+的表达及意义[J].现代实用医学,2011,23(6):660-661.
[12]姜艳丽,刘磊,王雪野,等.外周血CD4+CD25+CD127LOW调节性T细胞在恶性肿瘤患者免疫功能评估中的作用[J].中国实验诊断学,2015,19(7):1117-1120.
[13]李淑艳,邢淑娴.CIK细胞的特点及其在肿瘤生物治疗中的作用[J].癌变·畸变·突变,2007,19(5):424-426.
Effect of immune killer cells therapy on regulatory T cells in patients with malignant tumor*
Han Zhaodong1,Ruan Yue-qin2△,Han Xiaotong3,Liang Kuixiang4,Sun Qijing2,Li Wei1(1.Central Laboratory;2.Department of Clinical laboratory;3.Department of Pain;4.Department of Obstetrics,Affiliated Hospital of Binzhou Medical College,Binzhou,Shandong 256603,China)
ObjectiveTo investigate the effect of immune killer cells therapy on CD4+CD25+CD127LOWand CD8+CD28-regulatory T cells in the patients with malignant tumor.MethodsFifty patients with malignant tumor treated by the immune killer cells therapy in the oncology department of our hospital from May 2011 to April 2014 were taken as the research subjects (tumor group)and 30 individuals undergoing the healthy physical examination were selected as the control group.Flow cytometry was used to detect the peripheral blood CD4+CD25+CD127LOWand T regulatory CD4+cells with CD8+CD28-and CD8+.Results
The peripheral blood CD4+CD25+CD127LOW/CD4+and CD8+CD28-/CD8+before treatment in the tumor group were 11.48%±1.44% and 19.69%±5.01%,which were significantly higher than 4.65%±0.75%and 15.35%±4.71%in the control group,the differences were statistically significant(P<0.05).The peripheral blood CD4+CD25+CD127LOW/CD4+and CD8+CD28-/CD8+after treatment in the tumor group were 5.55%±0.81%and 16.15%±4.61%,which were significantly lower than before treatment with statistical differences;but slightly higher than those in the control group without statistical differences(P>0.05).ConclusionImmune killer cells in treating malignant tumor can reduce the peripheral blood CD4+CD25+CD127LOW,CD8+CD28-regulatory T cells level,corrects the immune imbalance state and improves the immune function.
Killer cells;T-lymphocytes,regulatory;Neoplasms;Antigens,CD4;Antigens,CD8;Antigens,CD28;Flow cytometry
10.3969/j.issn.1009-5519.2016.07.004
A
1009-5519(2016)07-0972-03
滨州医学院科技计划项目(BY2012KJ13)。
韩兆东(1963-),副主任技师,主要从事细胞免疫学及分子生物学研究。
△,E-mail:13563089341@163.com。
(2015-12-30)
