4′,5,7-三羟基异黄酮对LPS诱导的人主动脉内皮细胞ephrinB2及IL-6 mRNA表达的影响*
2016-09-05周雪冰欧刚卫陆红玲遵义医学院贵州遵义563000
姜 念,周雪冰,欧刚卫,陆红玲(遵义医学院,贵州遵义563000)
4′,5,7-三羟基异黄酮对LPS诱导的人主动脉内皮细胞ephrinB2及IL-6 mRNA表达的影响*
姜念,周雪冰,欧刚卫,陆红玲△
(遵义医学院,贵州遵义563000)
目的探讨4′,5,7-三羟基异黄酮对脂多糖(LPS)诱导人主动脉内皮细胞(HAEC)标记物ephrinB2及炎症因子白介素-6(IL-6)mRNA表达的影响。方法体外培养HAEC,分别用浓度为0.1、1.0、10.0、100.0、1 000.0 μg/mL的LPS刺激HAEC 4 h,建立HAEC损伤模型。将培养的人主动脉内皮细胞分为模型组(LPS 0.1 μg/mL),对照组,4′,5,7-三羟基异黄酮低(1.0 μm/mL)、中(10.0 μm/mL)、高(100.0 μm/mL)浓度组。MTT法检测细胞的活力,Real-time PCR法检测HAEC ephrinB2及IL-6 mRNA表达情况。结果除10.0、100.0 μg/L LPS组外,其余各浓度组与对照组比较,均能使HAEC的活力降低,差异均有统计学意义(P<0.05);LPS能促进ephrinB2及IL-6 mRNA的表达;4′,5,7-三羟基异黄酮中、高浓度组可促进HAEC细胞活力增加,差异均有统计学意义(P<0.05);4′,5,7-三羟基异黄酮低、中浓度组可明显降低ephrinB2及IL-6 mRNA的表达,差异均有统计学意义(P<0.01)。结论适当浓度的4′,5,7-三羟基异黄酮对LPS诱导的HAEC损伤有一定的保护作用。
异黄酮类;内皮细胞;白细胞介素6;脂多糖类;细胞增殖;炎症;ephrinB2
许多研究发现,动脉粥样硬化(AS)具有变质、渗出及增生等炎症特征,因此,炎症因子在心脑血管疾病的发生、发展及预后判断中起着极其重要的作用[1]。其中白介素6(IL-6)在AS中是一种具有较强独立预测价值的炎症标志物,在AS早期阶段,IL-6在血管损伤过程中起着重要作用[2-3]。ephrinB2是内皮细胞的标记物之一,与内皮细胞增殖、迁移、黏附及分化等过程密切相关,在早期的血管重塑中很重要。4′,5,7-三羟基异黄酮又名染料木素、金雀异黄素,是黄酮类化合物中的一种,已发现其具有明显的抗肿瘤、抗炎、抗氧化、降血脂及保护血管内皮细胞等生物活性[4-5],但其具体作用机制目前仍不十分明了。本研究以脂多糖(LPS)作用人主动脉内皮细胞(HAEC),探讨4′,5,7-三羟基异黄酮对HAEC ephrinB2 及IL-6mRNA表达的影响,旨在为进一步阐明4′,5,7-三羟基异黄酮对内皮细胞的保护机制提供理论依据。
1 材料与方法
1.1试剂与细胞株HAEC(美国模式菌种收集中心,即ATCC),4′,5,7-三羟基异黄酮、LPS、胰酶(Hyclone公司),MTT、RPMI1640培养液、胎牛血清(FBS,Gibco公司)。
1.2方法
1.2.1HAEC培养用含1%双抗、10%FBS的RPMI 1640培养基在37℃、5%CO2条件下培养HAEC。
1.2.2建立HAEC损伤模型将HAEC传代培养,生长融合成单层细胞,采用胰酶消化并进行细胞计数后接种于96孔板(每孔2×104个细胞),24 h后倾去培养液,用PBS洗 2~3遍。细胞分组:(1)对照组;(2)不同浓度LPS组:0.1、1.0、10.0、100.0、1 000.0 μg/mL。刺激各组细胞4 h,弃培养基后用PBS润洗2次,加180 μL无血清培养基和20 μL MTT培养4 h,弃去培养基加150 μL DMSO振荡20 s,于酶标仪490 nm处读取各组OD值。实验重复3次,取平均值。
1.2.3MTT法检测4′,5,7-三羟基异黄酮对LPS损伤HAEC活力的影响细胞培养及接种同1.2.1、1.2.2,将细胞分为对照组、模型组(LPS 0.1 μg/mL)、4′,5,7-三羟基异黄酮低(1.0 μmol/mL,GL)、中(10.0 μmol/mL,GM)、高(100.0 μmol/mL,GH)浓度组。将不同浓度的4′,5,7-三羟基异黄酮与 HAEC孵育 30 min后,加入 LPS (0.1 μg/mL)作用细胞4 h,弃培养基后用PBS润洗2次,加180 μL无血清培养基和20 μL MTT培养4 h,弃去培养基加150 μL DMSO振荡20 s,于酶标仪490 nm处读取各组OD值。实验重复3次,取平均值。
1.2.4Real-time PCR检测HAEC ephrinB2及IL-6 mRNA的表达细胞培养及分组同1.2.1、1.2.2。收集各组细胞,按Trizol试剂盒操作要求提取各组总RNA,按RT-PCR试剂盒操作进行逆转录,逆转录反应条件为37℃15min、85℃5 s、4℃。将扩增的cDNA加入至20 μL的反应体系。引物序列见表1。
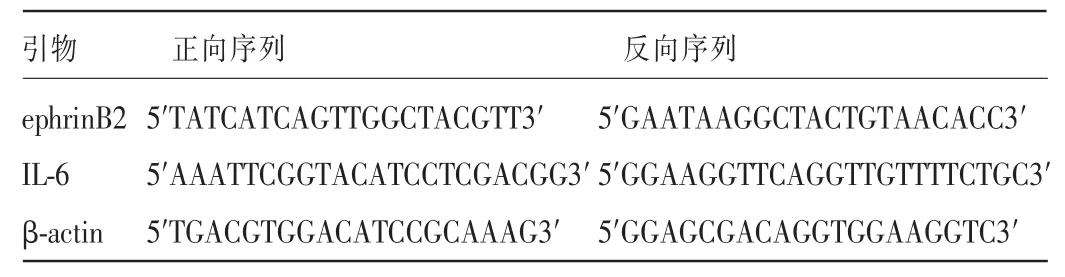
表1 引物序列
PCR采用SYBR GREEN法,反应条件:95℃3 min、55℃10 s、60℃30 s,40个循环,然后65℃5s、95℃5 min。以β-actin作为内参基因,目的基因的表达根据经Real-time PCR仪器检测的Ct值,通过公式2-(△△Ct)进行相对定量分析,计算mRNA表达水平。
1.3统计学处理应用SPSS17.0统计软件进行数据分析,计量资料以±s表示,组内比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1MTT法检测不同浓度LPS作用后HAEC活力HAEC经不同浓度LPS(0.1、1.0、10.0、100.0、1000.0μg/mL)刺激4 h后,除10.0、100.0 μg/mL LPS组外,其余各浓度组与对照组比较,均能使HAEC的活力降低,差异有统计学意义(P<0.05)。见表2。
2.2MTT法检测4′,5,7-三羟基异黄酮对LPS损伤HAEC活力的影响模型组OD值与对照组比较,差异有统计学意义(P<0.05)。4′,5,7-三羟基异黄酮GM、GH组与模型组比较,反映细胞存活的OD值有明显上升,差异均有统计学意义(P<0.05)。见表3。
表2 MTT法检测不同浓度LPS作用后HAEC活力(±s)

表2 MTT法检测不同浓度LPS作用后HAEC活力(±s)
注:与对照组比较,aP<0.05。
组别对照组0.1 μg/mL LPS组1.0 μg/mL LPS组10.0 μg/mL LPS组100.0 μg/mL LPS组1 000.0 μg/mL LPS组OD值0.173±0.015 0.117±0.030a0.116±0.024a0.170±0.001 0.138±0.020 0.101±0.012a
表3 MTT法检测4′,5,7-三羟基异黄酮对HAEC活力的影响(s)

表3 MTT法检测4′,5,7-三羟基异黄酮对HAEC活力的影响(s)
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05,cP<0.01。
组别对照组模型组GL(1.0 μmol/mL)GM(10.0 μmol/mL)GH(100.0 μmol/mL)OD值0.479±0.034 0.374±0.059a0.398±0.016 0.447±0.049c0.439±0.006b
2.3Real-time PCR检测HAEC ephrinB2及IL-6 mRNA的表达与模型组比较,GL组HAEC ephrinB2 mRNA的表达降低,GM组对ephrinB2及IL-6 mRNA表达的抑制作用更明显,而GH组反而促进了HAEC ephrinB2、IL-6 mRNA的表达,差异均有统计学意义(P<0.05)。见表4及图1。
表4 ephrinB2及IL-6 mRNA相对表达情况(±s)

表4 ephrinB2及IL-6 mRNA相对表达情况(±s)
注:与模型组比较,aP<0.05,bP<0.01。
组别对照组模型组GL(1.0 μmol/mL)GM(10.0 μmol/mL)GH(100.0 μmol/mL)ephrinB2 IL-6 1 1 2.509 8±0.253 3 0.886 4±0.101 1a0.067 6±0.001 9b2.815 0±0.388 9a1.360 0±0.226 2 1.224 0±0.220 6 0.985 0±0.049 4a1.650 0±0.155 5a

图1 ephrinB2及IL-6 mRNA的相对表达情况
3 讨 论
内皮细胞损伤是AS发生的早期阶段,受损内皮细胞表达特异性黏附受体及炎性相关细胞因子,吸引单核细胞聚集,黏附于内皮,引起慢性炎性反应,并不断摄取已进入内膜发生氧化的脂质,形成单核细胞源性泡沫细胞,从而引起AS的发生[6]。LPS是革兰阴性细菌细胞壁的主要成分,在慢性炎性反应过程中发挥重要作用。LPS的识别与跨膜信号转导是引起细胞炎症效应的关键,主要通过细胞膜Toll样受体4(TLR4)来实现[7],其信号转导的经典途径是二者结合后,促进丝裂原活化蛋白激酶(MAPK)和IκB激酶家族(IκB kinases,IKKε)磷酸化,最终分别活化转录因子活化蛋白1(AP-1)和核因子κB (NF-κB),促进炎性反应因子如肿瘤坏死因子-α(TNF-α)、IL-6和IL-1β等的分泌,引发炎性反应。有研究表明,LPS直接损伤内皮细胞后,内皮细胞生物力学特性发生变化,LPS增加可使内皮细胞膜的黏度增加[8]。LPS可促进人永生化表皮细胞(HaCaT细胞)、软骨细胞等增殖[9-10]。本研究结果发现,HAEC在受到不同浓度LPS作用时,随着LPS浓度的增加细胞活力逐渐降低,当LPS浓度达10.0 μg/mL时,细胞活力反而上升,但继续增加LPS浓度,细胞活力又逐渐降低;推测低浓度LPS对HAEC有损伤作用,而受到中浓度LPS作用时,LPS可诱导血管内皮细胞TLR4的表达[11],经Toll样受体信号转导途径作用促进细胞增殖,而高浓度(1 000.0 μg/mL)LPS作用时对细胞可能产生毒性作用,从而使细胞活力降低。由于要观察4′,5,7-三羟基异黄酮的作用,本研究选取了能导致细胞损伤的有效LPS浓度(0.1 μg/mL)进行后续实验,结果表明,经不同浓度4′,5,7-三羟基异黄酮干预后,细胞活力逐渐增加,说明适当的4′,5,7-三羟基异黄酮浓度可以抑制内皮细胞的损伤。
IL-6是一种分布广泛的炎症细胞因子,可通过体液和细胞免疫过程影响炎症、介导宿主防御和组织损伤[12]。IL-6可作用于血管壁而引起其损伤,有研究表明,血管内损伤可使TNF-α释放增加,TNF-α又促进IL-6的释放增加[13]。本研究中,HAEC经LPS刺激4 h后IL-6 的mRNA表达增加,说明此时细胞受到了损伤。而内皮细胞功能的损害又是AS过程中的始动环节和关键环节[14]。ephrinB2是内皮细胞特异性生长因子,参与血管生成调控。ephrinB2与血管结构的稳定性关系密切,活化的ephrinB2主要表达在内皮细胞和周细胞交汇处,是两类细胞形成血管结构所必需的[15]。Steinle等[16]研究发现,用ephrinB2-Fc刺激正向信号会促进内皮细胞增殖和迁移。本研究结果显示,HAEC经LPS刺激后ephrinB2 mRNA表达增加,推测此时内皮细胞的功能发生了改变。4′,5,7-三羟基异黄酮作为一种植物雌激素,在食品、医药、化妆品、饲料等领域具有广泛的应用前景。Andrade等[17]研究发现,4′,5,7-三羟基异黄酮能降低LPS刺激的人脐静脉内皮细胞(HUVEC)的黏附力,进而表现出抗AS效应。本研究结果也显示,低、中浓度4′,5,7-三羟基异黄酮能明显抑制 ephrinB2及 IL-6 mRNA的表达,表明适当浓度的4′,5,7-三羟基异黄酮可以减轻LPS诱导的HAEC损伤。但高浓度的4′,5,7-三羟基异黄酮却反而表现出促进ephrinB2及IL-6 mRNA的表达,推测可能与其高浓度对细胞的毒性作用有关。杨龙等[18]研究表明,高浓度的4′,5,7-三羟基异黄酮能诱导人肺癌耐药细胞系A549/DDP超微结构破坏,使细胞发生凋亡甚至坏死。
综上所述,LPS可以促使HAEC损伤,使ephrinB2 及IL-6的mRNA的表达水平上升,经适当浓度的4′,5,7-三羟基异黄酮干预后,ephrinB2及IL-6 mRNA的表达明显减低,对LPS诱导的HAEC损伤起到一定的保护作用。
[1]朱磊,刘君,昌艳艳.动脉粥样硬化与炎性因子的相关性研究[J].中国实用医药,2014,7(9):250-251.
[2]Harja E,Bu DX,Hudson BI,et al.Vascular and inflammatory stresses mediate atherosclerosis via RAGE and its ligands in apoE-/-mice[J].J Clin Invest,2008,118(1):183-194.
[3]陈光强,朱琳,胡量,等.CRP对血管内皮细胞泡沫化及IL-6、MCP-1表达的影响[J].医学研究杂志,2009,38(7):46-49.
[4]张萍,郑万金,仲英.染料木素的研究进展[J].齐鲁药事,2008,27(2):103-106.
[5]任娇,孙惜时,田憬若,等.大豆异黄酮对内皮细胞损伤保护作用的研究进展[J].大豆科学,2014,33(1):135-137.
[6]张雪梅,王高频.阿托伐他汀对血管紧张素Ⅱ诱导的人血管内皮细胞炎性因子的影响[J].中华老年心脑血管病杂志,2009,11(3):214-217.
[7]李福荣,冯蕾,桑慧,等.芹菜籽提取物保护Toll样受体4参与的内皮细胞过氧化损伤[J].营养学报,2013,35(1):56-59.
[8]王翔,王晓军,罗向东,等.内毒素直接损伤血管内皮细胞生物力学机理[J].生物物理学报,1998,15(4):804-811.
[9]程秋梅,潘延斌,谭美乐,等.来氟米特对脂多糖诱导下HaCaT细胞增殖和凋亡的影响[J].中国临床新医学,2014,7(4):302-305.
[10]张城,宋勇,张艺,等.金雀异黄酮对脂多糖处理的软骨细胞增殖抑制的拮抗及抗炎作用[J].中国生物制品学杂志,2011,2(24):184-186.
[11]路玲,常文秀,曹书华,等.小剂量脂多糖诱导血管内皮细胞TLR4的表达[J].中国中西医结合外科杂志,2012,18(1):47-51.
[12]周媛媛,沈捷,马向华.白细胞介素-6与2型糖尿病及动脉粥样硬化发生发展的关系[J].国际内科学杂志,2009,36(8):460-462.
[13]Guldiken B,Guldiken S,Turgut B,et al.The roles of oxidized low-density lipoprotein and interleukin-6 levels in acute atherothrombotic and lacunar ischemic stroke[J].Angiology,2008,59(2):224-229.
[14]陈鹏,戴敏.脂多糖对动脉粥样硬化血管内皮细胞及其信号转导通路的影响[J].中国动脉粥样硬化杂志,2008,16(6):495-498.
[15]Salvucci O,Maric D,Economopoulou M,et al.EphrinB reverse signaling contributes to endothelial and mural cell assembly into vascular structures[J]. Blood,2009,114(8):1707-1716.
[16]Steinle JJ,Meininger CJ,Forough R,et al.Eph B4 receptor signaling mediates endothelial cell migration and proliferation via the phosphatidylinositol 3-kinase pathway[J].J Biol Chem,2002,277(46):43830-43835.
[17]Andrade CM,Sá MF,Toloi MR.Effects of phytoestrogens derived from soy bean on expression of adhesion molecules on HUVEC[J].Climacteric,2012,15(2):186-194.
[18]杨龙,陆红玲,周正平,等.染料木素对人非小细胞肺癌细胞A549/DDP超微结构的影响[J].遵义医学院学报,2015,38(4):397-400.
Effects of 4′,5,7 trihydroxyisoflavone on mRNA expression of ephrinB2 and IL-6 induced by LPS in human aortic en-dothelial cells*
Jiang Nian,Zhou Xuebing,Ou Gangwei,Lu Hongling△(Zunyi Medical College,Zunyi,Guizhou 563000,China)
ObjectiveTo study the effects of 4′,5,7 trihydroxyisoflavone on mRNA expression of ephrinB2 and IL-6 in duced by LPS in human aortic endothelial cells(HAEC).MethodsHuman aortic endothelial cells were cultured in vitro and 0.1,1.0,10.0,100.0,1000.0 μg/mL of LPS was to stimulate HAEC for 4 h.The HAEC injury model was established.Then the cultured HAEC were divided into the model group(0.1 μg/mL LPS),low,middle and high 4′,5,7 trihydroxyisoflavone concentra tion groups(1.0,10.0,100.0 μm/mL respectively);the cell vitality was detected by MTT assay.The mRNA expressions of ephrinB2 and IL-6 were detected by reverse transcription polymerase chain reaction(RT-PCR).ResultsExcept for the 10.0,100.0 μg/mL LPS groups,the rest other concentration groups all could reduce the vitality of HAEC compared with the control group,the differences were statistically significant(P<0.05),LPS could promote the mRNA expression of ephrinB2 and IL-6;the middle and high concentration 4′,5,7 trihydroxyisoflavone groups HAEC could promote the increase of HAEC vitality with statistical difference (P<0.05)and the low and middle concentration 4′,5,7 trihydroxyisoflavone groups could significantly reduce the mRNA expression of ephrinB2 and IL-6 with statistical difference(P<0.01).ConclusionAppropriate concentration of 4′,5,7 trihdroxyisoflavone has a certain protective effect to LPS induced HAEC injury.
Isoflavones;Endothelial cells;Interleukin-6;Lipopolysaccharides;Cell proliferation;Inflammation;ephrinB2
10.3969/j.issn.1009-5519.2016.07.002
A
1009-5519(2016)07-0966-03
贵州省科技厅联合基金重点项目(黔科合J字LKZ[2013]14)。
姜念(1989-),在读硕士研究生,主要从事心血管疾病分子生物学研究。
△,E-mail:l_hongling2@163.com。
(2015-12-10)
