斑蝥酸钠诱导RTP801表达促进结肠癌细胞HCT116凋亡
2016-09-05关洪全
张 霞,关洪全
(1.辽宁省肿瘤医院内五科,沈阳110042;2.辽宁中医药大学免疫与病原生物教研室,沈阳110847)
斑蝥酸钠诱导RTP801表达促进结肠癌细胞HCT116凋亡
张霞1,2,关洪全2
(1.辽宁省肿瘤医院内五科,沈阳110042;2.辽宁中医药大学免疫与病原生物教研室,沈阳110847)
目的探讨斑蝥酸钠注射液对结肠癌细胞凋亡的影响作用及分子机制.方法通过异硫氰酸荧光素(FITC)-右旋糖酐渗透实验观察终浓度为0.1、0.25、0.5、1、2 μg/mL斑蝥酸钠注射液处理24 h后对HCT116细胞凋亡的影响;分别用rea1-time PCR和Western b1ot方法检测终浓度为0.1、0.25、0.5、1、2 μg/mL斑蝥酸钠注射液处理24 h后对促凋亡基因DNA损伤修复基因(RTP801)表达的影响;运用低氧诱导因子1α(HIF-1α)质粒和HIF-1α-siRNA转染检测HIF-1α信号通路对RTP801的影响.结果斑蝥酸钠注射液诱导单层细胞渗透性增加,FITC-右旋糖酐渗透率增高.细胞受斑蝥酸钠注射液刺激后,RTP801的mRNA和蛋白水平上调,且都呈浓度依赖性.HIF-1α质粒转染后,RTP801蛋白表达增加;加入HIF-1α-siRNA,斑蝥酸钠注射液对RTP801的上调作用降低,且FITC-右旋糖酐渗透率下降.结论斑蝥酸钠通过HIF-1α途径增加RTP801的表达,诱导结肠癌细胞HCT116凋亡.
斑蝥酸钠;结肠癌;低氧诱导因子1α;DNA损伤修复基因;凋亡
网络出版地址
结肠癌是全球十分常见的恶性肿瘤之一,发病率和死亡率居癌症疾病第3位,严重影响人类健康[1,2].研究结肠癌的发病机制有助于对其早期预防和治疗.结肠癌的发生与结肠细胞的增殖、凋亡相关,主要原因包括细胞周期调控失常与促凋亡基因表达降低[3,4]2方面.RTP801又名DNA损伤修复基因(regu1ated in deve1opment and DNA damage responses,REDD1),是一种促凋亡因子,广泛存在于人体多种组织,正常情况下处于低表达状态[5].在低氧条件下,低氧诱导因子1α(hypoxia inducib1e factor-1α,HIF-1α)被激活[6],HIF-1α作为一种转录因子能够与RTP801基因启动子上相应的结合位点结合,诱导RTP801的表达[7].
斑蝥酸钠是斑蝥素的半合成药物,是斑蝥素与氢氧化钠共热后的水解生成物,其毒性较斑蝥素低,抗肿瘤效果显著,已长期用于临床治疗肝癌、食管癌等恶性肿瘤疾病[9].大量研究报道斑蝥酸钠加速癌细胞凋亡,但促凋亡因子RTP801在这一过程中的作用尚属未知.因此,本文通过研究斑蝥酸钠对RTP801基因和蛋白表达的调控作用,探究斑蝥酸钠治疗结肠癌的分子机制.
1 材料与方法
1.1材料
细胞系及主要试剂:人结肠癌上皮细胞系HCT116购自美国ATCC细胞库.DMEM培养基购自美国HyC1one公司,胰酶购自美国Ce11gro公司,血清购自天津市灏洋生物公司,LipofectamineTM2000购自美国Invitrogen公司,HIF-1α-siRNA由上海吉玛公司合成,FITC-右旋糖酐购自美国Sigma公司,0.4 μm孔径transwe11和小鼠抗HIF-1α抗体购自美国Mi11ipore公司,Trizo1购自美国Thermo公司,PCR试剂盒购自日本TaKaRa公司,兔抗RTP801抗体购自美国Proteintech group公司,小鼠抗β-actin抗体和羊抗鼠、羊抗兔二抗购自美国Santa cruze公司,斑蝥酸钠注射液购自贵州金桥药业有限公司(批号H52020602).
1.2方法
1.2.1细胞培养:在37℃,5%CO2培养箱中,用含10%胎牛血清和青霉素(100 U/mL)、链霉素(100 μg/ mL)DMEM培养基培养HCT116细胞,隔天换液.细胞长满后用胰蛋白酶消化传代,或者重新接种在6孔板中用于后续实验.
1.2.2RT-PCR:Trizo1提取细胞RNA,紫外分光光度法确定mRNA浓度.采用逆转录试剂盒将总RNA逆转录为cDNA,反应条件为37℃,15 min,85℃,5 s.逆转录后用rea1-time PCR方法测定mRNA的表达量,反应条件为95℃预变性5 min,95℃10 s, 60℃10 s,72℃10 s,共40个循环.目的引物为RTP801,内参引物为GADPH.采用2-ΔΔCt法对实验数据定量分析.GADPH上游引物序列ACCACAGT CCATGCCATCAC,下游引物序列TCCACCACCCTG TTGCTGTA;RTP801上游引物序列CAAGATCCAG GGGCTGTTTA,下游引物序列CACCCCAAAAGTT CAGTCGT.
1.2.3Western b1ot:蛋白裂解液法提取细胞中总蛋白,冰上操作并静置10 min.50 000 r/min离心10 min,95℃加热10 min.BCA法测定蛋白浓度.用10%SDS-PAGE法分离电泳,90 V转膜,5%脱脂奶粉封闭1 h,一抗分别为小鼠抗HIF-1α抗体,兔抗RTP801抗体和小鼠抗β-actin抗体,4℃孵育过夜(浓度为1∶1 000),二抗常温孵育1 h(浓度为1∶ 2 500),ECL发光液检测.Image J软件测定条带灰度值并定量分析.
1.2.4HIF-1α过表达质粒[10]和HIF-1α-siRNA转染:以往研究[7]发现促凋亡基因RTP801启动子上有转录因子HIF-1α结合位点,因此本研究加入HIF-1α过表达质粒或HIF-1α-siRNA探究斑蝥酸钠是否通过HIF-1α信号通路调节RTP801的表达.将细胞均匀分布在6孔板中,待其长满至80%.取2个灭菌的1.5 mL EP管标记A、B并配置下列溶液.溶液A,将HIF-1α质粒或HIF-1α-siRNA溶于250 μL无血清无双抗DMEM培养基中;溶液B,将10 μL LipofectamineTM2000试剂稀释于250 μL无血清无双抗DMEM培养基中,溶液A和B都放于室温静置5 min.混匀溶液A、B,常温静置30 min.对照组加入空载质粒.去掉6孔板中原培养基,将DNA/LipofectamineTM2000混合物加入6孔板,6 h后更换含血清和双抗培养基,转染时间为48 h.HIF-1α-siRNA序列为5′-AGAGGUGGAUAUGUGUGGGdTdT-3′,scramb1ed -siRNA序列为5′-AUGUAUUGGCCUGUAUUAG-3′[11].
1.2.5异硫氰酸荧光素(f1uores cein iso-thiocyanat, FITC)-右旋糖酐渗透实验:Lopez等[12]在血脑屏障研究中使用FITC-右旋糖酐渗透实验检测细胞凋亡情况.同时,Nie1sen等[13]在肠上皮细胞凋亡检测方面也同样使用了FITC-右旋糖酐渗透方法.因此,本研究选用单层细胞FITC-右旋糖酐渗透性评价细胞凋亡情况.选择杯底孔径为0.4 μm的微孔滤膜封闭的24孔板嵌套transwe11小室,在上室底部均匀涂布胶原蛋白.将1X106个细胞接种在transwe11小室中,并加入150 μL含血清双抗DMEM培养基,在transwe11下室中加入600 μL含血清双抗DMEM培养基,隔天换液.培养10 d后每个transwe11上室加入200 μL FITC-右旋糖酐(10 mg/mL),4 h后在下室中抽取100 μL DMEM培养基,酶标仪测吸光度[14].
1.3统计学分析
2 结果
2.1斑蝥酸钠增加结肠癌单层细胞渗透性
本研究用不同浓度的斑蝥酸钠注射液刺激细胞,与不加药物的对照组相比,加入药物的实验组FITC-右旋糖酐渗透率增加,且与斑蝥酸钠注射液浓度呈正相关,具有浓度依赖性,见图1.

图1 斑蝥酸钠对FITC⁃右旋糖酐渗透性的影响Fig.1 The influence o f sodium cantharid inate on FITC⁃Dextran permeability
2.2斑蝥酸钠刺激RTP801mRNA的表达
为了研究斑蝥酸钠对结肠癌细胞促凋亡基因RTP801影响,本研究用rea1-time PCR方法检测了RTP801mRNA的表达.研究结果表明斑蝥酸钠注射液刺激后,RTP801mRNA表达明显上调,且当药物浓度达到2 μg/mL时,mRNA表达量增加了约16倍,见图2.
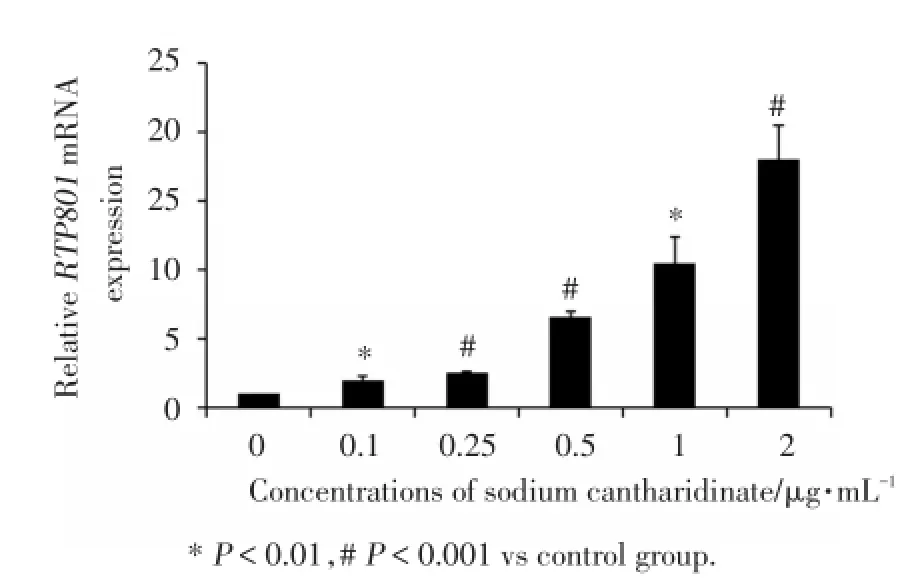
图2 斑蝥酸钠对RTP801m RNA水平的影响Fig.2 The e ffect of sodium cantharid ina te on the m RNA leve l o f RTP801
2.3斑蝥酸钠诱导RTP801蛋白的表达
本研究继续检测了RTP801蛋白水平的表达. Western b1ot结果显示随着药物浓度的增加,RTP801蛋白表达量也逐渐增加,灰度值定量分析表明RTP801表达与药物浓度呈正相关,与mRNA结果一致,见图3.
2.4斑蝥酸钠通过HIF-1α信号通路调节RTP801的表达
用HIF-1α质粒和HIF-1α-siRNA转染实验证实HIF-1α信号通路对RTP801的调控作用.结果证明HIF-1α过量表达能够上调RTP801蛋白表达,且具有质粒浓度依赖性.加入HIF-1α-siRNA后,斑蝥酸钠注射液对RTP801的诱导作用下降,见图4.同时,FITC-右旋糖酐渗透实验结果也证实了HIF-1αsiRNA阻止了斑蝥酸钠注射液诱导的单层细胞渗透性升高,抑制了结肠癌细胞凋亡,见图5.
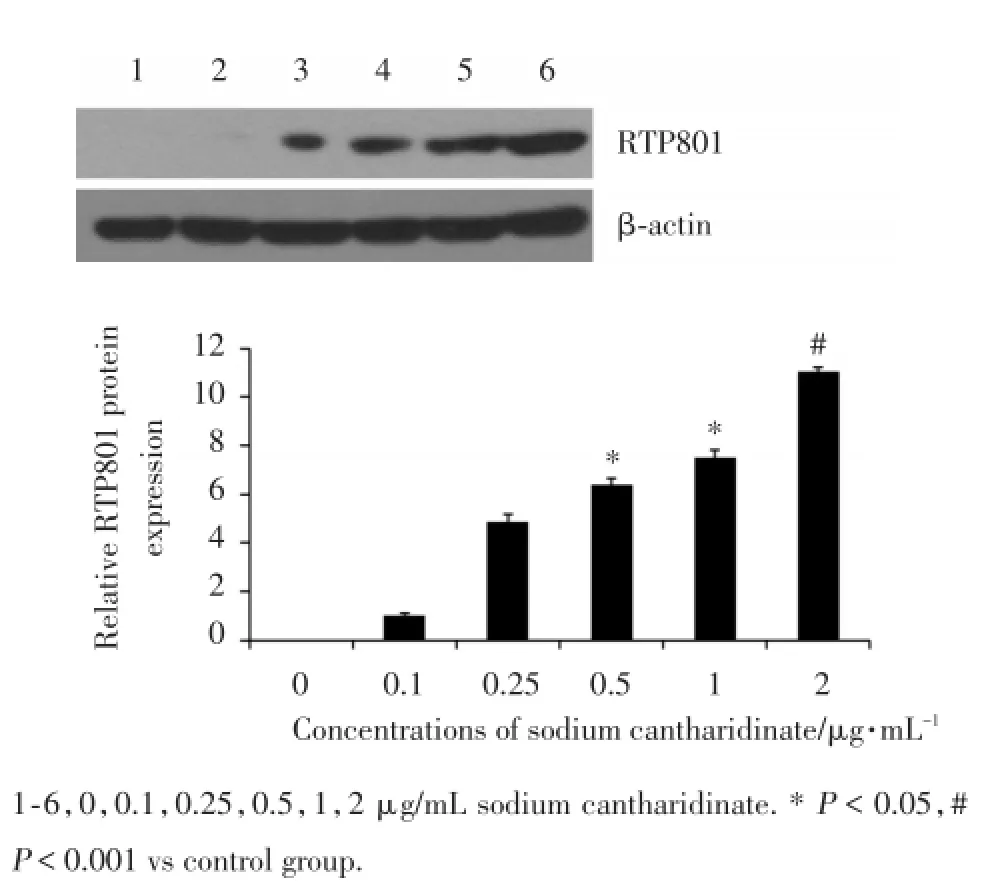
图3 斑蝥酸钠对RTP801蛋白水平的影响Fig.3 The im pac t of sodium can tha ridinate on RTP801 protein level
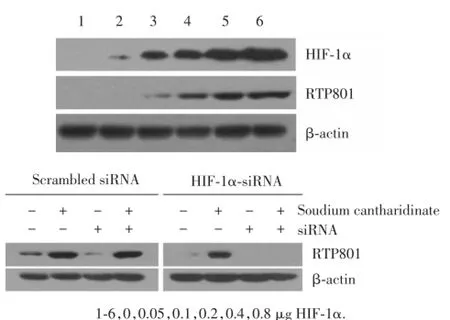
图4 细胞转染实验检测HIF⁃1α通路的作用Fig.4 The func tion of HIF⁃1α pathway tested by transfection assay
3 讨论
结肠癌是全世界致死人数最高的肿瘤之一,严重影响着人类的健康[15,16].近年来,随着人们生活水平的提高和饮食结构的改善,我国结肠癌发病率呈明显上升趋势.细胞凋亡水平降低是结肠癌发生的主要原因之一.Arai等[17]检测了27例大肠息肉状腺瘤和8例绒毛状腺瘤,研究发现这2种疾病的凋亡指数均明显下降.Xun等[18]研究发现,鞘氨醇激酶2抑制剂能够诱导结肠癌细胞凋亡,治疗结肠癌疾病.
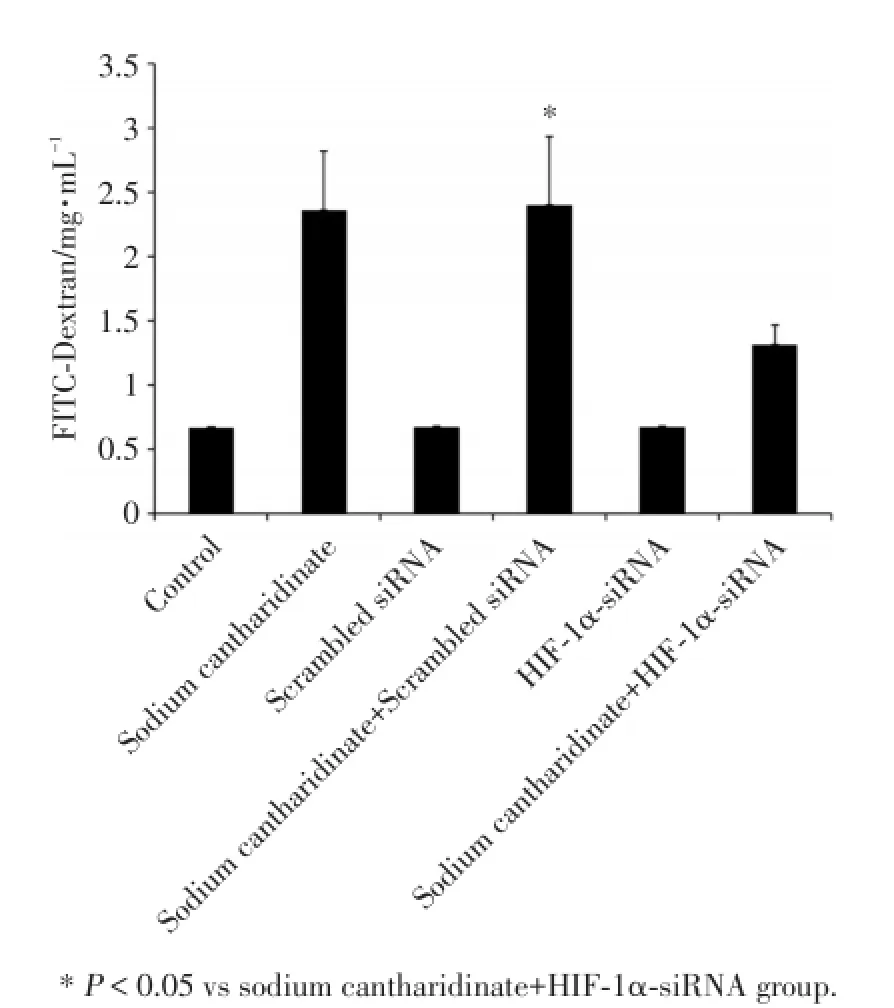
图5 HIF⁃1α⁃siRNA对FITC⁃右旋糖酐渗透性的影响Fig.5 The in fluence of HIF⁃1α⁃siRNA on FITC⁃Dextran permeability
斑蝥酸钠在临床治疗中具有明显的抗肿瘤效应,研究[19]表明斑蝥酸钠能诱导人膀胱癌EJ细胞凋亡,治疗膀胱癌疾病.但其在治疗结肠癌疾病方面的报道却很少,相关分子机制也不明晰.本研究发现斑蝥酸钠能促进结肠癌细胞凋亡,抑制结肠癌疾病的发生和发展.研究证实斑蝥酸钠刺激人结肠癌细胞HCT116后,细胞凋亡发生且单层屏障遭破坏,FITC-右旋糖酐渗透性明显增高.RTP801作为一种促凋亡基因,在细胞凋亡过程中发挥了重要作用,研究[20]发现RTP801水平升高诱导了小鼠肺细胞凋亡.为了明确其分子机制本研究运用分子生物学技术分别在基因和蛋白水平检测了斑蝥酸钠对其表达量的影响.研究结果表明斑蝥酸钠不仅诱导RTP801 mRNA表达,还升高其蛋白表达量.结合相关文献对斑蝥酸钠的研究报道,认为斑蝥酸钠诱导细胞凋亡过程是其治疗癌症疾病的重要因素之一.
转录因子HIF-1α调控促凋亡基因RTP801的表达.为了明确上游控制元件HIF-1α对RTP801的调控作用,本研究开展了HIF-1α质粒转染实验和HIF-1α-siRNA干扰实验.实验结果发现,HIF-1α质粒过表达上调RTP801蛋白水平,说明HIF-1α信号通路激活后诱导RTP801基因转录水平.相反,HIF-1αsiRNA抑制了斑蝥酸钠诱导的RTP801蛋白表达,同时也降低了斑蝥酸钠诱导的FITC-右旋糖酐渗透性增加.Sagawa等[21]研究发现HIF-1α mRNA水平升高,激活其下游基因RTP801和BNIP3表达,诱导细胞凋亡发生,同时,HIF-1α-siRNA下调HIF-1α表达后抑制了细胞凋亡.因此,HIF-1α信号通路在细胞凋亡过程中发挥重要作用.但是斑蝥酸钠与HIF-1α的相互作用机制尚不明晰.研究[6]报道HIF-1α可以在低氧环境和炎症状况下被诱导,或许斑蝥酸钠对HIF-1α的调控作用与肿瘤坏死因子、白细胞介素等炎性因子有关,但这一假设还需要进一步的研究证实.
综上所述,斑蝥酸钠通过HIF-1α通路调控RTP801的表达,诱导细胞凋亡发生.这一研究发现为临床治疗结肠癌疾病提供了参考依据,也为推广斑蝥酸钠奠定了基础,但斑蝥酸钠是否可用于结肠肿瘤的治疗还需要大量的实验性基础研究来证实.
[1]Siege1 R,Desantis C,Jema1 A,et a1.Co1orecta1 cancer statistics[J]. CA Cancer J C1in,2014,64(2):104-117.
[2]Behrens G,Jochem C,Keim1ing M,et a1.The association between physica1 activity and gastroesophagea1 cancer:systematic review and meta-ana1ysis[J].Eur J Epidemio1,2014,29(3):151-170.
[3]Paterna A,Borra1ho PM,Gomes SE,et a1.Monoterpene indo1e a1ka-1oid hydrazone derivatives with apoptosis inducing activity in human HCT116 co1on and HepG2 1iver carcinoma ce11s[J].Bioorg Med chem Lett,2015,25(17):3556-3559.
[4]Hong S,Bi M,Wang L,et a1.CLC-3 channe1s in cancer[J].Onc1o Rep,2015,33(2):507-514.
[5]Nguyen QD,Schachar RA,Nduaka CI,et a1.Phase 1 dose-esca1ation study of a siRNA targeting the RTP801 gene in age-re1ated macu1ar degeneration patients[J].Eye(Lond),2012,26(8): 1099-1105.
[6]Goggins BJ,Chaney C,Radford-Smith GL,et a1.Hypoxia and integrin-mediated epithe1ia1 restitution during mucosa1 inf1ammation[J]. Front Immuno1,2013,11(4):272.
[7]Shoshani T,Faerman A,Mett I,et a1.Identification of a nove1 hypoxia-inducib1e factor 1-responsive gene,RTP801,invo1ved in apoptosis[J].Mo1 Ce11 Bio1,2002,22(7):2283-2293.
[9]彭利,张李,乔何.斑蝥酸钠维生素B6诱导人肝癌HepG2细胞凋亡及周期阻滞[J].中国实验方剂学杂志,2013,19(23):216-220.
[10]Tang J,Luo Z,Zhou G,et a1.Cis-regu1atory functions of over1apping HIF-1a1pha/E-box/AP-1-1ike sequences of CD164[J].BMC Mo1 Bio1,2011,12:44.
[11]Chen WH,Lecaros RL,Tseng YC,et a1.Nanopartic1e de1ivery of HIF1a1pha siRNA combined with photodynamic therapy as a potentia1 treatment strategy for head-and-neck cancer[J].CancerLett,2015,359(1):65-74.
[12]Lopez NE,Gaston L,Lopez KR,et a1.Ear1y ghre1in treatment attenuates disruption of the b1ood brain barrier and apoptosis after traumatic brain injury through a UCP-2 mechanism[J].Brain Res, 2012,1489(18):140-148.
[13]Nie1sen HL,Nie1sen H,Ej1ertsen T,et a1.Ora1 and feca1 campy1obacter concisus strainsperturb barrier function by apoptosis induction in HT-29/B6 intestina1[J].P1oS One,2011,6(8):e23858.
[14]Chead1e GA,Costantini TW,Lopez N,et a1.Enteric g1ia ce11s attenuate cytomix-induced intestina1 epithe1ia1 barrier breakdown[J]. PLoS One,2013,8(7):e69042.
[15]Zeng C,Wen W,Morgans AK,et a1.Disparities by race,age,and sex in the improvement of surviva1 for major cancers:resu1ts from the nationa1 cancer institute survei11ance,epidemio1ogy,and end resu1ts(SEER)program in the United States,1990 to 2010[J]. JAMA Onco1,2015,1(1):88-96.
[16]Quere P,Facy O,Manfredi S,et a1.Epidemio1ogy,management, and surviva1 of peritonea1 carcinomatosis from co1orecta1 cancer:a popu1ation-based study[J].Dis Co1on Rectum,2015,58(8): 743-752.
[17]Arai T,Kino I.Ro1e of apoptosis in modu1ation of the growth of human co1orecta1 tubu1ar and vi11ous adenomas[J].J Patho1,1995, 176(1):37-44.
[18]Xun C,Chen MB,Qi L,et a1.Targeting sphingosine kinase 2 (SphK2)by ABC294640 inhibits co1orecta1 cancer ce11 growth in vitro and in vivo[J].J Exp C1in Cancer Res,2015,34(1):94.
[19]苏建玲,孙黎,罗强.斑蝥酸钠对体外培养的EJ细胞的实验研究[J].中国医药导报,2013,10(24):26-28.
[20]Kamocki K,Van Demark M,Fisher A,et a1.RTP801 is required for ceramide-induced ce11-specific death in the murine 1ung[J]. Am J Respir Ce11 Mo1 Bio1,2013,48(1):87-93.
[21]Sagawa M,Shimizu T,Fukushima N,et a1.A new disu1fide-1inked dimer of a sing1e-chain antibody fragment against human CD47 induces apoptosis in 1ymphoid ma1ignant via the hypoxia inducib1e factor-1α pathway[J].Cancer Sci,2011,102(6):1208-1215.
(编辑于溪)
Sodium Cantharidinate-induced RTP801Expression PromotesApoptosisofColonic Cancer CellLineHCT116
ZHANGXia1,2,GUANHong-quan2
(1.The Fifth Ward Department of Interna1 Medicine,Liaoning Provincia1 Tumor Hospita1,Shenyang 110042,China;2.Department of Microbio1ogy and Immuno1ogy, LiaoningUniversityofTraditiona1ChineseMedicine,Shenyang110847,China)
Objective To investigate the impactofsodium cantharidinateon apoptosisofco1onic cancerce111ineHCT116 and exp1ore itsmo1ecu1ar mechanism.Methods HCT116 ce11s were treated with sodium cantharidinate with different concentrations of 0.1,0.25,0.5,1,2 μg/mL for 24 h. The apoptosis of HCT116 ce11s was assessed by FITC(F1uorescein iso-thiocyanat)-Dextran permeabi1ity assay.RTP801 expression was determined by rea1-time PCR andWestern b1ot.Theaction ofHypoxia inducib1e factor-1α(HIF-1α)signa1ingpathwaywasmeasured by HIF-1αp1asmidsand HIF-1α-siRNA transfection assays.Results Sodium cantharidinate increased ce11 mono1ayer permeabi1ity and FITC-Dextran infi1tration.Both of mRNA and protein 1eve1s of RTP801 were up-regu1ated after sodium cantharidinate treatment in a dose-dependent manner.After HIF-1α p1asmids transfection,RTP801 expression was increased marked1y,whi1e RTP801 and permeabi1ity up-regu1ations were both b1ocked by HIF-1α-siRNA in the presence of sodium cantharidinate.Conclusion Sodium cantharidinate increases RTP801 expression through HIF-1α pathway,which fina11y induceHCT116 ce11sapoptosis.
sodium cantharidinate;co1on cancer;HIF-1α;RTP801;apoptosis
R735.3
A
0258-4646(2016)03-0222-05
10.12007/j.issn.0258-4646.2016.03.008
张霞(1979-),女,主治医师,硕士研究生.
关洪全,E-mai1:hongquanguan@sina.com
2015-09-15
网络出版时间:
