酒石酸长春瑞滨脂质微球注射液对荷人乳腺癌裸鼠肿瘤生长的影响
2016-09-02齐雪松王春燕
齐雪松,李 宁,王春燕,佟 鹏,苟 巧,郑 辉
酒石酸长春瑞滨脂质微球注射液对荷人乳腺癌裸鼠肿瘤生长的影响
齐雪松,李宁,王春燕,佟鹏,苟巧,郑辉*
(中国疾病预防控制中心辐射防护与核安全医学所,中国疾病预防控制中心辐射防护与核安全应急重点实验室,北京100088)
目的: 研究酒石酸长春瑞滨脂质微球注射液(NVB-lip)对荷人乳腺癌裸鼠肿瘤生长的影响。方法:35只雌性BALB/c-nu裸鼠,随机分为NVB-lip高(10 mg/kg)、中(5 mg/kg)、低(2.5 mg/kg)剂量组,阳性对照组(酒石酸长春瑞滨注射液,5 mg/kg)和阴性对照组(脂质化空白溶液),每组7只。给裸鼠接种人乳腺癌BCAP-37瘤株,待成瘤后,每只动物每次按0.20 mL经尾静脉注射给药,间隔3~4 d注射1次,每周注射2次,共注射6次。在第1次注射后第4、7、11、14、18和23天时分别称小鼠体质量和测量肿瘤体积,计算得出相对肿瘤体积、相对肿瘤增殖率和肿瘤抑制率。结果:与阴性对照组相比,各组荷瘤裸鼠体质量差异均无统计学意义(P均>0.05)。NVB-lip各剂量组的相对肿瘤体积和相对肿瘤增殖率显著减小,肿瘤抑制率显著增大,差异均有统计学意义(P<0.01)。结论:NVB-lip在2.5~10 mg/kg范围内抑瘤作用明显,具有可开发潜力。
酒石酸长春瑞滨脂质微球注射液;裸鼠;人乳腺癌;肿瘤抑制
【ABSTRACT】OBJECTIVE: To study the effect of vinorelbine tartrate lipid microsphere (NVB-lip) injection on growth of human breast cancer cells in nude mice. METHODS:35 female BALB/c-nu mice were inoculated with human breast cancer BCAP-37 cells. These mice were divided randomly into 5 groups for further treatments:NVB-lip high dose group (NVB-lip 10 mg/kg),medium dose group (NVB-lip 5 mg/kg),low dose group (NVB-lip 2.5 mg/kg),positive drug control group (NVB-free 5 mg/kg) and negative control group (only lipid microsphere). There were 7 mice each group. Injection with NVB-lip was done after 6-8 days when the tumors shaped. NVB-lip was injected intravenously every 3 or 4 days each week for 6 times in total. Weights and tumor volumes(VT) of mice were observed and measured on No. 4,7,11,14,18 and 23 days from the first injection. Relative tumor volumn(VRT) ,relative tumor proliferation rate and tumor inhibition rate were calculated. RESULTS:The weights of nude mice for different groups increased slowly but the differences were not statistically significant. Compared with the negative group,the VRTand relative tumor proliferation rates of NVB-lip groups were reduced but tumor inhibition rate was increased. The differences were statistically significant (P<0.01). CONCLUSION:The inhibition of NVB-lip high dose group(2.5-10 mg/kg) was more obviously than that of the other groups. NVB-lip may h ave c linical a pplications.
【KEY WORDS】vinorelbine tartrate lipid microsphere injection;nude mice;human breast cancer;tumor inhibition
酒石酸长春瑞滨(vinorelbine tartrate,NVB)是一种新型长春花生物碱类抗肿瘤药物,具有较强的抗肿瘤活性,是治疗转移或复发性乳腺癌、非小细胞肺癌、卵巢癌、恶性淋巴瘤等有效的化疗药物之一[1-3]。由于该药在血液、神经、消化和心血管等方面的毒性使其临床应用受到一定的限制[4-6]。为降低NVB的毒副作用,将其制成脂质微球制剂成为近年来采用的方法。但NVB脂质微球制剂尚在实验研究阶段,其抑瘤效果有待明确。
乳腺癌是女性中发病率较高的肿瘤,且发病呈年轻化趋势,因而对研发高效、低毒作用的抗癌药物需求较为迫切。本研究通过荷人乳腺癌裸鼠模型观察比较酒石酸长春瑞滨脂质微球注射液(vinorelbine tartrate lipid microsphere injection,NVB-lip)抑制肿瘤生长或增殖药效作用,为NVB新型制剂在乳腺癌治疗的临床应用奠定实验基础。
1 材料与方法
1.1实验动物
BALB/c-nu裸鼠,35只,雌性,由北京大学医学部实验动物科学部提供。实验动物生产许可证号:SCXK(京)2006-0008;实验动物使用许可证号:SCXK (京)2006-0025。采用BALB/c-nu裸鼠无菌饲养罩在北京大学医学部实验动物科学部常规饲养。
1.2瘤源
人乳腺癌BCAP-37瘤株由中国医学科学院药物研究所药理一室提供。瘤株已分别接种到BALB/c-nu裸鼠并且成瘤。
1.3主要试剂
酒石酸长春瑞滨脂质微球注射液(1 mg/mL)和空白脂质微球注射液(每瓶5 mL)由沈阳药科大学提供,酒石酸长春瑞滨注射液(10 mg/mL,NVB-free)购自江苏豪森药业股份有限公司,无菌注射用水(每瓶10 mL),购自大通惠达药业有限公司。所有试剂4 ℃ 密封保存。
1.4实验方法
1.4.1瘤块移植接种方法常规消毒裸鼠胸腹部皮肤,在无菌下剥离瘤块,去除瘤块中心坏死组织和瘤块周围纤维和脂肪组织,将肿瘤组织切割成1.5 mm× 1.5 mm×1.5 mm的肿瘤组织块。用眼科镊将2块肿瘤组织移植到裸鼠右前肢腋窝皮下。
1.4.2荷瘤动物分组和处理移植肿瘤6~8 d后进行随机分组,称量各组裸鼠体质量并测量给药前肿瘤体积(V0)后开始经尾静脉注射给药。根据肿瘤生长快慢和动物体质量差异,将35只裸鼠随机分为5组,每组7只动物。
参照酒石酸长春瑞滨注射液临床应用方法、推荐剂量和预实验中小鼠对该受试药物的最大耐受剂量结果,将受试药物(NVB-lip)设计为高(10 mg/kg)、中(5 mg/kg)、低(2.5 mg/kg)3个剂量组,分别相当于人体质量有效剂量的13、6.5和3.3倍。另设阳性对照组(NVB-free,5 mg/kg),相当于人体质量有效剂量的6.5倍;阴性对照组(脂质化空白溶液)。各剂量组受试药物均用空白脂质化溶液按所需浓度配制,每只动物每次注射体积按0.20 mL经尾静脉注射给药,间隔3~4 d注射1次,每周注射2次,共注射6次。
1.4.3荷人乳腺癌瘤株裸鼠肿瘤生长指标的测定荷瘤裸鼠在第1次注射后第4、7、11、14、18和23天时分别用游标卡尺测量肿瘤直径并称取裸鼠体质量,于末次给药后24 h处死动物,称取体质量,剥离肿瘤块,称瘤质量,观测和比较不同实验组荷瘤裸鼠给药后肿瘤生长的差异,并按下列公式计算肿瘤体积(tumor volum, VT) 、相对肿瘤体积(relative tumor volum,VRT) 、相对肿瘤增殖率(relative tumor proliferation rate,T/C)和肿瘤抑制率(tumor inhibition rate,ri):

其中a、b、c分别表示测量肿瘤的长、宽、高;V为给药前测量所得肿瘤体积;m-为对照组平均肿瘤质
0-C量,mT为 给药组平均肿瘤质量。
1.5统计学方法
全部实验数据均进行方差齐性检验,若方差齐性,进行t检验;若方差不齐,进行秩和检验。应用SAS 9.0统计软件,检验水准为α=0.05。
2 结果
2.1各组荷人乳腺癌瘤株裸鼠给药期间体质量的变化
见表1。各组荷瘤裸鼠随给药时间延长体质量有所增长,但各给药组体质量变化与阴性对照组比较,差异均无统计学意义(P均>0.05)。
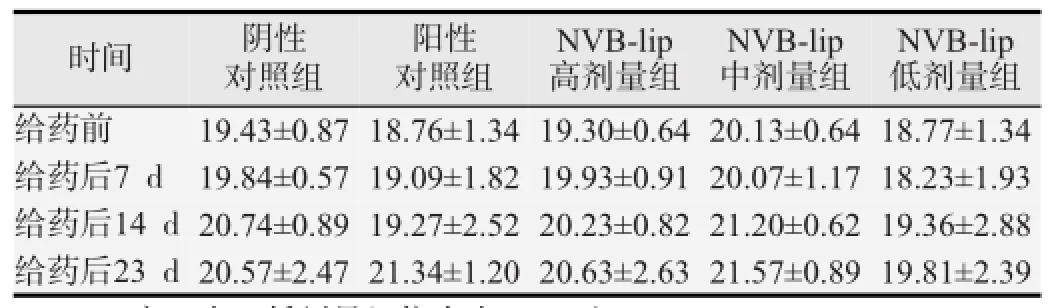
表1 荷人乳腺癌裸鼠体质量变化(g)
2.2各组荷人乳腺癌裸鼠给药期间VRT和 相对肿瘤增殖率的变化
由表2可见,随着给药时间的延长,各实验组的相对肿瘤体积VRT均逐渐增大。与阴性对照组比较,差异均具有统计学意义(P<0.01),其中NVB-lip高剂量VRT减小趋势更明显。与阳性对照组比较,NVB-lip中剂量组VRT未见明显差异,NVB-lip高剂量组VRT在 给药后第18天和第23天显著减小(P<0.05),低剂量组VRT在 给药后第14天增大(P<0.05),其余时间点均无显著差异。以第23天观察的数据建立NVB-lip剂量效应关系曲线为:y=-2.10x+43.38(校正的决定系数=0.99, P<0.05),提示NVB-lip具有明显抑制人乳腺癌生长或增殖药效的作用,并在2.5~10 mg/kg范围内具有剂量效应关系,即随着NVB-lip剂量的增大VRT减 小。
各给药组给药期间移植肿瘤的相对增殖率均可见不同程度的增加,见表3。其中NVB-lip高剂量组增加最少,阳性对照组和NVB-lip中剂量组次之,NVB-lip低剂量组均高于上述各给药组。NVB-lip中、低剂量组的相对肿瘤增殖率从给药后第11天达到峰值后呈缓慢下降趋势(P<0.05)。
RT
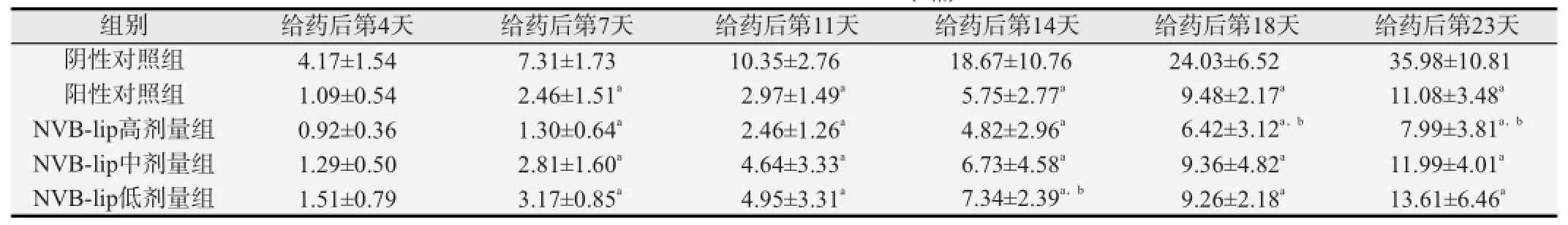
表2 荷人乳腺癌裸鼠相对肿瘤体积(V)的比较
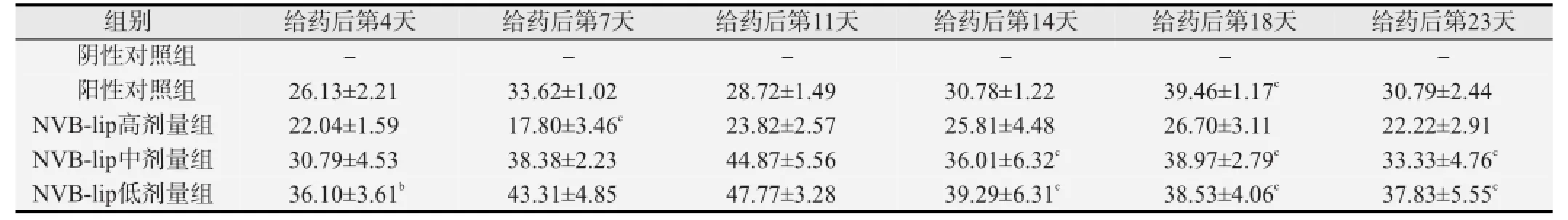
表3 荷人乳腺癌裸鼠相对肿瘤增殖率的比较(%)
2.3 各组荷人乳腺癌裸鼠肿瘤质量和肿瘤生长抑制率的比较
末次给药后肿瘤质量和肿瘤抑制率变化显示,各给药组荷瘤动物平均瘤质量均明显低于阴性对照组,差异均有统计学意义(P均<0.01)。各给药组组间比较,NVB-lip高剂量组瘤质量最小,肿瘤抑制率最高;NVB-lip中剂量组次之;NVB-lip低剂量组与阳性对照接近,且两者间差异无统计学意义(P>0.05)。见表4。
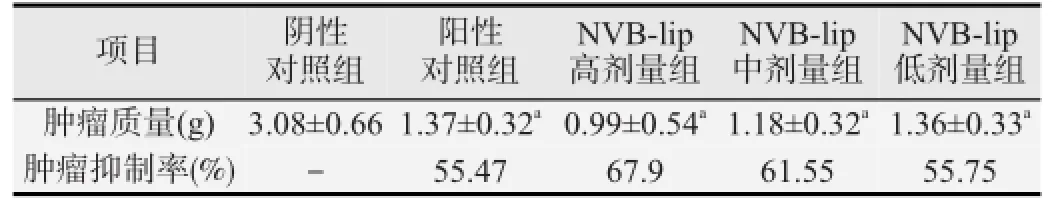
表4 荷人乳腺癌裸鼠肿瘤质量和肿瘤抑制率的变化
3 讨论
NVB主要作用于肿瘤细胞G2期,属于细胞周期特异性药物,它与微管蛋白单体结合,抑制微管的形成,并且具有高度脂溶性,对微管具有解聚作用。正是NVB的这些作用,使肿瘤细胞的分裂增殖停止于有丝分裂中期,从而产生抗肿瘤作用[7]。NVB的抗肿瘤活性十分明显,但其毒副作用使患者不易坚持使用,成为其在临床应用中的限制。脂质体包封可以有效的降低NVB的毒副作用,减少药物在正常组织中的分布,增加药物在肿瘤组织中的蓄积[8],且不会改变药物的主要质量指标[9-10],但脂质体是否会降低药物效用始终是临床工作人员关注的焦点。
本文以荷瘤人乳腺癌裸鼠模型为研究对象,观察NVB-lip抑制肿瘤生长或增殖药效的作用。根据各实验组荷瘤裸鼠相对肿瘤体积、相对肿瘤增殖率、肿瘤质量和肿瘤抑制率指标的变化发现,随着NVB-lip给药剂量增加,移植的肿瘤增殖减慢,瘤体发生不同程度的缩小,抑瘤效果明显。通过给药后第23天相对肿瘤体积的观察发现NVB-lip在2.5~10 mg/kg范围内具有剂量效应关系,抑制肿瘤细胞增殖作用随给药剂量增加而增加。末次给药后各给药组肿瘤质量和肿瘤抑制率结果显示,NVB-lip具有明显抑制肿瘤生长的作用。从NVB-lip 2.5和5 mg/kg剂量组的相对肿瘤增殖率变化还可发现,在连续给药11 d时达到峰值后呈现缓慢下降的趋势,这可能与脂质体在体内随循环时间延长,有助于增加扩散到肿瘤组织中的药物分布量,进而增加药效有关[11],关于NVB-lip在荷瘤小鼠体内的药代动力学研究也证实了此观点[12]。NVB-lip低剂量(2.5 mg/kg)组的抑瘤作用与阳性对照(NVB-free)的抑瘤作用效果相当,证实脂质体包封并没有影响NVB的抑瘤药效作用,且高剂量(10 mg/kg)抑瘤作用更优。另外,通过对实验动物的体质量和外观观察,并未发现脂质体对机体产生明显损害或毒性,与Wakelee报道一致[13]。根据上述实验结果可预测,NVB-lip的抑瘤作用可靠,药效作用与同剂量阳性对照比较未见明显变化,故认为NVB-lip具备可开发潜力[14]。本研究未涉及NVB-lip对正常组织器官的影响,后续将进一步深入研究。
[1] 王莉芳,王彩霞,魏娜,等. 酒石酸长春瑞滨脂质体注射液的安全性及抗肿瘤作用研究[J]. 中国药理学通报,2012,28(11):1627-1628.
[2] 王凤岐,陈海霞. 重酒石酸长春瑞滨注射液治疗乳腺癌患者的临床研究[J]. 当 代医学,2011,17(29):133-134.
[3] 谢荣盛,陈勇,梁业,等. 重酒石酸长春瑞滨联合5-氟尿嘧啶二线治疗晚期胃癌的临床观察[J]. 长江大学学报,2014,11(27):60-61.
[4] 乔宝红,宋淑英. 重酒石酸长春瑞滨注射后出现渗漏患者的处理[J]. 陕 西医药杂志,2012,41(5):517.
[5] 王秀云,吴情,凌芳芳. 冰敷预防重酒石酸长春瑞滨引发静脉炎46例效果观察[J]. 齐鲁护理杂志,2009,15(21):21.
[6] 陈尚瑜,杨建峰. 重酒石酸长春瑞滨注射液致过敏性休克1例[J]. 医药导报,2012,31(9):1231.
[7] 裴天仙,王晶晶,滕晋莹,等. 酒石酸长春瑞滨对大鼠免疫和造血系统的长期毒性作用[J]. 中国药理学与毒理学杂志,2014,28(4):562-568.
[8] Galano G,Caputo M,Tecce MF,et al. Efficacy and tolerability of vinorelbine in the cancer therapy[J]. Curr Drug Saf,2011,6(3):185-193.
[9] 王幸平,王志媛,龚伟,等. 酒石酸长春瑞滨成循环热敏脂质体的荷瘤小鼠药效学研究[J]. 军事医学,2012,36(5):362-364.
[10] Bahadori F,Topcu G,Eroqiu MS,et al. A new lipid-based nano formulation of vinorelbine[J]. AAPS Pharm Sci Tech,2014,15(5):1138-1148.
[11] 王栋海,解李丽,张勇,等. PEG2000-DSPE含量不同的酒石酸长春瑞滨脂质体的制备和评价[J]. 中国医药工业杂志,2014,45(11):1046-1049.
[12] 庄翌,陈建伟,徐鑫鑫,等. 长春瑞滨脂质体与长春瑞滨注射液在荷瘤小鼠体内的药代动力学及组织分布[J]. 中国药科大学学报,2013,44(3):253-256.
[13] Wakelee HA,Middleton G,Dunlop D,et al. A phase I pharmacokinetic study of bexarotene with vinorelbine and cisplatin in patients with advanced non-small-cell lung cancer (NSCLC)[J]. Cancer Chemother Pharmacol,2012,69(3):815-824.
[14] Shi JF,Sun MG,Li XY,et al. A combination of targeted sunitinib liposomes and targeted vinorelbine liposomes for treating invasive breast cancer[J]. J Biomed Nanatechnol,2015,11(9):1568-1582.
Effect of vinorelbine tartrate lipid microsphere injection on growth of human breast cancer cells in nude mice
QI Xuesong,LI Ning,WANG Chunyan,TONG Peng,GOU Qiao,ZHENG Hui*
(Key Laboratory of Radiological Protection and Nuclear Emergency, National Institute for Radiological Protection, China CDC, Beijing 100088, China)
R730.1
A
1004-616X(2016)02-0103-04
1 0.3969/j.issn.1004-616x.2016.02.004
2015-11-02;
2015-11-26
作者信息: 齐雪松,E-mail:cedar121@sina.com。*
,郑辉,E-mail:Z henghui@nirp.net
