4-硝基喹啉-1-氧化物诱导食管鳞状细胞癌发生的研究进展
2016-09-02陈欣然韩利霞单保恩
陈欣然,王 玲,王 薇,3,韩利霞,4,刘 莉,5,单保恩,,
4-硝基喹啉-1-氧化物诱导食管鳞状细胞癌发生的研究进展
陈欣然1,王玲2,王薇1,3,韩利霞1,4,刘莉1,5,单保恩1,2,*
( 1. 河 北医科大学第四医院科研中心,河北石家庄050035;2. 河 北医科大学第四医院肿瘤研究所免疫室,河北石家庄050035;3. 河北省人民医院临床检验科,河北石家庄050057;4. 河北省儿童医院输血科,河北石家庄050030;5. 白求恩国际和平医院256临床部检验科,河北石家庄050080 )
食管鳞状细胞癌(ESCC)是一种常见且预后较差的恶性肿瘤,其发病机制尚未完全明确。建立ESCC模型,研究ESCC发病机制,对于降低ESCC的发病率和病死率具有重要意义。4-硝基喹啉-1-氧化物(4NQO)是一种肿瘤诱导剂,已广泛用于口腔癌的研究,而在ESCC研究中的应用还较少。因此,本文就4NQO体内代谢特点、诱导ESCC模型及诱癌机制的相关文献进行综述,以期为食管癌的防治提供一些新的研究线索。
4-硝基喹啉-1-氧化物;食管鳞状细胞癌;癌前病变;肿瘤诱导剂
目前,食管癌已成为严重影响人类生存及生活质量的肿瘤之一,其发病率和病死率分别位居世界恶性肿瘤发病率的第8位和第6位[1]。中国是食管癌的高发国家,发病率和死亡率分别占全球食管癌发病率和死亡率的52.8%和49.3%[2]。食管癌的高发省份为河北、河南、福建和重庆,其次为新疆、江苏、山西、甘肃和安徽。在河南林州,食管癌和贲门癌发病率最高,占当地所有恶性肿瘤的81.4%[3]。食管癌分为食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)和食管腺癌[4]。中国的食管癌高发区95%以上为鳞状细胞癌,因此建立ESCC模型,研究ESCC的自然进程和发病机制,对于我国食管癌的预防和治疗,降低食管癌的发病率和病死率,具有非常重要的意义。
ESCC的诱因很多,主要包括吸烟、饮酒、摄入过量含亚硝酸的食物或水,营养不均衡等。其中,亚硝酸物质摄入过量已成为目前公认的ESCC的主要诱发因素[2]。4-硝基喹啉-1-氧化物(4-nitroquinoline-1-oxide,4NQO)是一种水溶性喹啉衍生物,能够通过氧化应激损伤和抑制DNA合成等机制诱导鳞状细胞癌的产生[5]。前期动物实验研究表明,4NQO诱导肿瘤的形成具有一定的组织特异性,口服主要诱导口腔及上消化道系统肿瘤的形成,而皮下注射主要诱导肺癌的形成[6-9]。目前对于4NQO诱导口腔癌的研究报道较多,而对ESCC的报道较少。因此,本文主要就4NQO的理化性质、体内代谢特点、诱导ESCC模型及诱癌机制进行简要综述。
1 4NQO体内代谢特点及诱癌机制
4NQO为喹啉类衍生物,黄色粉末,易溶于水,为诱癌前体物,进入体内后,通过代谢成有活性的代谢产物发挥诱癌作用,其致癌作用起始于其硝基集团被还原。4NQO被NADH:4NQO硝基还原酶还原成4-羟胺酸喹啉-1-氧化物(4-hydroxyaminoquinoline-1-oxide,4HAQO)和NADPH:苯醌还原酶[10]。带有4个电子的产物4HAQO是DNA加成物。4HAQO可进一步被乙酰化代谢,并形成DNA加成物。4NQO的代谢产物在DNA的很多位点形成加成物,色谱分析表明有2个鸟嘌呤和1个腺嘌呤加成位点,但体内研究表明4HAQO优先与鸟嘌呤加成。4NQO乙酰化代谢产物的3、4位可分别与鸟嘌呤的N2和C8位结合,与N2结合导致的突变较强而与C8结合导致的突变较弱,这种结合可导致鸟嘌呤被嘧啶代替[11]。4NQO还是UV类似物,可导致庞大的DNA加成物[12]。
4NQO活性代谢产物可通过氧化还原作用产生活性氧如超氧自由基和过氧自由基。氧化还原作用是在酶的催化下,喹啉化合物得到一个电子,继而再将电子传递给一分子的氧,即产生超氧离子或过氧离子[13]。活性氧与细胞内具有氧化还原状态的信号转导蛋白结合,将其从还原态氧化成氧化态,从而激活转录因子的产生并诱导肿瘤形成。
4NQO诱导的基因毒性和细胞毒性可被多药耐药蛋白(multidrug resistance protein,MRP)和硫代转移酶P1-1(gluthathione S-transferase P,GSTP1-1)逆转[14]。4NQO是硫代转移酶P(含GSTP1-1)的作用底物,其结合可被MRP带出细胞。用放射活性的4NQO分析4NQO-DNA加成物的细胞毒性检测表明MRP和GSTP1-1可对4NQO加成和细胞毒性产生高水平的保护作用。然而,MRP或GSTP1-1单独作用对4NQO介导的细胞毒性保护作用很弱。这说明MRP和GSTP1-1在4NQO诱导肿瘤形成的起始和进展过程中起重要的协同保护作用。
4NQO诱导肿瘤形成具有一定的组织特异性,口服摄入其肿瘤发生部位主要集中在舌的背面和腹面,腭部和食管[15-17],而皮下注射还会影响到肺[18]。4NQO还原酶(硫辛酸氨脱氢酶)通过还原活化4NQO,对4NQO的敏感性起重要作用。食管部位存在大量的硫辛酸氨脱氢酶,因此与其他消化道相比,食管对4NQO的诱导作用更敏感。另外,4NQO还原酶的浓度与口腔黏膜鳞状细胞癌发病率呈正相关[19]。这些结果表明高4NQO还原酶活性可增加4NQO诱癌的易感性[14]。
4NQO在诱导肿瘤形成模型中具有一定的种属特异性。4NQO对不同大鼠种系[Dark A gouti ( DA)、Long E vans、S prague D waley (SD)、ACI/MS Fisher 344、Donryu和Wistar/Furth (WF)]作用不同, WF大鼠耐受性较强而DA对4NQO诱导鳞状细胞癌最敏感[20]。DA和WF杂交大鼠是DA大鼠敏感性的5倍[21]。因此,用4NQO作为致癌诱导剂,其保护或敏感区域基因均可被鉴定。推测这些敏感及耐受基因及其与鳞状细胞癌的关系对于探索恶性肿瘤的发生机制具有重要的作用。
2 4NQO体外细胞毒性研究
目前尚无4NQO对食管鳞状细胞的作用研究。Darroudi等[22]发现4NQO可造成中国仓鼠紫外线敏感损伤修复缺陷的CHO细胞和43-3B细胞死亡、染色体异常和姐妹染色单体置换。Bosselaers等[23]报道4NQO可造成中国仓鼠肺V79细胞姐妹染色单体异常。在4NQO对头颈部细胞的作用研究中,Kim等[24]用mtDNA(线粒体DNA)/nDNA(核DNA)比率反映线粒体损伤修复能力,结果表明,与4NQO未处理组相比,4NQO作用24 h的JHUO19 (舌癌细胞)和JHU-O22(扁桃体淋巴结转移细胞)细胞mtDNA/nDNA比率分别降低37%和40%,而用于对照的角化细胞系mtDNA/nDNA比率却有所增加。由以上结果可知,4NQO具有一定的细胞毒性,能够造成细胞死亡、染色体损伤和染色体损伤修复能力的降低,而4NQO对于食管鳞状细胞的作用还有待进一步的研究。
3 4NQO体内诱导食管鳞状细胞癌的研究
如表1所示,在体内实验中,4NQO可成功诱导食管鳞状细胞癌的形成。目前用于体内研究的动物主要为小鼠,其中常用的是C57BL/6小鼠,其次为CBA,ICR和L2-D1小鼠。虽然饮水法和涂抹法均可诱导鳞状细胞癌的形成,但涂抹法仅用于口腔鳞癌的诱导,而饮水法更适用于食管鳞状细胞癌的研究。一般来说,用于诱导食管鳞状细胞癌的4NQO浓度为50或100 µg/mL,诱癌时间为16~20周,观察时间为28周。诱癌过程中,通过HE染色,可清楚观察到小鼠食管经历正常、上皮增生、原位癌和浸润性癌4个病理过程,病变程度与4NQO浓度和诱癌时间均呈显著正相关。而且,小鼠食管癌形成的病变特点与人食管癌病变形成过程非常相似。综上可知,4NQO饮水法是体内诱导食管鳞状细胞癌的良好模型。
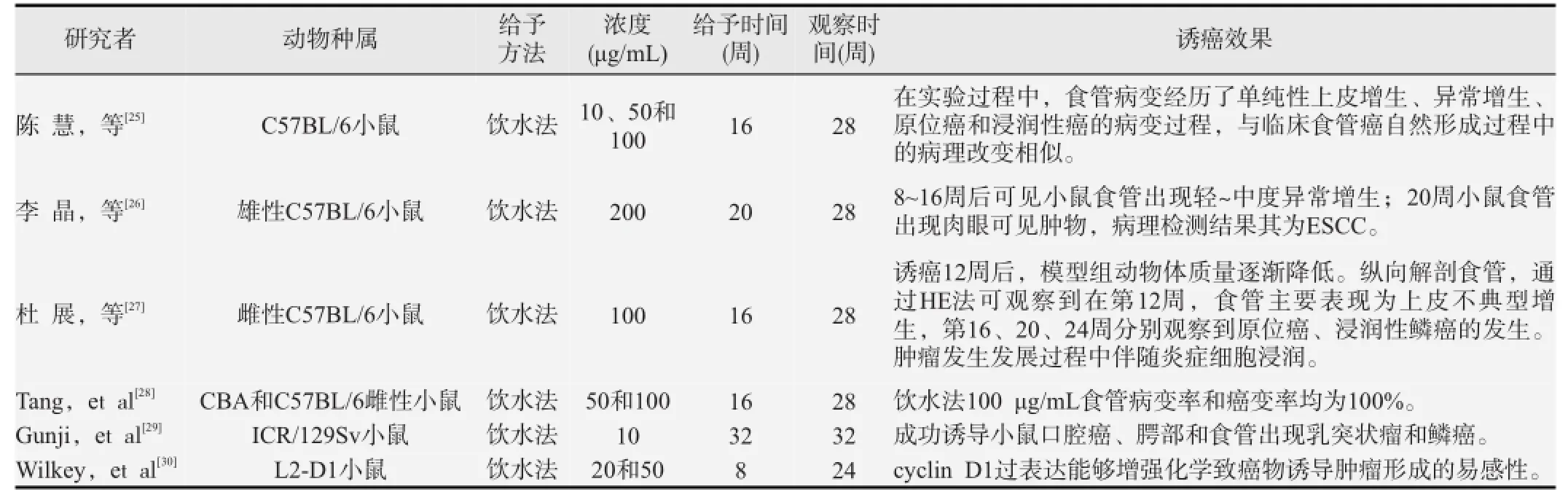
表1 4NQO体内诱导食管鳞状细胞癌实验的总结
4 4NQO诱导食管鳞状细胞癌模型的评价
目前用于食管癌的模型主要有自发性动物模型、移植性动物模型、诱发性动物模型和基因工程模型。4NQO诱发的食管鳞状细胞癌模型较其他类型的模型具有一定的优越性[31]。
自发性动物模型指在自然情况下所发生的食管癌动物模型。该模型完全在自然条件下发生,食管癌的发生、发展过程与人类食管癌相似,主要是反映动物的肿瘤易感性、环境致癌物质和促癌物质的积聚程度。虽然这种模型在理论上较理想,但其存在较大局限性,如发生率低且不稳定,发生时间较难预测且参差不齐,荷瘤动物个体在品系、性别、年龄、肿瘤发生时间、大小等均有较大差异。异种移植模型可以对食管癌组织或者细胞株进行倍增时间、侵袭转移能力等多种表型特性的鉴定,同时对基因、信号通路等相关机制进行研究,最主要的应用是进行相关抗肿瘤药物体内实验。然而,移植瘤模型只是对瘤性组织或具有成瘤性的细胞株的生物学特性进行评估,而无法模拟肿瘤成瘤前的一系列基因突变的累计过程,且不能评估免疫系统在肿瘤进展中的作用,所以,该模型还远不能满足阐明肿瘤发生发展的相关机制的要求。诱发性食管癌动物模型为致癌因素与受体动物食管部位直接或间接接触,使食管部位产生肿瘤的模型。诱发性食管动物模型操作方法简单,靶器官和诱癌剂恒定,诱发成瘤率高,基本模拟了食管癌变的发生过程,接近人类食管癌的发生发展过程,使人们得以有计划、有步骤地观察食管癌变的整个过程,是进行基础和临床食管癌研究的常用方法。目前用于诱发性食管癌的诱癌剂主要有甲基苄基亚硝胺(N-nitrosomethylbenzylamine,NMDA)、甲基戊基亚硝胺(methyl-n-amyl nitrosamine/N-Amyl-N-dimethylnitrosamine,MNAN/AMN)和4NQO。然而,NMDA和MNAN/AMN主要用于大鼠食管癌诱导模型,而4NQO可成功诱导小鼠ESCC。基因工程模型可以通过基因敲入/敲出技术构建基因工程动物,进一步明确特定分子事件在食管癌发生发展各阶段的空间时序,从而找到关键靶标,设计相应靶向治疗药物或者相应的治疗策略。然而,目前用于诱导ESCC的基因工程模型主要局限于CyclinD1过表达转基因小鼠和P53基因突变小鼠,而且两种基因工程小鼠不能直接发生ESCC。
结合以上食管癌模型的特点可以推断诱发性食管癌模型和基因工程模型相结合是诱导ESCC的较好组合。利用基因工程小鼠导入或敲除特定基因后,通过4NQO饮水法诱导小鼠食管鳞状上皮细胞癌及癌前病变,研究靶基因在食管癌形成中的表达变化及在食管癌形成中的作用,既可以较好模拟ESCC的发生过程,又可研究特定基因在食管癌发生发展中的作用,是研究ESCC发病机制及寻找ESCC肿瘤标志物较为理想的模型。
5 展 望
4NQO作为诱癌剂能够成功诱导ESCC,对于研究ESCC的发生机制、寻找ESCC及癌前病变的生物标志物,探索ESCC新的治疗策略具有重要意义。然而,在4NQO诱导的ESCC研究中,肿瘤标志物的研究还较少,因此,应该利用基因工程小鼠联合4NQO诱导模型,加强肿瘤标志物的研究,对食管癌及癌前病变的预防和诊断具有重要意义。另外,应加强体外4NQO对食管鳞状细胞或其相应肿瘤细胞的作用研究,结合体内外实验结果,深入探讨ESCC的发病机制,为ESCC的治疗提供新靶点和新思路。
[1] Herszényi L,Tulassay Z. Epidemiology of gastrointestinal and liver tumors[J]. Eur Rev Med Pharmacol S ci,2010,14(4):249-258.
[2] 吴岩,贺宇彤. 食管癌病因学[J]. 食管外科电子杂志,2014,2(3):114-120.
[3] 赫捷,邵康. 中国食管癌流行病学现状,诊疗现状及未来对策[J]. 中 国癌症杂志,2011,21(7):501-504.
[4] Henry MA,Lerco MM,Ribeiro PW,et al. Epidemiological features of esophageal cancer:Squamous cell carcinoma versus adenocarcinoma[J]. Acta Cir Bras,2014,29(6):389-393.
[5] Kanojia D,Vaidya MM. 4-nitroquinoline-1-oxide induced experimental oral carcinogenesis[J]. Oral Oncol,2006,42(7):655-667.
[6] Imaida K,Sato H,Okamiya H,et al. Enhancing effect of high fat diet on 4-nitroquinoline 1-oxide-induced pulmonary tumorigenesis in ICR male mice[J]. Jpn J Cancer Res,1989,80(6):499-502.
[7] Shrotriya S,Tyagi A,Deep G,et al. Grape seed extract and resveratrol prevent 4-nitroquinoline 1-oxide induced oral tumorigenesis in mice by modulating AMPK activation and associated biological responses[J]. M ol Carcinog, 2015,54(4):291-300.
[8] Chen Y,Jiang Y,Liao L,et al. Inhibition of 4NQO-induced oral carcinogenesis by dietary oyster shell calcium[J]. Integr Cancer Ther,2015. doi:10.1177/1534735415596572.
[9] Jiang Y,Liao L,Shrestha C,et al. Inhibition of 4-nitroquinoline-1-oxide-induced oral carcinogenesis by dietary calcium[J]. Int J Clin Exp Pathol,2015,8(4):3529-3542.
[10] Enson AM. Conversion of 4-nitroquinoline-1-oxide(4NQO) to 4-hydroxyamino- quinoline-1-oxide by a dicumarol-resistant hepatic 4NQO introreductase in rats and mice[J]. Biochem Pharmacol,1993,46(7):1217-1221.
[11] Brüsehafer K,Manshian BB,Doherty AT,et al. The clastogenicity of 4NQO is cell-type dependent and linked to cytotoxicity,length of exposure and p53 proficiency[J]. Mutagenesis,2015. doi:10.1093/ mutage/gev069.
[12] Waters R,Jones CJ,Martin EA,et al. The repair of large DNA adducts in mammalian cells[J]. Mutat Res,1992,273(2):145-155.
[13] Urvalek AM,Osei-Sarfo K,Tang XH,et al. Identification of ethanol and 4-nitroquinoline-1-oxide induced epigenetic and oxidative stress markers during oral cavity carcinogenesis[J]. Alcohol Clin Exp Res,2015,39(8):1360-1372.
[14] Morrow CS,Diah S,Smitherman PK,et al. Multidrug resistance protein and glutathione S-transferase P1-1 act in synergy to confer protection from 4-nitroquinoline-1-oxide toxicity[J]. Carcinogenesis,1998,19(1):109-115.
[15] de Visscher SA,Witjes MJ,vander Vegt B,et al. Localization of liposomal mTHPC formulations within normal epithelium,dysplastic tissue,and carcinoma of oral epithelium in the 4NQO-carcinogenesis rat model[J]. Lasers Surg Med, 2013,45(10):668-678.
[16] Chu M,Su YX,Wang L,et al. Myeloid-derived suppressor cells contribute to oral cancer progression in 4NQO-treated mice[J]. Oral Dis, 2012,18(1):67-73.
[17] Yang Z,Guan B,Men T,et al. Comparable molecular alterations in 4-nitroquinoline 1-oxide-induced oral and esophageal cancer in mice and in human esophageal cancer,associated with poor prognosis of patients[J]. In Vivo, 2013,27(4):473-484.
[18] Nunoshiba T,Demple B. Potent intracellular oxidative stress exerted by the carcinogen 4-nitroquinoline-N-oxide[J]. Cancer Res,1993,53(14):3250-3252.
[19] Booth DR. A relationship found between intra-oral sites of 4NQO reductase activity and chemical carcinogenesis[J]. Cell Tissue Kinet,1990,23(4):331-340.
[20] Kitano M,Hatano H,Shisa H. Strain difference of susceptibility to 4-nitroquinoline-1-oxide-induced togue carcinoma in rats[J]. Jpn J Cancer Res,1992,83(8):843-850.
[21] Tanuma JI,Fujii K,Hiirano M,et al. Five quantitative traint loci affecting 4-nitroquinoline-1-oxide indeced tongue cancer in the rat[J]. Jpn J Cancer Res,2001,92(6):610-616.
[22] Darroudi F,Natarajan AT,Lohman PH. Cytogenetical characterization of UV-sensitive repair-deficient CHO cell line 43-3B II induction of cell killing,chromosomal aberrations and sister-chromatid exchanges by 4NQO,mono- and bi-functional alkylating agents[J]. Mutat Res,1989,212(2):103-112.
[23] Bosselaers IE,Caessens PW,Van Boekel MA,et al. Differential effects of milk proteins,BSA and soy protein on 4NQO- or MNNG-induced SCEs in V79 cells[J]. Food Chem Toxicol,1994,32(10):905-909.
[24] Kim MM,Glazer CA,Mambo E,et al. Head and neck cancer cell lines exhibit differential mitochondrial repair deficiency in response to 4NQO[J]. Oral Oncol,2006,42(2):201-207.
[25] 陈慧,高鑫,李刚,等. 4NQO诱发C57BL/6小鼠舌癌及食管鳞状细胞癌模型的建立[J]. 苏州大学学报:医学版,2010,30(5):972-974.
[26] 李晶,于大海,卿海云,等. 4-硝基喹啉-1-氧化物饮水法构建BALB/C小鼠胃癌及食管癌模型[J]. 中华实验外科杂志,2011,28(9):1411.
[27] 杜展,王超,张勇,等. C57BL/6小鼠食管鳞状细胞癌早期病变的形态学改变[J]. 世 界华人消化杂志,2013,21(2):116-121.
[28] Tang XH,Knudsen B,Bemis D,et al. Oral cavity and esophageal carcinogenesis modeled in carcinogen-treated mice[J]. Clin Cancer Res,2004,10(1):301-303.
[29] Gunji A,Uemura A,Tsutsumi M,et al. Parp-1 deficiency does not increase the frequency of tumors in the oral cavity and esophagus of ICR/129Sv mice by 4-nitroquinoline 1-oxide,a carcinogen producing bulky adducts[J]. Cancer Lett,2006,241(1):87-92.
[30] Wilkey JF,Buchberger G,Saucier K,et al. Cyclin D1 overexpression increases susceptibility to 4-nitroquinoline-1-oxide-induced dysplasia and neoplasia in murine squamous oral epithelium[J]. Mol Carcinog,2009,48(9):853-861.
[31] 黄裔腾,殷秀凯,钟雪云,等. 食管鳞癌动物模型的研究进展[J].世界华人消化杂志,2011,19(16):1704-1710.
R735.1
A
1004-616X(2016)02-0151-04
1 0.3969/j.issn.1004-616x.2016.02.015
2015-07-01;
2015-12-03
国家自然科学基金项目(81173611);河北省重点医学科研课题(zd2013045);河北省教育厅学位办高等学校研究生创新资助项目
作者信息: 陈欣然,E-mail:cxrtht@163.com。*
,单保恩,E-mail:shanbaoen_1962@163.com
