转染Elf5基因的人卵巢癌干细胞增殖、侵袭能力及凋亡变化
2016-08-31仇影影谢肖磊邱玲琳闫洪超
仇影影,谢肖磊,邱玲琳,闫洪超
(1徐州医学院研究生学院,江苏徐州221002;2徐州医学院附属医院)
·基础研究·
转染Elf5基因的人卵巢癌干细胞增殖、侵袭能力及凋亡变化
仇影影1,谢肖磊1,邱玲琳1,闫洪超2
(1徐州医学院研究生学院,江苏徐州221002;2徐州医学院附属医院)
目的观察转染Elf5基因的人卵巢癌干细胞增殖、侵袭能力及凋亡变化。方法将目的基因Elf5+EGFP克隆到载体pcDNA3.1中,构建重组质粒pcDNA3.1-Elf5+EGFP,转入感受态细胞,挑选阳性克隆菌落,大量抽提质粒。培养人卵巢癌干细胞并分为重组质粒组、空质粒组、空白对照组。重组质粒组转染pcDNA3.1-Elf5+EGFP真核表达载体,空质粒组转染pcDNA3.1-EGFP空载质粒,空白对照组不进行转染。采用Western blotting法检测Elf5蛋白。分别于转染后1、2、3、4、5、6 d采用MTT法检测细胞增殖能力;转染24 h后采用侵袭小室检测细胞侵袭能力并计算穿膜细胞数;转染24 h后流式细胞术检测不同周期细胞及凋亡细胞。结果成功构建了pcDNA3.1-Elf5+EGFP真核细胞表达载体,重组质粒组细胞中Elf5蛋白稳定表达。转染后1、2、3、4、5、6 d重组质粒组细胞增殖能力低于空白对照组和空质粒组(P均<0.05)。重组质粒组穿膜细胞数少于空质粒组、空白对照组(P均<0.05)。重组质粒组G0/G1期细胞百分比高于空质粒组、空白对照组(P均<0.05)。重组质粒组细胞凋亡率高于空质粒组、空白对照组(P均<0.05)。结论转染ELF5基因的人卵巢癌干细胞增殖、侵袭能力受到抑制,细胞凋亡增多。
Elf5基因;卵巢癌;肿瘤干细胞;细胞增殖;细胞凋亡
在女性生殖系统恶性肿瘤中,卵巢癌恶性程度最高,病死率居于首位[1]。卵巢癌之所以易转移和复发,根本原因在于肿瘤干细胞[2~4]。我们前期研究筛选出具有肿瘤干细胞特征的卵巢癌干细胞(以人HO8910细胞系为实验对象),经鉴定发现筛选出的细胞具有较强的分化、自我更新能力,并有多药耐药性较高的干细胞相关基因表达水平和体内成瘤特性[5]。Elf5是Ets基因家族成员之一,在肿瘤的发生、发展过程中发挥重要作用[6,7]。Elf5与卵巢癌干细胞的关系目前尚未见报道,为此,2015年1~10月,我们观察了转染Elf5基因的人卵巢癌干细胞增殖、侵袭能力及凋亡的变化,现报告如下。
1 材料与方法
1.1主要实验材料DNA内切酶、DNA连接酶及DNA marker购自Fermentas公司;DNA凝胶回收试剂盒及琼脂糖购自天根生化科技有限公司;中量抽提试剂盒购自杭州爱思进生物技术有限公司;无乙水醇、异丙醇、丙三醇及无水氯化钙购自北京国药集团化学试剂有限公司;人卵巢癌干细胞由本课题组保存;四甲基偶氮唑蓝(MTT)购自美国Sigma公司; Liptapfector脂质体转染试剂购自碧云天生物技术有限公司;Elf5一抗及Transwell 小室购自美国Chemicon公司;大肠杆菌DH5α为本实验室保存。
1.2pcDNA3.1- Elf5+EGFP载体的构建及鉴定目的基因上下游引物分别加BamHⅠ、EcoRⅠ及保护碱基,由上海吉玛制药技术有限公司合成引物,将oligo溶解成50 μmol/L,进行两轮PCR反应,利用Agarose电泳并切胶回收Elf5+EGFP基因片段。用BamHⅠ和EcoRⅠ分别对Elf5+EGFP基因片段和载体pcDNA3.1进行酶切,用DNA凝胶回收试剂盒回收。用T4DNA ligase连接双酶切,得到Elf5+EGFP基因片段和线性化载体。氯化钙法制备感受态细胞,将连接产物转化感受态细胞,从平板上鉴定并挑选阳性克隆菌落,置于含LB培养基的试管中培养。抽提菌液质粒进行双酶切鉴定并测序。测序结果与目的基因序列比对无误后,将菌液接种于LB培养基,进行质粒抽提,获得足够的重组质粒。
1.3细胞分组与Elf5基因转染人卵巢癌干细胞用含EGF、bFGF、Noggi、LIF的培养基培养,分为重组质粒组、空质粒组、空白对照组。重组质粒组转染pcDNA3.1- Elf5+EGFP真核表达载体,空质粒组转染pcDNA3.1-EGFP空载质粒,空白对照组不进行转染。转染结束后,用G418培养基对已转染细胞进行筛选并传代培养。Western blotting法检测Elf5蛋白。
1.4细胞增殖能力观察将三组细胞按1.5×104/孔分别接种于96孔培养板,分别于转染后1、2、3、4、5、6 d后加入MTT工作液,继续培养,最后加入二甲基亚砜终止反应。将96孔培养板置于BOIBASE2000全自动酶标仪上,在490 nm波长处测定吸光度值(A值),代表细胞增殖能力。
1.5细胞侵袭能力观察转染24 h后采用侵袭小室检测卵巢癌干细胞的体外侵袭能力。分离并提取各组细胞悬液,以105/孔将细胞接种于侵袭膜上并培养。培养12 h后去除膜上基质胶及残留细胞,固定并进行染色,倒置显微镜下观察并计算穿膜细胞数,反映细胞侵袭能力。
1.6不同周期细胞检测转染24 h后胰酶消化、洗涤并离心细胞,固定细胞,加100 μL PBS并吹打细胞,制成单细胞悬液,调整细胞浓度,用流式细胞仪分析不同周期细胞分布情况。
1.7凋亡细胞检测转染24 h后胰酶消化、洗涤并离心细胞,固定细胞,加100 μL PBS并吹打细胞,制成单细胞悬液,按annexin V-PI细胞凋亡双染试剂盒说明书进行染色,采用流式细胞术测算细胞凋亡率。
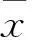
2 结果
2.1pcDNA3.1- Elf5+EGFP载体构建及转染情况酶切结果显示,在1 518 bp位置出现明显条带,与预计扩增片段大小相符,对照组未扩增出条带;DNA序列分析结果显示,目的基因序列与GenBank中基因序列完全相同,目的基因插入方向正确,证实重组质粒pcDNA3.1- Elf5+EGFP构建成功。重组质粒组转染质粒后,细胞中Elf5蛋白表达上调,而空质粒组及空白对照组未检测到Elf5蛋白表达。
2.2各组细胞增殖能力比较转染后1、2、3、4、5、6 d重组质粒组A值低于空白对照组和空质粒组(P均<0.05)。见表1。
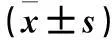
表1 各组转染后不同时间A值比较
注:与重组质粒组相比,*P<0.05。
2.3各组细胞侵袭能力比较重组质粒组、空质粒组、空白对照组穿膜细胞数分别为(92.1±2.7)、(149.6±4.6)、(147.4±5.3)个,重组质粒组与空质粒组、空白对照组相比,P均<0.05。
2.4各组不同周期细胞分布比较重组质粒组G0/G1期细胞百分比高于空质粒组、空白对照组(P均<0.05)。见表2。

表2 各组不同周期细胞分布比较±s)
注:与重组质粒组相比,*P<0.05。
2.5各组细胞凋亡率比较重组质粒组、空质粒组、空白对照组细胞凋亡率分别为31.4%±1.9%、9.1%±2.2%、8.7%±1.5%,重组质粒组与空质粒组、空白对照组相比,P均<0.05。
3 讨论
目前研究[8,9]表明,卵巢癌发生侵袭、转移及复发与卵巢癌干细胞的无限增殖、自我更新和多向分化能力有密切关系。Ets家族成员在正常细胞的增殖、生长、凋亡过程中发挥重要作用[10]。Elf5属于其成员之一,位于人类染色体11q13~15,此区域与其他脆性位点一样,易出现杂合性缺失。Elf5的完整结构域包含参与蛋白间相互作用的结构域、与苏氨酸/半胱氨酸核心序列结合的基序及两个共性结构域[6]。Elf5基因在胎盘滋养细胞、上皮外分泌腺和人类乳腺等器官中均有表达,但表达程度各不相同[11~15]。正常情况下,Elf5不仅可调节腺泡细胞的产生,还可影响胚胎发育[16]。有学者[17]研究表明,Elf5基因的杂合性缺失可导致乳腺成体干细胞增加,促进乳腺癌发病。近年来国外众多学者[18~20]也认为Elf5是乳腺癌发生发展过程中的潜在抑癌基因,有望成为乳腺癌新的治疗靶点。关于Elf5基因对人卵巢癌干细胞生物学行为的影响,目前报道较少。
本研究首先成功构建了重组质粒pcDNA3.1- Elf5+EGFP,并将其成功转染人卵巢癌干细胞,然后从多方面研究了Elf5在体外的一系列生物学作用。我们发现,重组质粒组细胞增殖能力低于空质粒组及空白对照组,表明Elf5基因对卵巢癌干细胞增殖具有明显抑制及延缓作用。重组质粒组G0/G1期细胞百分比高于空质粒组、空白对照组,提示Elf5基因可抑制G0/G1期进展到S期、G2/M期,进一步推测Elf5基因对卵巢癌干细胞的增殖抑制作用可能与干扰细胞周期有关。侵袭小室实验结果显示,重组质粒组的穿膜细胞数少于空质粒组及空白对照组,表明Elf5基因可限制卵巢癌干细胞的侵袭及运动能力。本研究结果还显示,重组质粒组细胞凋亡率高于其余两组,提示Elf5基因不仅能抑制卵巢癌干细胞增殖,还可促进其凋亡。但对于Elf5基因通过何种机制影响卵巢癌干细胞的生物学行为,目前尚处于初级研究阶段。在以后的研究中,我们还将进一步探索Elf5基因的具体作用机制。
[1] Vargas-Hernández VM,Moreno-Eutimio MA,Acosta-Altamirano G,et al.Management of recurrent epithelial ovarian cancer[J].Gland Surg,2014,3(3):198-202.
[2] Zhang S,Chan M,Balch C,et al.Identification and characterization of cancer stem-like cells from human ovarian carcinomas[J].Biomass Bioenergy,2003,25(6):623-636.
[3] Bapat SA.Human ovarian cancer stem cells[J].Reprod,2010,140(1):33-41.
[4] Djordjevic B,Stojanovic S,Conic I,et al.Current approach to epithelial ovarian cancer based on the concept of cancer stem cells[J].J BUON,2012,17(4):627-636.
[5] Yan HC,Fang LS,Xu J,et al.The identification of the biological characteristics of human ovarian cancer stem cells[J].Eur Rev Med Pharmacol Sci,2014,18(22):3497-3503.
[6] Zhou J,Ng AY,Tymms MJ,et al.A novel transcription factor,ELF5,belongs to the ELF subfamily of ETS genes and maps to human chromosome 11p13-15,a region subject to LOH and rearrangement in human carcinoma cell lines[J].Oncogene,1998,17(21):2719-2732.
[7] Choi Y,Sinha S.Determination of the consensus DNA-binding sequence and a transcriptional activation domain for ESE-2[J].Biochem J,2006,398(3):497-507.
[8] Hu L,McArthur C,Jaffe RB.Ovarian cancer stem-like side-population cells are tumourigenic and chemoresistant[J].Br J Cancer,2010,102(8):1276-1283.
[9] Shah MM,Landen CN.Ovarian cancer stem cells: are they real and why are they important[J].Gynecol Oncol,2014,132(2):483-489.
[10] Lee HJ,Ormandy CJ.Elf5,hormones and cell fate[J].Trends Endocrinol Metab,2012,23(6):292-298.
[11] Lapinskas EJ,Palmer J,Ricardo S,et al.A major site of expression of the ets transcription factor Elf5 is epithelia of exocrine glands[J].Histochem Cell Biol,2004,122(6):521-526.
[12] Myriam H,Ramya U,Paul T,et al.ELF5-enforced transcriptional networks define an epigenetically regulated trophoblast stem cell compartment in the human placenta[J].Hum Mol Genet,2010,19(12):2456-2467.
[13] Lee HJ,David GO,Anita L,et al.Progesterone drives mammary secretory differentiation via RankL-mediated induction of Elf5 in luminal progenitor cells[J].Development,2013,140(7):1397-1401.
[14] Lapinskas EJ,Svobodova S,Davis ID,et al.The Ets Transcription Factor ELF5 Functions as a Tumor Suppressor in the Kidney[J].Twin Res Hum Genet,2011,14(4):316-322.
[15] Pearton DJ,Smith CS,Redgate E,et al.Elf5 counteracts precocious trophoblast differentiation by maintaining Sox2 and 3 and inhibiting Hand1 expression[J].Dev Biol,2014,392(2):344-357.
[16] Lee HJ,Hinshelwood RA,Bouras T,et al.Lineage specific methylation of the elf5 promoter in mammary epithelial cells[J].Stem Cells,2011,29(10):1611-1619.
[17] Rumela C,Wei Y,Rose-Anne R,et al.Elf5 regulates mammary gland stem/progenitor cell fate by influencing notch signaling[J].Stem Cells,2012,30(7):1496-1508.
[18] Rumela C,Julie H,Mario AB,et al.Elf5 inhibits the epithelial-mesenchymal transition in mammary gland development and breast cancer metastasis by transcriptionally repressing Snail2[J].Nat Cell Biol,2012,14(11):1212-1222.
[19] Kalyuga M,Gallegoortega D,Lee HJ,et al.ELF5 suppresses estrogen sensitivity and underpins the acquisition of antiestrogen resistance in luminal breast cancer[J].PLoS Biol,2012,10(12):252-253.
[20] Frend HT,Watson CJ.Elf5 - breast cancer's little helper[J].Breast Cancer Res,2013,15(2):307-307.
闫洪超(E-mail:1015058194@qq.com)
10.3969/j.issn.1002-266X.2016.19.008
R737.31
A
1002-266X(2016)19-0025-03
2015-12-04)
