脂质体转染法与电转染法在丙型肝炎病毒RNA转染人肝癌细胞中的应用效果比较
2016-08-31卢莎谭文杰张玲邓瑶陶格斯蔡敏李恋沈晓玲
卢莎,谭文杰,张玲,邓瑶,陶格斯,蔡敏,李恋,沈晓玲
(1内蒙古医科大学,呼和浩特010110;2中国疾病预防控制中心病毒病预防控制所)
脂质体转染法与电转染法在丙型肝炎病毒RNA转染人肝癌细胞中的应用效果比较
卢莎1,2,谭文杰2,张玲2,邓瑶2,陶格斯1,2,蔡敏1,李恋1,沈晓玲1
(1内蒙古医科大学,呼和浩特010110;2中国疾病预防控制中心病毒病预防控制所)
目的比较脂质体转染法与电转染法在丙型肝炎病毒(HCV)RNA转染人肝癌细胞中的应用效果。方法培养人肝癌细胞Huh7.5-CD81并分为A、B组及对照组。A组采用电转染质粒pHebei(E1E2)/JFH1来源的HCV RNA;B组采用脂质体转染质粒pHebei(E1E2)/JFH1来源的HCV RNA;对照组采用脂质体转染复制缺陷质粒pJFH1/GND转录获得的HCV RNA。光学显微镜下观察各组转染后细胞形态,采用免疫荧光法(IFA)检测三组转染效率,real-time PCR法检测三组细胞培养液上清中的HCV RNA,采用TCID50法检测A、B组细胞培养液上清中的丙型肝炎病毒(HCVcc)感染滴度。结果A组转染使用细胞数为1×106,转染后第2天细胞损伤过半,边缘毛糙;B组转染使用细胞数为2×105,转染后第2天细胞基本无损伤。A组转染效率为9.98%±0.83%,B组转染效率为2.58%±0.39%,两组转染效率相比,P<0.01;对照组未检出荧光阳性细胞。A、B组转染后细胞培养液上清中HCV RNA拷贝数均呈现先下降后升高的趋势,最终稳定于106copies/mL。A组转染后21 d、B组转染后31 d方能检测到HCV感染滴度,A、B组收获HCV最高感染滴度均为104ffu/mL。结论脂质体转染和电转染两种方法均可建立嵌合HCV的人肝癌细胞培养体系,脂质体转染法对细胞的损伤较小,电转染法转染效率较高、收获HCVcc的时间较短,但两种方法收获的HCVcc感染滴度无明显差异。
丙型肝炎病毒;电穿孔;脂质体;RNA转染
丙型肝炎病毒(HCV)可引起人类丙型肝炎。最新的靶向HCV蛋白抑制剂疗效较好,但价格昂贵,不良反应较多,因此针对HCV的疫苗及抗病毒药物仍在探索中[1~4]。HCV体外细胞培养系统是重要的研究工具[5~7],其构建策略包括建立全基因或亚基因组HCV感染性克隆、应用电转染或脂质体转染技术将HCV RNA或DNA转移到容纳细胞内。电转染或脂质体转染同属经典方法,各有优势[8~13]。电转染效率高(20%~30%)但对细胞损伤大,脂质体转染效率在10%左右但对细胞损伤小,利于传代培养。我们前期实验构建了含有中国分离株包膜蛋白基因的嵌合HCV全长质粒[14],体外转录获得病毒RNA,同时应用脂质体转染法和电转染法,观察并比较两种方法建立嵌合HCV人肝癌细胞培养体系的效果。
1 材料与方法
1.1质粒、细胞及其他实验材料质粒pHebei(E1E2)/JFH1、复制缺陷质粒pJFH1/GND由本实验室保存(源自Wakita T教授)。人肝癌细胞Huh7.5-CD81为本实验室保存。所有培养液均购自GIBCO公司。MEGAscript T7 Kit、转染试剂DMRIE-C购自Invitrogen公司。鼠抗HCV Core单抗购自ABR公司。FITC标记的羊抗鼠多抗购自中杉金桥生物有限公司。红外荧光标记的羊抗鼠多抗购自Rockland公司。
1.2细胞分组与质粒转染方法将嵌合中国分离株包膜蛋白基因的HCV质粒pHebei(E1E2)/JFH1经体外转录,获得嵌合病毒全长RNA。将Huh7.5-CD81细胞分为A、B组及对照组。A组采用电转染法:25T细胞培养皿接种细胞,用不含抗生素、含10%胎牛血清的DMEM培养;次日,待细胞生长至70%~80%融合成片时,提取5 μg pHebei(E1E2)/JFH1的RNA;转染前用0.25%胰酶消化细胞,预冷的cytomix电转缓冲液清洗细胞2次,500 r/min离心5 min后收集细胞;加入200 μL缓冲液重悬细胞,移至0.4 mm的预冷电转杯中,电转条件为135 V、970 μF;电转结束,将电转杯中的细胞迅速转入准备好的25T细胞培养瓶中,37 ℃、5% CO2培养过夜,次日去除漂浮死细胞,更换新鲜培养基。B组采用脂质体转染法[15]:在6孔板中接种Huh7.5-CD81细胞(1×105/孔),用不含抗生素、含10%胎牛血清的DMEM培养;次日,待细胞生长到70%~80%融合成片时,用脂质体DMRIE-C(Invitroge公司)作转染试剂,依照厂商提供的方法转染5 μg pHebei(E1E2)/JFH1的RNA。对照组经脂质体转染5 μg pJFH1/GND的RNA。
1.3转染后细胞形态观察于光学显微镜下观察细胞形态、边缘、透明度、折光性等特点。
1.4转染效率测算A、B组及对照组分别于转染后3 d或4 d及每次传代后48 h采用免疫荧光法(IFA)检测病毒Core蛋白,在荧光显微镜下观察并计数荧光阳性细胞,计算转染效率。
1.5培养液上清中HCV RNA检测转染后细胞每次传代时收集培养液上清,用TRIzol试剂提取细胞培养液上清中的RNA,采用real-time PCR法检测HCV mRNA。
1.6A、B组细胞培养液上清中HCV感染滴度检测将A、B组细胞以1×103/孔接种于96孔板,第2天对细胞培养液上清(待测病毒液)进行10倍比稀释,最高稀释度定为106,每个稀释度设6个复孔;每孔加入培养液上清100 μL,37 ℃孵育5 h;用PBS清洗细胞3次,然后加入100 μL DMEM完全培养基继续培养;细胞长满后行IFA检测,观察感染病灶(foci),以半数复孔出现foci的最高稀释度计算HCV感染滴度。
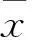
2 结果
2.1HCV RNA转染后细胞状态比较A组转染使用细胞数为1×106,转染后第2天细胞损伤过半,细胞50%融合成片,边缘毛糙;B组转染使用细胞数为2×105,转染后第2天细胞基本无损伤,80%融合成片。详见图1。
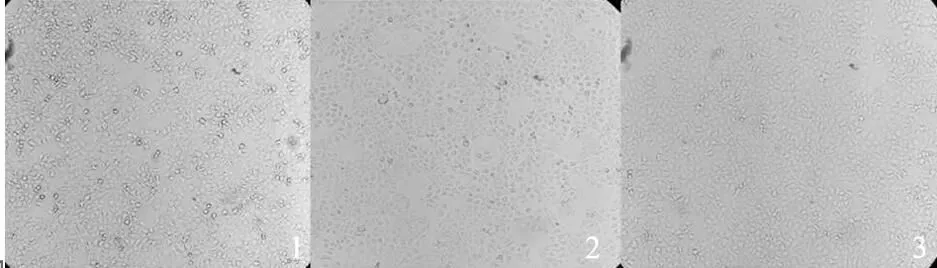
注:1为A组电转染后细胞,2为B组脂质体转染后细胞,3为对照组细胞。
图1HCV RNA转染后细胞形态(100×)
2.2各组转染效率比较A组转染后4 d转染效率为9.98%±0.83%,25 d后荧光阳性细胞百分比为80%~90%;B组转染后3 d转染效率为2.58%±0.39%,36 d后荧光阳性细胞百分比为80%~90%;两组转染效率相比,P<0.01。对照组未检出荧光阳性细胞。
2.3各组细胞培养液上清中HCV RNA水平比较A、B组转染后4 d细胞培养液上清中HCV RNA拷贝数开始降低,于转染后14~19 d降到最低,而后逐渐升高,最终均维持在106copies/mL,A、B组差异无统计学意义;对照组转染6 d后HCV RNA拷贝数降到103以下,10 d后未检出。见图2。
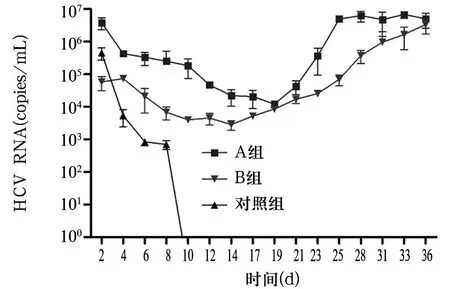
图2 各组转染后不同时间细胞培养液上清中HCV RNA水平比较
2.4A、B组细胞培养液上清中HCV感染滴度比较受检测方法灵敏度影响,A组转染后21 d、B组转染后31 d方能检测到HCV感染滴度。随时间延长,病毒滴度逐渐增高并趋于稳定。A、B组转染后收获最高HCV感染滴度均为104ffu/mL,两组相比,P>0.05。见图3。
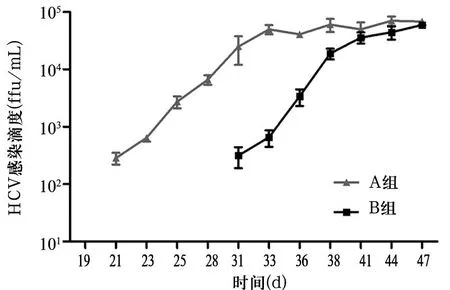
图3 A、B组转染后不同时间细胞培养液上清中HCV感染滴度比较
3 讨论
脂质体转染法的原理是通过转染试剂提供脂质双分子层包裹外源基因形成囊状小泡,继而与细胞膜融合,完成外源基因导入。该法操作简单、细胞毒性小,但转染效率受细胞类型及外源基因性质影响较大。电转染法利用仪器瞬时产生高强度电场从而改变细胞膜完整性和通透性,吸收周围介质中的外源性分子进入细胞内,具有重复性好、安全性高、适用性广的优势,但对细胞损伤较大[16]。与脂质体转染法相比,电转染法因使用瞬间高电压刺激可能使转染后细胞大量死亡。已有研究[17]发现,细胞存活率达50%时的电场参数可获得最佳转染效率。
本研究分别采用脂质体转染和电转染两种方法将嵌合HCV全基因RNA导入Huh7.5-CD81,建立了体外细胞培养模型。本研究结果显示,A组转染效率为9.98%±0.83%,B组转染效率为2.58%±0.39%,A组转染效率高于B组;对照组中HCV不能复制因此没有HCV Core蛋白产生,故未检出荧光阳性细胞。我们对三组细胞培养液上清中的HCV RNA进行检测,发现A、B组HCV RNA拷贝数因本底RNA的影响呈现先下降后升高的趋势,最终稳定在106copies/mL;对照组转染6 d后HCV RNA拷贝数降到本底以下,10 d后未检出。A、B两组最终收获的HCVcc感染滴度相似,均为104ffu/mL,可见,转染效率并非感染滴度的决定因素。
电转染法转染效率高,可使收获HCVcc的时间缩短,但其使用细胞量大,需损失50%甚至更多的细胞方能保证转染效率,且需多次摸索电压、电流、脉冲时间等转染条件,本实验中A组的电转染参数最终确定为135 V、970 μF、10 ms。对贴壁细胞进行电转染操作程序复杂,需多次转移细胞,污染风险增大,转染后细胞损伤明显,不利于后期连续传代培养。而脂质体转染法细胞用量小,转染后细胞损伤小,操作简单,虽然转染效率较低,但对于同一HCV毒株,最终收获的HCVcc感染滴度与电转染法相比并无明显差异。
总之,脂质体转染和电转染两种方法均可建立嵌合HCV的人肝癌细胞培养体系,脂质体转染法对细胞损伤较小,电转染法转染效率较高、收获HCVcc的时间缩短,但两种方法最终得到的HCVcc感染滴度无明显差异。
[1] Bakulin I,Pasechnikov V,Varlamicheva A,et al.NS3 protease inhibitors for treament of chronic hepatitis C:efficancy and safety[J].World J Hapatol,2014,6(5):326-339.
[2] Hayes CN,Chayama K.Emerging treatment of chronic hepatitis C[J].J Formos Med Assoc,2015,114(3):204-215.
[3] Shaheen MA,Idress M.Evidence-based consensus on the diagnosis,prevention and management of hepatitis C virus disease[J].World J Hapatol,2015,385(9973):1124-1135.
[4] Hayashi N,Seto C,Kato M,et al.Once-daily simeprevir (TMC435) with peginterferon/ribavirin for treatment-naive hepatitis C genotype 1-infected patients in Japan:the DRAGON study[J].J Gastroenterol,2014,49(1):138-147.
[5] 张玲,谭文杰.丙型肝炎病毒体外细胞培养的新进展[J].中华微生物学和免疫学杂志,2013,33(6):465-469.
[6] Vieyres G,Pietschmann T.Entry and replication of recombinant hepatitis C viruses in cell culture[J].Methods,2013,59(2):233-248.
[7] Steinmann E,Pietschmann T.Cell culture systems for hepatitis C virus[J].Curr Top Microbiol Immunol,2013,369:17-48.
[8] Lindenbach BD,Evans MJ,Rice CM,et al.Complete replication of hepatitis C virus in cell culture[J].Science,2005,309(5734):623-626.
[9] Lu J,Xiang Y,Tao WY,et al.A novel strategy to develop a robust infectious hepatitis C virus cell culture system directly from a clinical isolate[J].J Virol,2014,88(3):1484-1491.
[10] Galli A,Scheel TK,Prentoe JC,et al.Analysis of hepatitis C Virus core/NS5A protein co-localization using novel cell culture systems expressing core-NS2 and NS5A of genotypes 1-7[J].J Gen Virol,2013,94(10):2221-2235.
[11] Scheel TK,Gottwein JM,Jensen TB,et al.Development of JFH1-based cell culture systems for hepatitis C virus genotype 4a and evidence for cross-genotype neutralization[J].Proc Natl Acad Sci U S A,2008,105(3):997-1002.
[12] Li YP,Ramirez S,Jensen SB,et al.Highly efficient full-length hepatitis C virus genotype 1 (strain TN) infectious culture system[J].Proc Natl Acad Sci U S A,2012,109(48):19757-19762.
[13] Gottwein JM,Scheel TK,Jensen TB,et al.Development and characterization of hepatitis C virus genotype 1-7 cell culture systems:role of CD81 and scavenger receptor class B type I and effect of antiviral drugs[J].Hepatology,2009,49(2):364-377.
[14] 卢莎,张玲,陶格斯,等.嵌合中国分离株包膜蛋白基因的HCV细胞培养模型的传代分析[J].病毒学报,2015,31(6): 647-652.
[15] 卢莎,沈晓玲,管洁,等.嵌合中国分离株基因的丙型肝炎病毒(1b/2a)细胞培养模型的建立[J].生物技术通讯,2009,20(4) :502-505.
[16] Takei H,baba Y,Hisatsune A,et al.Glycyrrhizin inhibits interleukin-8 production and nuclear factor-κB activity in lung epithelial cells,but not through glucocorticoid receptors[J].J Pharmacol Sci,2008,106(3):460-468.
[17] Sandri M,Bortoloso E,Nod A,et al.Electrotransfer in differentiated myotubes:a novel,efficient procedure for functional gene transfer[J].Exp Cell Res,2003,286(1):87-95.
Application effects of electroporation and lipofection in HCV RNA transfecting human hepatoma cells
LU Sha1,TAN Wenjie,ZHANG Ling,DENG Yao,TAO Gesi,CAI Min,LI Lian,SHEN Xiaoling
(1 Inner Mongolia Medical University,Hohhot 010059,China)
ObjectiveTo observe the application effects of electroporation and lipofection in hepatitis C virus (HCV) RNA transfecting human hepatoma cells.MethodsHuman hepatoma cells (Huh7.5-CD81) were cultured and divided into groups A,B and control group.Cells in the group A were transfected with HCV RNA of pHebei (E1E2)/JFH1 by electroporation,cells in the group B were transfected with HCV RNA of pHebei (E1E2)/JFH1 by lipofection,and cells in the control group were transfected with HCV RNA of replicating defective pJFH1/GND.Cell morphology was observed using an optical microscope in each group after transfection.Immunofluorescence was employed to detect the transfectional efficiency.RNA copies in the supernatant were tested by real-time PCR.TCID50 was applied to detect HCV infectious titer.ResultsThe number of cells used in the group A were 1×106,and more than half were damaged with rough edges one day after transfection; the number of cells in the group B were 2×105and almost no damage was found one day after transfection.Transfectional efficiency of group A was 9.98%±0.83%,and that was 2.58%±0.39% in the group B,P<0.01.Fluorescence positive cells in the control group were not detected.Meantime,HCV RNA copy number in the supernatant of groups A and B first decreased,then increased and eventually reached at 106copies/mL.HCV infection titer was detected successfully at 21days after transfection in the group A and at 31days in the group B.The highest infectious titer of groups A and B was both 104ffu/mL.ConclusionsElectroporation and lipofection both can be used to establish HCV cell culture system.Lipofection displays less damage to cells.Although electroporation demonstrates higher transfectional efficiency and short time of obtaining HCVcc,but there is no difference in infectious titer of obtained HCVcc.
hepatitis C virus; electroporation; liposomes; RNA transfection
国家自然科学基金资助项目(81373229);传染病科技重大专项(2013ZX10004601,2013ZX10004609);内蒙古医科大学科技百万项目(NY2011BW003)。
卢莎(1980-),女,硕士,讲师,主要研究方向为医学微生物学。E-mail:huder@sina.com
简介:沈晓玲(1964-),女,教授,主要研究方向为免疫学与分子病毒学。E-mail: shenxl1@aliyun.com
10.3969/j.issn.1002-266X.2016.19.005
R373.9
A
1002-266X(2016)19-0015-04
2015-12-18)
