无偿献血者ELISA灰区标本的追踪检测结果分析
2016-08-30张国平焦作市中心血站河南焦作454000
张国平焦作市中心血站,河南焦作 454000
无偿献血者ELISA灰区标本的追踪检测结果分析
张国平
焦作市中心血站,河南焦作454000
目的对无偿献血者ELISA灰区标本进行追踪检测,探讨灰区的设置原则。方法使用ELISA对39 318名无偿献血者进行HBsAg、抗HCV、抗HIV、抗TP四项传染性指标检测;对既往献过血的175名灰区结果献血者进行追踪检测。结果39 318名无偿献血者中,酶免4项合计反应性标本105例,占献血者总数的0.27%;灰区标本233例,占献血者总数的0.59%。175名灰区献血者追踪检测结果仍为灰区的68例,占38.9%;结果为非反应性的107例,占61.1%;未发现转为反应性的标本。结论4项传染性指标以初检复检两次ELISA进行检测的模式下,为了提高血液安全水平,应设置灰区;核酸检测技术(NAT)应用于献血者传染性指标检测后,可以对ELISA灰区标本进行NAT追踪检测,取得一定的研究数据后,进一步探讨ELISA实验的灰区设置问题。
无偿献血者;ELISA;灰区;追踪检测
[Abstract]Objective To track and test the ELISA grey-area specimens in blood donors without payment and study the setup principles of grey-area.Methods 39318 blood donors without payment were detected by four infectious indicators including HBsAg,anti-HCV,anti-HIV and anti-TP by ELISA,and 175 blood donors with grey-area results were tracked and detected.Results In 39318 blood donors without payment,there were 105 reactive specimens(four items in total by enzyme immunoassay),accounting for 0.27%and 233 grey-area specimens,accounting for 0.59%;tracking test results showed that in the 751 grey-area blood donors,there were still 68 grey-area donors,accounting for 38.9%and 107 non-reactive donors,accounting for 61.1%,and none was converted to reactive specimen.Conclusion In the pattern of four infectious indicators with initial examine and duplicate examine,the gray-area should be set in order to improve the blood safety level;NAT should be applied after the test of infectious indicators of blood donors,the ELISA grey-area specimen can be tracked and tested by NAT,and the grey-area setup problems of ELISA experiment should be further discussed after obtaining a certain research data.
[Key words]Blood donors without payment;ELISA;Grey-area;Tracing test
按照《献血者健康检查要求》[1],血站应对无偿献血者,进行乙肝表面抗原 (HBsAg)、丙型肝炎抗体 (抗HCV)、艾滋病病毒抗体(抗HIV)和梅毒抗体(抗TP)初检复检二次检测。为进一步提高临床用血安全水平,保证用血者身体健康,很多血站检验科在使用酶联免疫吸附试验(ELISA),对上述4项传染性指标进行结果判读时,除了“反应性”和“非反应性”外,还会设置“灰区”[2-4]。为了对灰区的设置原则进行探讨,该站对检测结果为灰区的献血者,进行了追踪检测,现报道如下。
1 资料与方法
1.1一般资料
2015年1—12月,该市无偿献血者39 318名,年龄18~55岁。使用ELISA对所有无偿献血者血液标本进行HBsAg、抗HCV、抗HIV、抗TP四项传染性指标检测;对既往献过血的175名灰区献血者 (其献血时间为2014 年1月—2015年6月),使用ELISA对HBsAg、抗HCV、抗HIV、抗TP4项传染性指标进行追踪检测。
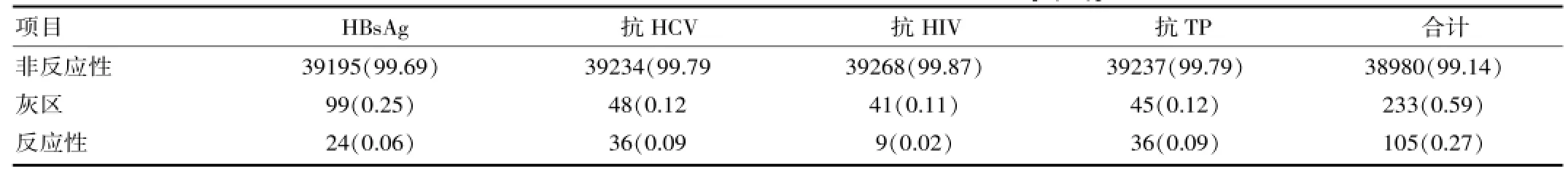
表1 39 318名无偿献血者四项传染性指标检测结果[n(%)]
1.2试剂
HBsAg ELISA试剂盒,抗HCV ELISA试剂盒,抗HIV ELISA试剂盒,抗TP ELISA试剂盒HBsAg、抗HCV、抗HIV、抗TP质控品。所有试剂均由合格供方提供,进货检验合格,有效期内使用。
1.3主要仪器
STAR全自动样本处理系统;FAME全自动酶免分析系统;UranusAE全自动酶免分析仪;SUNRISE扫描酶标仪;Columbus洗板机。
1.4方法
1.4.1ELISA检测流程 每位无偿献血者均留取初检、复检2份标本,应用ELISA法,按照HBsAg、抗HCV、抗HIV、抗TP试剂的说明书要求,进行初检、复检2次检测。
1.4.2结果判读规则反应性,S/C.O≥1;灰区,1>S/C. O≥0.7;非反应性,S/C.O<0.7。
1.4.3灰区标本追踪检测流程 检测结果为灰区的献血者,6个月后,只采集1份标本,对灰区项目追踪检测,使用原检测厂家的试剂双孔复试。2孔检测结果均S/C. O值<0.7为非反应性,解除该献血者屏蔽状态,可以继续献血;2孔检测结果有1孔或2孔S/C.O值≥0.7,报告为“灰区”,该献血者长期屏蔽,暂不能献血;2孔检测结果均S/C.O值≥1.0为反应性,该献血者永久屏蔽,不宜继续献血。
1.5质量控制
检验科使用ELISA法检测时,每板均按照试剂使用说明书要求,设置相应的空白、阴性对照、阳性对照及室内质控,做好室内质控工作;同时每年参加国家卫生计生委临检中心、河南省临检中心组织的室间质量评价活动。
2 结果
2.1无偿献血者4项传染性指标检测结果
使用ELISA法对39 318名无偿献血者进行4项传染性指标检测,HBsAg、抗HCV、抗HIV、抗TP非反应性结果共38980名,占99.14%;反应性结果共105名,占0.27%;灰区结果共233名,占0.59%。39 318名无偿献血者4项传染性指标检测结果见表1。
灰区标本数是反应性标本数的2.22倍,表明灰区占总不合格的比例较高。
2.2灰区结果献血者追踪检测结果
使用ELISA法对175名灰区结果献血者进行追踪检测,HBsAg、抗HCV、抗HIV、抗TP非反应性结果共107名,占61.1%;反应性结果共0名,占0%;灰区结果共68名,占38.9%。175名灰区结果献血者追踪检测情况见表2。
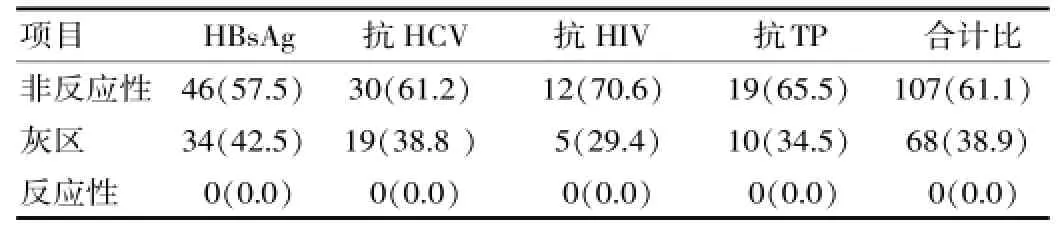
表2 175名灰区结果献血者追踪检测情况[n(%)]
追踪检测结果仍为灰区的标本数是非反应性标本数的0.64倍,未发现转为反应性的标本。
2.3质控结果
室内质控使用Levey-Jennings质控图,采用13 s、22 s和10x质控规则,对每板的质控值进行分析,符合选定的质控规则,则实验结果在控,可以发布检测结果;如果质控值违背质控规则,则应分析原因,必要时重新检测[5-6]。参加国家卫生计生委临检中心和省卫生计生委临检中心室间质评结果均100%符合。
3 讨论
ELISA实验灵敏度高、特异性好、试剂稳定、操作简便快速、无放射性污染,可利用全自动酶免分析仪进行自动化检测,检测通量大,特别适用于大批量无偿献血者血液标本的传染性指标检测,在采供血机构得到了广泛应用[7-8]。但是,多种因素包括献血者体内原因、标本质量、检测试剂、仪器设备、实验环境、人员因素等,可影响ELISA实验结果[9]。在ELISA实验的结果判读过程中,除了反应性和非反应性两种实验结果外,还有部分标本OD值非常接近阳性判定值(cut-off),即“灰区”结果[10]。
使用ELISA对随机选取的大批量已知某项目反应性和非反应性标本进行检测,以OD值为横坐标,以标本数量为纵坐标,可得到一个分布图。其中,非反应性标本中OD值较高的部分,与反应性标本中OD值较低的部分,将会出现重叠现象,即是灰区结果产生的原因[11]。因此,合理科学地设置灰区,能使ELISA实验最大限度地检出阳性标本,防止弱阳性标本的漏检,可有效地保证检测结果的准确性,对ELISA实验有重要的现实意义[12]。
该研究表1数据显示,39 318名无偿献血者中,酶免4项合计反应性标本105例,占献血者总数的0.27%;而灰区标本233例,占献血者总数的0.59%;灰区标本数是反应性标本数的2.22倍,表明灰区占总不合格的比例较高。表2显示,既往献过血的175名灰区献血者,追踪检测结果仍为灰区的68例,占38.9%;结果为非反应性的107例,占61.1%;未发现转为反应性的标本,与谢云峥、张艳梅的报道基本一致[13-14],与张秀慧等的报道有所不同[15],这可能与所选取的研究对象不同、所使用的试剂不同等因素有关。
灰区结果具有不确定性,既可能是真阳性,也可能是真阴性。采供血机构为了保证临床用血安全,任何一项传染性指标检测结果为灰区或反应性的血液,均不会发往临床使用[16]。如果该灰区标本为真阳性,则把住了血液安全关,降低了输血风险;如果该灰区标本为真阴性,其结果也就是假阳性,则浪费了血液资源,造成不必要的血液报废。
4 结语
4项传染性指标以初检复检两次ELISA进行检测的模式下,为了提高血液安全水平,应设置灰区,因其真阳性的概率较大;随着检测技术的快速发展,近年来核酸检测技术(NAT)逐渐应用于献血者传染性指标的检测[17-19],可以对ELISA弱阳性及灰区标本进行NAT检测,取得一定的研究数据后,再探讨ELISA实验的灰区设置问题,这有待于进一步深入研究。
[1]中华人民共和国国家标准.GB18467-2011献血者健康检查要求[S].北京:卫生部,国家标准管理委员会.
[2]刘胡敏,陶传敏,黄锦江,等.ELISA检测丙型肝炎病毒设置灰区的必要性[J].现代预防医学,2013,40(8):1490-1491,1494.
[3]陈显,胡文佳,黄成垠,等.献血者ELISA检测为灰区标本的确证试验与核酸检测情况分析[J].中国输血杂志,2015,28 (2):198-199.
[4]陈霞,黄丽丽,姜标.ELISA法检测HBsAg灰区设置的探讨[J].临床输血与检验,2011,13(1):63-66.
[5]王鸿杰,葛红卫.采供血质量控制技术[M]//王憬惺.输血技术.北京:人民卫生出版社,2013:432-473.
[6]段友斌,寸伟.ELISA实验室内质控失控的回顾性分析[J].临床输血与检验,2014,16(1):72-74.
[7]中华人民共和国国家卫生计生委.血站技术操作规程.国卫医发〔2015〕95号[S].北京:中国人民共和国国家卫生计生委.
[8]蔡丽娜,朱绍汶,周春,等.2010-2013年中国南京地区无偿献血人群HBV、HCV、HIV感染情况分析[J].中国实验血液学杂志,2014,22(4):1089-1093.
[9]谭立明.ELISA法检测的影响因素及其对策[J].实验与检验医学,2013,31(4):300-305.
[10]蔡云玲,刁丽波,洪汾.抗-HIV检测结果分析及灰区设置探讨[J].中国输血杂志,2015,28(9):1142-1143.
[11]李金明.临床酶免疫测定技术[M].北京:人民军医出版社,2006:96-105.
[12]陈善华,朱丽莉,李浩,等.ELISA方法检测HBsAg设置灰区的必要性探讨[J].中国输血杂志,2015,28(9):1142-1143.
[13]谢云峥,杨军,周国平,等.上海地区抗-HCV反应性献血者随访研究[J].临床输血与检验,2013,15(3):212-216.
[14]张艳梅,王新梅,郭喜彪,等.献血者抗HCV ELISA检测有反应性与确证实验的比较[J].临床血液学杂志,2015,28(6):483-485.
[15]张秀慧,余加宏,钟政荣,等.ELISA法检测HBsAg灰区和单试剂反应性样本的确认结果分析[J].临床输血与检验,2015,17(3):224-226.
[16]陈洪生,陈佳微,张三明,等.ELISA“灰区”范围的设定对献血者血液检测安全和血源保护的意义[J].中国输血杂志,2015,28(9):1140-1141.
[17]白艳菊.核酸检测技术在无偿献血者血液筛查中的应用[J].中国现代药物应用,2013,7(15):249-250.
[18]李莉华,韩卫,何路军,等.国产核酸检测试剂在不同检测系统中的应用[J].临床血液学杂志,2015,28(12):643-646.
[19]赵红娜,王艺芳,葛文超,等.郑州地区无偿献血者中核酸检测的初步应用[J].中国输血杂志,2014,27(9):923-926)
Analysis of Tracking Test Results of ELISA Grey-area Specimen in Blood Donors without Payment
ZHANG Guo-ping
The Blood Center of Jiaozuo City,Jiaozuo,Henan Province,454000 China
R446.6
A
1672-5654(2016)04(c)-0096-03
10.16659/j.cnki.1672-5654.2016.12.096
2016-01-22
