人类免疫缺陷病毒抗体检测“灰区”设置的探讨*
2015-03-16冯晓丹叶莉莉高玲娟顾平清江苏省南京市妇幼保健院检验科210004
冯晓丹,叶莉莉,高玲娟,顾平清(江苏省南京市妇幼保健院检验科 210004)
·论 著·
人类免疫缺陷病毒抗体检测“灰区”设置的探讨*
冯晓丹,叶莉莉,高玲娟,顾平清
(江苏省南京市妇幼保健院检验科 210004)
目的 通过酶联免疫吸附试验(ELISA)检测人类免疫缺陷病毒(HIV)抗体,旨在设置科学、合理的HIV抗体检测的“灰区”范围,减少HIV抗体阳性的漏检率。方法 采用ELISA对吸光度值/临界值(S/CO)介于大于0.8~<1.2的30例临界值患者血清进行HIV抗体检测,以此S/CO值,设置“灰区”范围;对于S/CO介于灰区的标本进行免疫印迹确证。结果 设置灰区参考范围为0.796~1.204;共有46例处于“灰区”的血清标本,经免疫印迹确证为阳性3例,不确定1例。结论ELISA检测HIV抗体应设置合理的“灰区”范围,对灰区的标本进行确证,对减少HIV抗体阳性漏检具有重要的临床意义。
HIV抗体; 灰区; 酶联免疫吸附试验
获得性免疫缺陷综合征(AIDS)是由人类免疫缺陷病毒(HIV)引发的一种免疫缺陷性疾病[1]。到2010年,我国HIV感染者已达1 000万,严重威胁着人类健康[2]。为了有效控制艾滋病的传播,WHO和我国卫生部将酶联免疫吸附试验(ELISA)首推为HIV抗体筛查方法[3-4]。在ELISA检测HIV抗体过程中,对Cut-off值的设定尤为重要,而接近Cut-off值的结果往往难以判断,研究者将其定义为“灰区”[5]。本研究旨在根据本实验室实际情况,科学、合理地设置HIV抗体检测的“灰区”范围,最大限度地检出可疑标本,防止HIV抗体弱阳性标本的漏检。
1 资料与方法
1.1 一般资料 收集2008年1月至2014年12月南京市妇幼保健院门诊患者28 760份血液标本,无溶血、脂血、黄疸等,收集后-20 ℃保存。
1.2 仪器与试剂 HAMILTON全自动酶免分析仪(瑞士Hamilton Bonaduz AG)。HIV(1+2型)ELISA试剂盒由北京万泰药业股份有限公司提供(国药准字S20000024),批号分别为I201102038034、I201101028021、I201105088083;HIV(1+2型)ELISA试剂盒由英科新创(厦门)科技公司提供(国药准字S20000039),批号分别为2011086615、2011126622、2011116618、2011076613。
1.3 方法 ELISA严格按照试剂盒说明书流程以及初筛试验流程进行操作。根据说明书判定北京万泰HIV诊断试剂的Cut-off值为0.124,英科新创HIV诊断试剂的Cut-off值为0.105。将原始吸光度值/临界值(S/CO),根据回归方程计算S/CO的平均值为1时(临界值血清)的CV值。灰区的上限和下限计算公式分别为:灰区上限(S/CO值)=1+2CV,灰区下限(S/CO值)=1-2CV[6]。
2 结 果
2.1 HIV抗体试验“灰区”的参考范围 将处于0.8
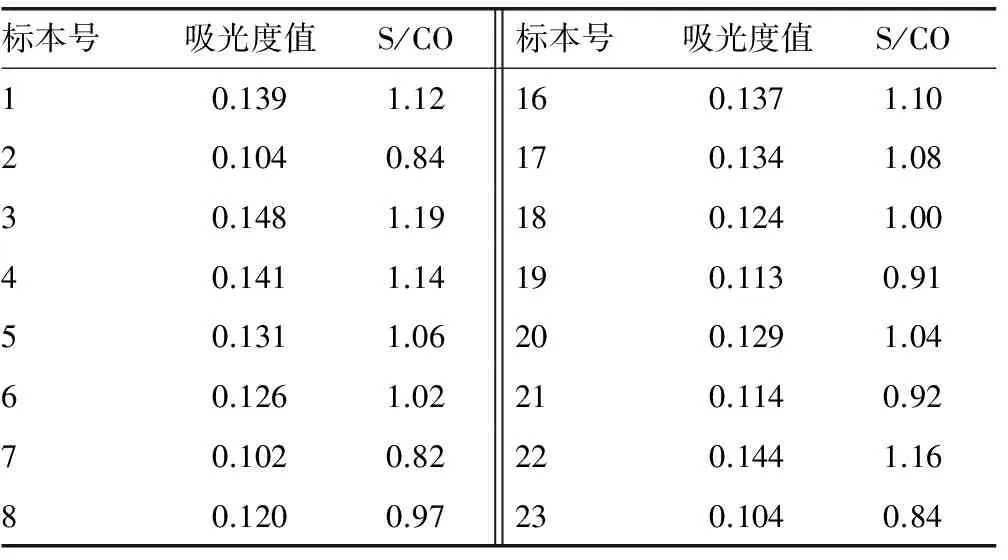
表1 HIV体抗体临界值血清所测吸光度、S/CO值
2.2 灰区标本确证结果 28 760份血清标本经免疫印迹确证为阳性的共计8例(表2仅示例阳性结果3例,其余5例阳性结果未处于灰区),经ELISA试剂初筛S/CO值在0.796~1.204的血清共计46例(表2仅示例23例结果),将其确定为灰区标本。经免疫印迹确证为阳性的3例,占比例为6.52%(3/46);不确定1例,占比例为2.17%(1/46)。减少HIV抗体漏检率为25%(2/8),假阳性比例为86.9%(20/23),见表2。
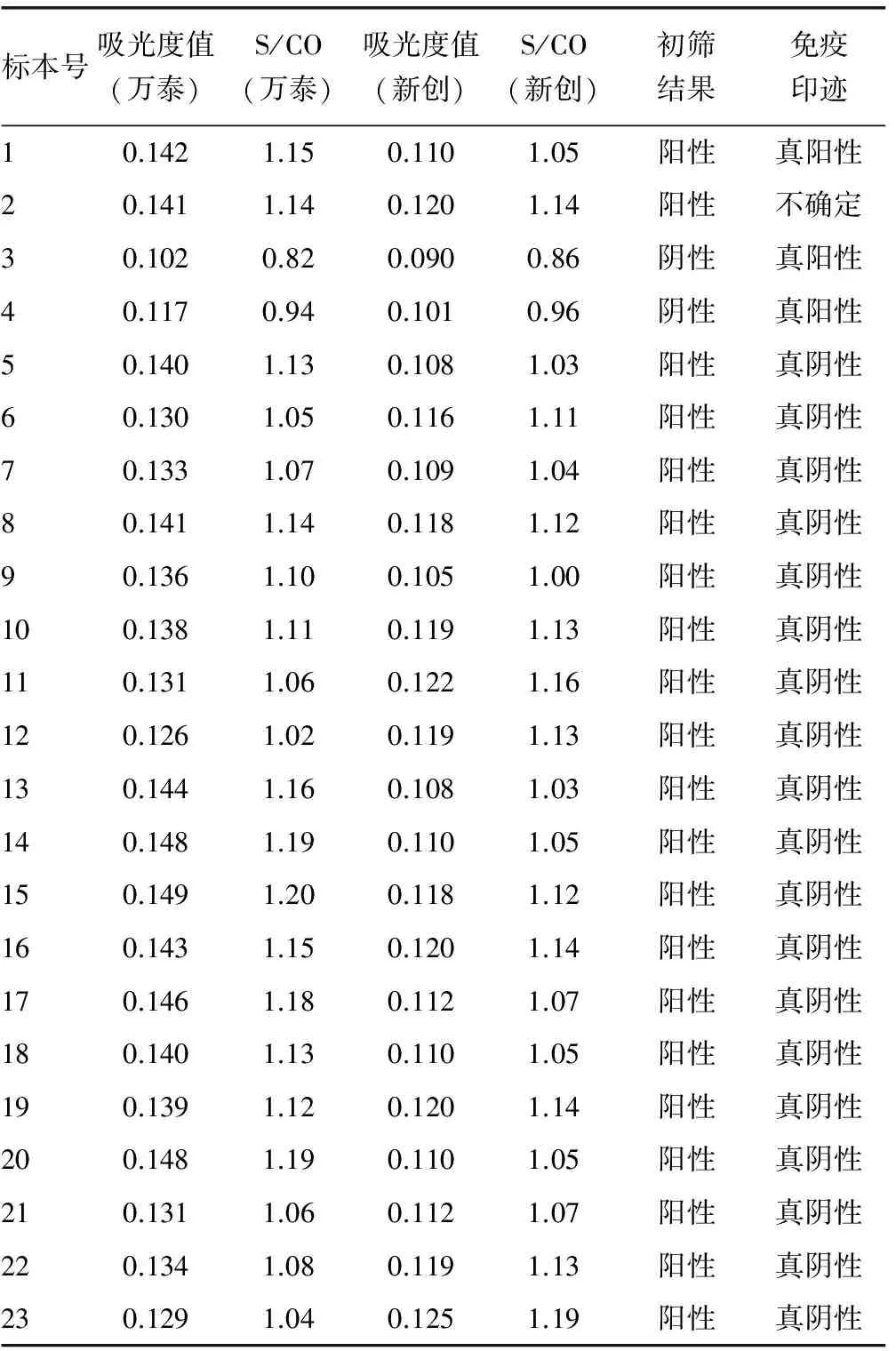
表2 “灰区”标本经确证的阳性结果
3 讨 论
临床实验室针对HIV抗体测定时,ELISA均需要设置一段“灰区”范围[7],然而目前,国内定性试剂生产厂家并未对其“灰区”范围进行科学、合理地设定,而且各实验室对于“灰区”设定的观点众说不一。在实际的HIV抗体检测时,设置合适的“灰区”范围能最大限度地减少阳性漏检的问题,“灰区”范围的确定使得测定结果假阳性与假阴性发生率降低[8]。在本研究中,作者探讨了“灰区”范围的合适范围,将处于0.8
根据本试验室设置的“灰区”范围,进一步将S/CO值处于“灰区”的血清共计46例进行免疫印迹确证,结果显示阳性3例,占比例为6.52%(3/46),不确定1例,占比例为2.17%(1/46)。原因分析:(1)国内HIV抗体筛查试剂盒,多采用ELISA双抗体(抗原)夹心法,但ELISA诊断试剂的局限性使得不能及时捕捉HIV抗体检测的窗口期[9],针对这些标本的检测,其结果可能为阴性或处在灰区,但具有传染性,如表2中的标本2。(2)部分患者标本,经多次检测,HIV抗体的S/CO值始终处在“灰区”范围,此为真抗体弱阳性,其原因可能为基因片段的突变导致试剂盒检测吸光度值降低[10],如表2中的标本1、3、4。且本研究揭示,针对灰区的标本进行进一步确证,HIV抗体漏检率为25%(2/8),假阳性比例为86.9%(20/23)。基于此,合理、科学地设置灰区范围,能使ELISA最大限度地检出阳性标本,防止弱阳性标本的漏检,可有效保证检测结果的准确性。
[1]Patel SM,Johnson S,Belkllap SM,et al.Serious adverse cutaneous and hepatic toxicities associated with nevirapine use by non-HIV-infected individuals[J].J Acquir Immune Defic Syndr,2004,35(2):120-125.
[2]Chinese Medical Association,Chinese Center for Disease Control and Prevention.Guidelines for diagnosis and treatment of HIV/AIDS in China(2005)[J].Chin Med J(Engl),2006,119(19):1589-1608.
[3]杨春晖,张容,郑鹏,等.影响抗HIV弱阳性质控血清稳定性的几种因素探讨[J].中国输血杂志,2008,21(6):441-443.
[4]李金明.临床酶免疫测定技术[M].北京:人民军医出版社,2005:95.
[5]周艳萍,倪诗强,黄勇进.酶联免疫吸附试验“灰区”结果探讨[J].检验医学与临床,2008,5(14):876-877.
[6]伍伟健,郭如华.ELISA试验灰区设置方法的探讨[J].中国生物制品学杂志,1998,21(10):911-912.
[7]Parkin JM,Murphy M,Anderson J,et al.Tolerability and side-effects of post-exposure prophylaxis for HIV infection[J].Lancet,2000,355(9205):722-723.
[8]庞栋.血站实验室质控物的制备和应用[J].医学文选,2001,12(3):351-352.
[9]Parienti JJ,Massari V,Descamps D,et al.Predictors of virologic failure and resistance in HIV-infected patients treated with nevirapine-or efavirenz-based antiretroviral therapy[J].Clin Infect Dis,2004,38(9):1311-1316.
[10]Tourret J,Deray G,Isnard-Bagnis C.Tenofovir effect on the kidneys of HIV:infected patients:a double-edged sword?[J].J Am Soc Nephrol,2013,24(10):1519-1527.
Study on gray area setting in HIV antibody detection*
FENGXiao-dan,YELi-li,GAOLing-juan,GUPing-qing
(DepartmentofClinicalLaboratory,NanjingMaternityandChildHealthCareHospital,Nanjing,Jiangsu210004,China)
Objective To set the scientific and rational gray area range of HIV antibody detection by ELISA for reducing the missed detection rate of HIV antibody detection.Methods Thirty serum specimens with the critical value range of 0.8
HIV antibody; gray area; enzyme-linked immunosorbent assay
江苏省南京市科技发展计划资助项目(201308041)。
冯晓丹,女,主管检验医师,硕士,主要从事医学检验相关工作。
10.3969/j.issn.1672-9455.2015.22.015
A
1672-9455(2015)22-3332-02
2015-06-11
2015-09-11)
