高载量标本HBV-DNA定量检测时稀释液的选择与评价
2016-08-19汪东剑余维涛张晓云刘冬萍邱华琴彭慧琼
汪东剑 余维涛 张晓云 刘冬萍 邱华琴 彭慧琼
335000鹰潭,中国人民解放军第一八四医院输血科
高载量标本HBV-DNA定量检测时稀释液的选择与评价
汪东剑 余维涛 张晓云 刘冬萍 邱华琴 彭慧琼
335000鹰潭,中国人民解放军第一八四医院输血科
目的 对高载量标本HBV-DNA稀释检测时稀释液进行选择和评价,期望筛选出较为理想适用于临床的稀释液。方法 以阴性质控品作为标准稀释液,阴性血清、生理盐水、蒸馏水作为候选稀释液,分别对定值标准品(浓度为2.00×109IU/m1)进行10倍、100倍的稀释检测,比较使用候选稀释液与标准稀释液的检测结果,同时进行偏差分析。结果 在10倍稀释时,使用蒸馏水稀释与标准稀释液稀释,其检测结果间差异无统计学意义(t=2.04,P>0.05),偏差小于行业标准规定的总允许误差;使用阴性血清、蒸馏水时检测结果高于标准稀释(P<0.05),分别有16.67%和20.00%的偏差超过行业标准规定的总允许误差。在100倍稀释时,使用待选稀释液,其检测结果均高于使用标准稀释液时,差异有统计学意义(P<0.05),且以蒸馏水作为稀释液时的检测结果与以标准稀释液稀释时的检测结果呈良好的线性关系,其公式为Y=0.963X+0.267;使用不同稀释液时偏差均小于行业标准规定的总允许误差,以标准稀释液偏差最小,其次为蒸馏水、生理盐水、阴性血清(P<0.05)。结论 在10倍稀释时,最适稀释液为阴性质控品与蒸馏水;在100倍稀释时,最适稀释液为阴性质控品,其次为蒸馏水、生理盐水、阴性血清,以蒸馏水作为稀释液时,可通过公式Y=0.963X+0.267对检测结果进行校正,确保结果更为精确。
【主题词】 稀释液;乙型肝炎病毒;DNA;检测
Fund program:Nanjing Mi1itary Region Medica1 Scientific Research Fund Project(MS078)
HBV-DNA定量检测已广被泛运用于临床及科研[1-2],随着研究的深入,高病毒载量患者的诊断、治疗日益受到重视[3-7]。当前国内多数厂家HBVDNA定量检测试剂盒的线性范围在1.00×102~5.00×108IU/m1之间,然而有报道显示国产试剂对于病毒载量高于107IU/m1的标本,其检测结果在准确性方面不如进口试剂,建议进行稀释检测[8]。同时对于超过线性范围的标本,为精确定量,厂家也建议采用阴性质控品对待检标本进行稀释,然后以测定结果乘以稀释倍数作为最终报告结果。稀释检测是临床检验中常用的方法,报道显示稀释检测后常需进行校正才能得出与实际值相符的结果,而稀释液的选择也直接影响检测结果的准确性[9-11],但目前尚无高载量标本HBV-DNA检测时稀释液的选择与评价的相关报道。研究前期运用在乳汁中掺入高HBV-DNA载量血清建立乳汁HBV-DNA模型时,曾用生理盐水作为稀释液,以期制备梯度定值标准品,结果发现稀释检测结果高于预期理论结果[12],提示稀释液选择不当会对HBV-DNA检测造成影响。为此我们以试剂盒提供的阴性质控品为标准稀释液,以三种常用于临床的阴性血清、生理盐水、蒸馏水为候选稀释液,通过对定值高载量HBV-DNA标准品进行稀释检测,以期发现HBV-DNA稀释检测中的规律,为工作中稀释液的选择和应用提供依据。
1 材料与方法
1.1材料
1.1.1定值标准品:由中山大学达安基因股份有限公司提供(灭活的HBV阳性血清),浓度为2.00× 109IU/m1。
1.1.2稀释液:标准稀释液的阴性质控品,由中山大学达安基因有限公司提供。候选稀释液:①自制阴性血清,收集2014年1月至9月经HBV血清标志物及HBV-DNA检测均为阴性的无溶血、黄疸、脂血血清50份,充分混匀紫外线照射2 h无害化处理后-20℃保存备用;②生理盐水,晨欣药业股份有限公司生产;③无菌蒸馏水,四川科伦药业股份有限公司生产。
1.2检测方法
1.2.1样品稀释:将标准血清分成30份,每份分别使用阴性质控品、自制阴性血清、生理盐水、蒸馏水稀释10倍及100倍制备成对应的稀释样品待检。
1.2.2稀释检测:严格按照试剂盒说明书提供的操作步骤对稀释样品进行HBV-DNA定量检测;对标准稀释样品同时使用两个厂家提供的试剂进行平行检测。
1.3主要仪器和试剂 HBV-DNA核酸定量检测使用中山大学达安基因股份有限公司生产的DA-7600核酸扩增仪;稀释检测试剂使用中山大学达安基因股份有限公司生产的HBV-DNA核酸定量检测试剂盒;平行检测试剂分别使用中山大学达安基因股份有限公司与上海科华生物工程股份有限公司生产的HBV-DNA核酸定量检测试剂盒。
1.4统计学方法 所有检测结果QDNA均进行对数转化为LGQ,采用SPSS18.0软件进行分析,计量资料以均数±标准差(±s)表示,组间差异比较采用t检验,P<0.05为差异具有统计学意义。偏差分析以《CNAS-CL36医学实验室质量和能力认可准则在分子诊断领域的应用说明》规定的(靶值±0.4对数值)为允许总误差(TEa),当偏差小于此 TEa时可接受,否则不可接受。
2 结果
2.1稀释检测结果 各稀释检测结果见表1。在10倍稀释时,稀释理论结果为8.30,标准稀释、阴性血清稀释、生理盐水稀释、蒸馏水稀释检测结果分别为8.37±0.12、8.58±0.10、8.53±0.14、8.38± 0.09,使用试剂2检测结果分别为:阴性血清稀释、生理盐水稀释检测结果均高于标准血清稀释检测(P<0.05),蒸馏水稀释检测结果与标准稀释检测结果基本一致,t=2.04,P>0.05,差异无统计学意义。在100倍稀释时,稀释理论结果为7.30,标准稀释、阴性血清稀释、生理盐水稀释、蒸馏水稀释检测结果分别为7.34±0.09、7.49±0.10、7.44± 0.08、7.35±0.09,候选稀释液稀释检测结果均高于标准稀释检测结果(P<0.05)。
2.2候选稀释液与标准稀释液稀释检测结果的曲线拟合 我们以标准稀释检测结果为Y值,候选稀释检测结果为X值分别在10倍稀释、100倍稀释时进行曲线拟合,拟合方程均为线性(Y=aX+b),以
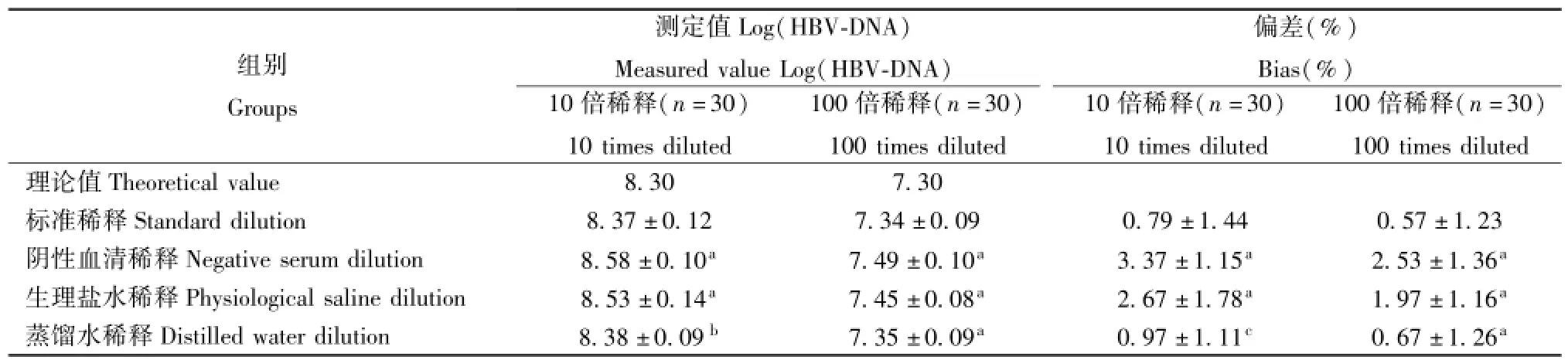
表1 不同稀释度检测Tab.1 Detection of different di1utions
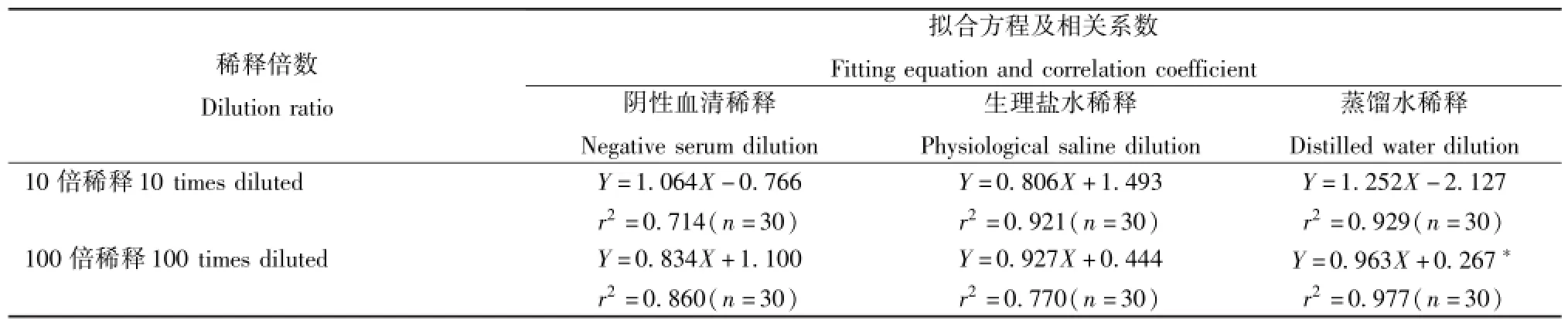
表2 曲线拟合参数Tab.2 Parameters of curve fitting
a介于1.00±0.05和r2≥0.95作为是否符合线性关系的判断标准,具体参数见表2。结果显示仅在100倍稀释时,蒸馏水稀释检测与标准稀释检测呈良好线性关系(曲线拟合见图1)。

图1 蒸馏水稀释检测与标准稀释检测结果的曲线拟合Fig.1 The curve fitting of disti11ed water di1uted detection and standard di1uted detection
2.3偏差分析 各稀释检测结果与理论结果间的偏差分析结果见表 1。在10倍稀释时,靶值为8.30,允许总误差为 ±0.40(对应偏差为± 4.82%),当选用标准稀释液和蒸馏水作为稀释液时,偏差均小于TEa;选用阴性血清、生理盐水作为稀释液时,分别有 5例(占 16.67%)、6例(20.00%)偏差大于TEa。在100倍稀释检测时,靶值为7.30,允许总误差为 ±0.40(对应偏差为 ± 5.48%),所有稀释检测偏差均小于TEa,标准稀释偏差最小,其次为蒸馏水稀释、生理盐水稀释、阴性血清稀释。
2.4平行评估 使用厂家2提供的检测试剂对使用厂家1阴性质控品稀释的样品进行平行检测,与使用厂家1提供检测试剂的检测结果比较见表3。
3 讨论
HBV-DNA载量升高被公认为反映HBV复制最敏感的检测指标,研究显示血清HBV-DNA载量不仅与肝脏损害相关,而且是临床药物的选择的重要依据[13-14]。在临床工作中,常出现高载量的HBVDNA标本,这类标本往往接近或者超过检测试剂盒的线性范围如何精确定量高载量患者HBV-DNA水平在指导临床用药及预后判断方面具有重要意义。厂家对于超过线性范围的高载量标本建议采用阴性质控品将标本稀释到线性范围后再检测,然后将测定结果乘以稀释倍数即得出高载量标本的实际浓度。由于国内PCR测定主要依靠手工进行核酸提取,模板制备、仪器设备、扩增反应体系、数据处理等均会对检测结果产生影响。对于高载量血清的稀释检测,一方面随着操作步骤的增加,使得操作因素对检测结果的影响增大;另一方面由于稀释液有可能改变标本的物理和化学性状,可能对核酸的提取或扩增造成影响,最终影响检测结果的准确性。厂家建议采用阴性质控品作为稀释液,其主要成分为HBV阴性血清,但由于试剂盒自带阴性质控品量少,除用于日常质控外,难以满足临床稀释检测的需要,因而我们使用自制阴性血清、生理盐水和蒸馏水作为稀释液对超过线性范围的定值血清进行稀释检测,试图寻找适合的稀释液用于临床工作中高载量标本HBV-DNA的稀释检测。
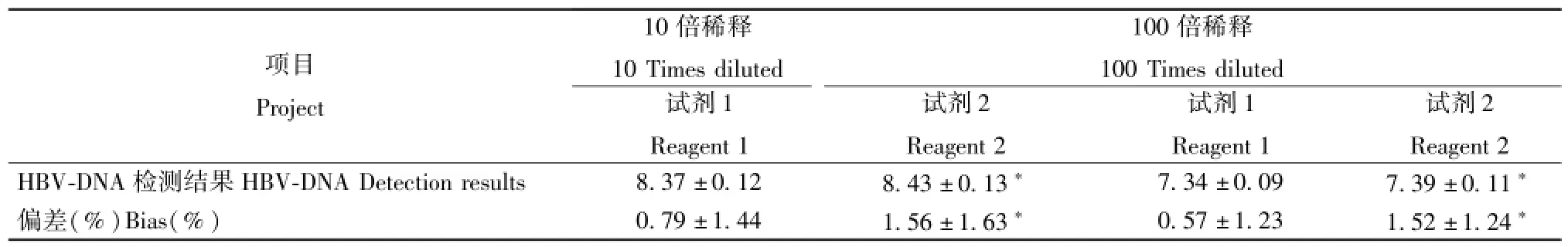
表3 不同试剂检测结果比较Tab.3 Detection resu1ts using different reagents
在10倍稀释时,比较使用候选稀释液与标准稀释液进行稀释检测的结果我们发现采用阴性血清、生理盐水作为稀释液时,其结果均高于使用标准稀释液进行稀释时的检测结果,差异均具有统计学意义(P<0.05);而使用蒸馏水与使用标准稀释液进行稀释检测的结果基本一致,差异无统计学意义(t =2.04,P>0.05)。在偏差分析中,我们以《CNASCL36医学实验室质量和能力认可准则在分子诊断领域的应用说明》规定的(靶值±0.4对数值)为允许总误差(TEa),当偏差小于此TEa时可接受,否则不可接受作为判断标准。我们以定值标准品稀释后的理论值作为参照,计算此时使用不同稀释液进行稀释检测的偏差,发现使用标准稀释液和蒸馏水作为稀释液,检测偏差均小于TEa,满足标准要求,且两者偏差比较差异无统计学意义(t=2.00,P> 0.05);而使用阴性血清、生理盐水稀释时,虽然偏差均值符合标准要求,但分别有16.67%和20.00%的偏差大于TEa,不满足标准要求。
在100倍稀释时,使用三种候选稀释液,检测结果均高于标准稀释检测时的结果,差异有统计学意义(P<0.05)。我们尝试通过曲线拟合寻找使用候选稀释液与使用标准稀释液时检测结果间的函数关系,结果发现仅在100倍稀释时,蒸馏水稀释与标准稀释结果符合线性要求,其公式为Y=0.963X+ 0.267,r2=0.977(Y=标准稀释检测结果,X=蒸馏水稀释检测结果)。此时的偏差分析显示,使用标准稀释液与三种候选稀释液稀释,其偏差均小于TEa,满足标准要求。使用不同稀释液,其偏差之间的差异具有统计学意义(P<0.05),其中使用标准稀释液偏差最小,蒸馏水次之,阴性血清偏差最大。
由于阴性质控品、定值标准品与HBV阳性定量参考品为同一厂家提供,厂家在引入机制上的质量控制措施确保其在基本成分上的一致性,使得使用阴性质控品对定值标准品进行稀释后,对核酸提取体系及模板扩增体系的影响最小,检测结果更为接近稀释样品的真值。当使用另一厂家提供的试剂对标准稀释的样品进行检测与使用原厂家试剂检测结果进行比较后发现,两者在检测结果及与理论值之间偏差方面的差异均有统计学意义(P<0.05)。说明使用阴性质控品进行稀释检测效果最好与使用同一厂家试剂有关,在稀释检测时如所使用的稀释液(阴性质控品)与试剂为不同厂家提供,易造成稀释检测结果的不准确。虽然自制阴性血清(经筛选排除携带HBV-DNA的可能)主要成分与临床待检标本基本一致,理论上对HBV-DNA检测不会造成大的影响。但通过实验我们发现在10倍与100倍稀释检测时,使用自制阴性血清作为稀释液,检测结果高于使用阴性质控品时,且偏差最大,这或许是自制阴性血清与阴性质控品在蛋白、糖类、脂类及各种酶的含量上与阴性质控品的差异导致其核酸提取、模板扩增效率不同而导致。在使用生理盐水作为稀释液时,其检测结果同样高于使用阴性质控品时,这可能与生理盐水干影响核酸提取试剂(主要成分为NaOH、Tris-HCL、TritonX-100、NP-40、Che1ex-100、EDTA)的离子浓度和缓冲体系,从而导致结果间的差异。
综合以上分析,我们认为对于高载量HBV-DNA标本的稀释检测,试剂盒自带的阴性质控品是最佳稀释液,建议厂家能够为临床提供标准化的专用稀释液,工作中应需要注意的是稀释液与检测试剂应为同一厂家提供。当试剂盒自带阴性质控品不能满足临床稀释检测需要时,在10倍稀释时可以使用蒸馏水作为替代稀释液进行稀释检测;而阴性血清与生理盐水各有16.67%和20.00%的偏差大于TEa,不满足标准要求,故在此时不适合作为替代稀释液使用。在100倍稀释时,虽然蒸馏水、阴性血清、生理盐水作为稀释液进行稀释检测均能满足质量标准的要求,从检测结果与偏差的比较来看,蒸馏水仍是最佳替代稀释液,此时,将蒸馏水稀释检测的结果按照公式Y=0.963X+0.267(Y=报告结果,X=检测结果)进行校正,可得到与使用阴性质控品稀释检测相一致的结果,使得结果更为精确。
[1] 刘波,徐岳军,庄晓玲,等.慢性乙型肝炎患者细胞毒T细胞内穿孔素的表达与病毒载量的关系.中华微生物学和免疫学杂志,2010,30:315-317.doi:10.3760/cma.j.issn.0254-5101.2010.01.006.
[2] 李一荣,王雪平,陈凤花,等.慢性乙肝患者HBV核心基因一组单核苷酸多态性与血清HBV DNA水平的相关性研究.中华微生物学和免疫学杂志,2011,31:443-447.doi:10.3760/ cma.j.issn.0254-5101.2011.05.013.
[3] 江红秀,韩国荣,王翠敏,等.妊娠后期拉米夫定抗病毒治疗HBV DNA高载量孕妇的母婴结局分析.中华肝脏病杂志,2012,20:888-891.doi:10.3760/cma.j.issn.1007-3418.2012. 12.003.
[4] IshikawaT.C1inica1featuresofhepatitisBvirus-re1ated hepatoce11u1ar carcinoma.Wor1d J Gastroentero1,2010,16:2463-2467.doi:10.3748/wjg.v16.i20.2463.
[5] Huang L,Li J,Lau Wy,et a1.Perioperative reactivation of hepatitis Bvirus rep1icationinpatients undergoingpartia1 hepatectomyforhepatoce11u1arcarcinoma.JGastroentero1 Hepato1,2012,27:158-164.doi:10.1111/j.1440-1746.2011. 06888.x.
[6] 许春,魏倪.核苷(酸)类药物治疗HBV DNA高载量慢性乙型肝炎一例.中华临床感染病杂志,2011,4:56-57.doi:10.3760/cma.j.issn.1674-2397.2011.01.015.
[7] 丁晨,潘凡,胡还章,等.HBV DNA高载量的肝细胞癌患者肝癌根治术后抗病毒治疗疗效观察.临床肝胆病杂志,2014,30:656-659.doi:10.3969/j.issn.1001-5256.2014.07.021.
[8] 王召钦,周伯平,陈心春,等.国产HBV DNA荧光定量PCR试剂检测准确性的初步分析.中华实验和临床病毒学杂志,2009,23:479-481.doi:10.3760/cma.j.issn.1003-9279.2009. 06.026.
[9] 贺勇,陈嵌,唐治贵,等.干、湿化学检测系统测定肾功能高值标本时稀释液的选择与评价.重庆医学,2012,41:542-544. doi:10.3969/j.issn.1671-8348.2012.06.009.
[10] 孙彬,白光亮,丁修冬,等.HCG稀释检测对结果的影响及解决策略探讨.标记免疫分析与临床,2014,21:726-728.doi:10.11748/bjmy.issn.1006-1703.2014.06.033.
[11] 周洪,陈志菊,周绍英.2种检测系统测定血、尿淀粉酶高值标本时稀释液的评价与选择.重庆医学,2015,44:1048-1051. doi:doi:10.3969/j.issn.1671-8348.2015.08.012.
[12] 汪东剑,张晓云,江丁.乳汁成分对乙型肝炎病毒DNA检测的影响.海南医学,2013,24:2409-2411.doi:10.3969/j.issn. 1003-6350.2013.16.0993.
[13] 严颖,麦丽,郑玉宝,等.慢性乙型肝炎患者血清HBV DNA载量与肝组织病理改变的分析.中山大学学报(医学科学版),2012,33:486-489.
[14] European Association for the Study of the Liver.EASL c1inica1 practive guide1ines:managementofchronichepatitisB.J Hepato1,2016,64:179-202.doi:10.1016/j.jhep.2015. 07.040.
Select and evaluate the diluents for quantitative detection of HBV DNA of high loads sample
WangDongjian,Yu Weitao,Zhang Xiaoyun,Liu Dongping,Qiu Huaqin,Peng Huiqiong No.184 Hospital of People's Liberation Army,Yingtan 335000,China
Yu Weitao,Email:dearwdj@163.com
Objective To se1ect and eva1uate the di1uents for quantitative detection of HBV DNA of high 1oads samp1e,hope to find the most app1icab1e di1uents which cou1d be used in c1inica1 test.Methods The standard substance(2.00×109IU/m1)was 10 and 100 times di1uted by different di1uents,compare the resu1t of test,and the bias was ana1ysis taking negative qua1ity contro1 as standard di1uents,negative serum,physio1ogica1 sa1ine,and disti11ed water as candidate di1uents.Results When 10 times di1uted,there was no statistica11y difference between the standard di1uents and disti11ed water as di1uents(t=2.04,P>0.05),the bias were 1ess than the TEa regu1ated by professiona1 standard.When used negative serum and physio1ogica1 sa1ine as di1uents,the resu1ts were higher than that of standard di1uents(P<0.05),and the ratio of the bias higher than the TEa was 16.67%and 20.00%.When 100 times di1uted,the resu1ts of candidate di1uents were higher than that of standard di1uents.In this time,the resu1t of disti11ed water di1uted detection presented a good 1inear re1ationship with the resu1t of standard di1uted detection,the formu1a was Y=0.963X+0.267(Y=resu1t of standard di1uted detection,X=resu1t of disti11ed water di1uted detection).A11 the bias were 1ess than the TEa,the sequence of bias sort by ascending counts were negative qua1ity contro1,disti11ed water,physio1ogica1 sa1ine and negative serum.Conclusions The most app1icab1e di1uents were negative qua1ity contro1 and disti11ed water with 10 times di1ution.When 100 times di1uted was used,the most app1icab1e di1uents was negative qua1ity contro1,then was disti11ed water,physio1ogica1 sa1ine and negative serum.If using the disti11ed water to di1ute,we cou1d corrected the resu1t by the formu1a Y= 0.963X+0.267 to ensure the resu1t to be more exact1y.
Di1uents;Hepatitis B;DNA;Detection
余维涛,Emai1:dearwdj@163.com
10.3760/cma.j.issn.1003-9279.2016.02.028
南京军区医药卫生科研基金课题(MS078)
2016-01-06)
