重组病毒MVA-S的构建及其在小鼠中的免疫效果
2016-08-19臧晚春潘瑞陈国敏毕胜利曾毅
臧晚春 潘瑞 陈国敏 毕胜利 曾毅
102206北京,中国疾病预防控制中心病毒病预防控制所传染病预防控制国家重点实验室
重组病毒MVA-S的构建及其在小鼠中的免疫效果
臧晚春 潘瑞 陈国敏 毕胜利 曾毅
102206北京,中国疾病预防控制中心病毒病预防控制所传染病预防控制国家重点实验室
目的 构建表达HBsAg重组MVA病毒,鉴定其抗原性并探讨不同免疫策略对免疫效果的影响。方法 通过基因克隆的方法构建携带目的基因的重组pSC11质粒,该重组质粒与MVA病毒共转染BHK-21细胞后,发生同源重组,经数轮蓝白斑筛选后,获得携带目的基因的重组病毒MVA-S。通过PCR和Western B1ot鉴定目的基因的表达。分别采用单独免疫和联合免疫的策略免疫BALB/c小鼠,通过ELISpot检测细胞免疫水平。结果 PCR和Western B1ot证实MVA-S携带目的基因并具有抗原性。ELISpot结果显示MVA-S能诱导小鼠产生特异性细胞免疫,MVA-S与DNA-S疫苗单独免疫效果无统计学差异;DNA-S疫苗和MVA-S联合免疫效果强于DNA-S疫苗单独免疫;等剂量DNA-S疫苗初始免疫,高剂量MVA-S加强免疫效果更强;2种DNA疫苗(pVR-S、pcDNA-S)分别初始免疫、等剂量MVA-S加强免疫,组间差异无统计学意义。结论 研究成功构建了表达目的基因的重组病毒MVA-S,该重组病毒可诱导小鼠产生特异性细胞免疫,联合免疫效果更强。
【主题词】 痘苗病毒安卡拉株;乙肝表面抗原;联合免疫
乙型肝炎病毒(Hepatitis B virus,HBV)感染可造成急性或慢性肝脏疾病,根据世界卫生组织(Wor1d Hea1th Organization,WHO)公布数据,每年约有78万人死于急性或慢性乙型肝炎[1]。目前药物治疗不能彻底清除感染者体内HBV复制,且有药物副作用、耐药性等缺点。研究发现慢性乙肝患者体内HBV免疫耐受状态与T细胞耗竭有关[2],因此研究者提出治疗型疫苗概念,通过疫苗呈递抗原,诱导机体产生特异性细胞免疫,打破免疫耐受状态,从而清除HBV[3]。痘苗病毒安卡拉株(Modified vaccinia Ankara,MVA)为绒毛尿囊膜痘苗病毒安卡拉株(Chorioa11antois vaccinia virus Ankara,CVA)在鸡胚成纤维细胞(CEF)中连续传代571次获得,曾在全球消灭天花运动中广泛应用,因其外源基因容量大、复制缺陷性、高安全性等特点,成为理想疫苗载体之一,诸多以MVA为载体,针对感染性疾病如HIV/ AIDs、疟疾、结核、丙肝、癌症等的候选疫苗已开展临床前实验和临床试验[4]。
本研究构建了表达HBsAg基因的重组MVA-S病毒,鉴定外源基因携带与表达后,探讨了单独免疫和联合免疫策略下小鼠的免疫效果。
1 材料与方法
1.1材料 表达HBsAg的pVR-S和pcDNA-S质粒由陈国敏教授构建,pSC11穿梭质粒为本室保存;pS-、pS+和TKR-、TKL+引物对分别扩增目的基因和病毒 TK区基因,为陈国敏教授设计,合成由Invitrogen公司完成;Mouse γ-IFN ELISpot试剂盒为Mabtech公司产品。MVA毒株和BHK-21细胞为本室保存,CEF为本所董婕老师馈赠;4~6周龄BALB/c小鼠购自中国食品药品检定研究院。
1.2方法
1.2.1重组质粒pSC11-S构建:用PCR方法扩增HBsAg基因片段。将目的基因和pSC11质粒经Sa1 I和Bg1 II双酶切后用T4连接酶连接,并转化感受态细胞DH5α,经IPTG诱导,在含X-ga1和氨苄青霉素的LB平板上挑取单克隆,得到重组质粒pSC11-S,测序鉴定。
1.2.2重组病毒MVA-S构建:pSC11-S转染已感染MVA的BHK-21细胞,48 h后冻融裂解细胞收获病毒。以10倍病毒稀释液感染 CEF,48 h后加37℃预热的中性红和X-ga1低熔点琼脂糖胶,约2 h后挑取最大稀释度的蓝色克隆,重复筛选至第3代时开始采用PCR鉴定,筛选至10代以后,连续3次PCR和Western B1ot鉴定获得重组病毒MVA-S,扩增纯化。
1.2.3重组病毒MVA-S的鉴定:取MVA-S病毒液感染BHK-21细胞,48 h后收集细胞,冻融3次后胰酶消化,用酚氯仿法提DNA,引物分别用pS+和pS-、TKL+和pS-、pS+和TKR-、TKL+和TKR-,扩增鉴定MAV-S。用上样buffer处理病毒感染的细胞,同法处理等量未感染病毒的细胞,作为阴性对照,进行SDS-PAGE胶电泳,电泳完毕后将蛋白转至NC膜,5%脱脂奶4℃下过夜封闭,鼠HBsAg单抗(1∶100稀释)4℃下过夜孵育,TBST振荡洗膜3次后,加ALP标记的山羊抗鼠IgG(1∶1000稀释)室温孵育2 h,TBST振荡洗膜3次,按显色试剂盒说明书显色。
1.2.4重组MVA-S病毒大量扩增与纯化:用MVAS病毒液感染BHK-21细胞,大量扩增重组病毒,超声破碎细胞大约30 s,4℃下12000 rpm离心5 min,收集上清。SW41超离管中加一半体积的36%蔗糖溶液,小心缓慢加入等体积病毒液,4℃下30000×g离心1 h,弃上清,用1 m1 10 mmo1/L Tris-HC1 pH9.0重悬病毒沉淀,冻存于-80℃,用噬斑法测定滴度。1.2.5 重组病毒MVA-S免疫小鼠:4~6周龄SPF级雌性BALB/c小鼠随机分组,每组5只。单独免疫策略:2×pVR-S、2×pcDNA-S、2×MVA-S、2×TE(空白对照),质粒100 μg/只/次,MVA-S 8.4×107pfu/只/次,于第1、3周免疫,第4周处死小鼠取脾细胞。联合免疫策略:2×pcDNA-S/1×低剂量MVA-S(DDMS-L)、2×pcDNA-S/1×中剂量MVA-S (DDMS-M)、2×pcDNA-S/1×高剂量 MVA-S (DDMS-H)、2×pVR-S/1×低剂量MVA-S(PPMSL)、2×pVR-S/1×中剂量MVA-S(PPMS-M)、2× pVR-S/1×高剂量MVA-S(PPMS-H),以同样DNA疫苗初免、MVA加强作为对照。质粒剂量同单独免疫,于第1、5周免疫,MVA-S低、中、高剂量分别为8.4×107pfu/只/次、1.8×108pfu/只/次、3.6×108pfu/只/次,对照组MVA剂量同相应剂量组MVA-S,于第7周免疫,第8周处死小鼠取脾细胞。
1.2.6ELISpot检测细胞免疫反应:小鼠处死后无菌操作取出脾脏,分离脾细胞。ELISpot样品检测孔中加入50 μ1浓度为10 μg/m1三肽混合物,阳性刺激孔中加入50 μ1含0.05 μg/m1 PMA和10 μg/m1离子霉素的10%FBS 1640培养基,阴性孔不加刺激物。每孔加入5×105个脾细胞(sp1enocytes),孵育48 h,显色40 min,其余操作同说明书。使用AID EL1ispot Reader计数仪计数孔内斑点数,计算样品孔与阴性孔斑点均值差,并将其换算成106个脾细胞形成斑点数(SFC/106sp1enocytes)。
1.3统计学方法 采用SAS 9.2统计软件对各组百万脾细胞形成斑点数进行分析,多组比较采用随机区组方差分析,两两比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1重组质粒pSC11-S鉴定 重组质粒pSC11-S 经Sa1 I和Bg1 II酶切和测序分析目的基因的连接位点和序列正确。
2.2重组病毒 MVA-S鉴定 未感染病毒正常CEF铺胶后,细胞被中性红着红色;感染MVA母病毒的CEF不能被中性红着色,显白斑;由于重组病毒MVA-S携带LacZ基因,经X-ga1诱导后感染重组病毒MVA-S的CEF显蓝斑。重组病毒经连续蓝白斑筛选至10代后,采用PCR方法扩增目的基因片段,Western B1ot方法检测目的基因的表达,结果显示目的基因插入方向正确,并有目的蛋白表达。
2.3ELISpot结果
2.3.1单独免疫:2×MVA-S组与2×MVA组SFC/ 106sp1enocytes差异有统计学意义(t=3.56,P= 0.012);2×pVR-S组与2×TE组SFC/ 106sp1enocytes差异有统计学意义(t=3.67,P= 0.0063);2×pcDNA-S组与 2×TE组SFC/ 106sp1enocytes差异有统计学意义(t=3.40,P= 0.009)。2×MVA-S、2×pcDNA-S以及2×pVR-S组之间随机区组方差分析结果表明三组的SFC/106sp1enocytes差别无统计学意义(F=0.68,P= 0.580),见图1。
2.3.2联合免疫:各联合免疫实验组与对照组差异均有统计学意义,t检验结果见表1。
2.3.3相同DNA疫苗初始免疫,使用不同剂量MVA-S加强免疫:DDMS-L、DDMS-M、DDMS-H三剂量组间差异有统计学意义(F=9.30,P=0.004),两两比较结果显示DDMS-L和DDMS-M剂量组间差异无统计学意义(t=-1.28,P=0.675),DDMS-M 和DDMS-H剂量组间差异有统计学意义(t= -2.93,P=0.038),DDMS-L和DDMS-H剂量组间差异有统计学意义(t=-4.21,P=0.004)。PPMSL、PPMS-M、PPMS-H三剂量组间差异有统计学意义(F=12.67,P=0.001),两两比较结果显示PPMS-L 和PPMS-M剂量组间差异无统计学意义(t= -1.80,P=0.289),PPMS-M和PPMS-H剂量组间差异有统计学意义(t=-3.167,P=0.024),PPMSL和 PPMS-H剂量组间差异有统计学意义(t= -4.97,P=0.001),见图2。
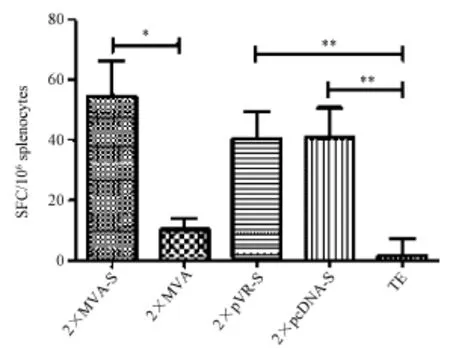
Note:∗:P<0.05;∗∗:P<0.01图1 单独免疫组ELISpot斑点形成数Fig.1 ELISpot of sing1e immunization strategy
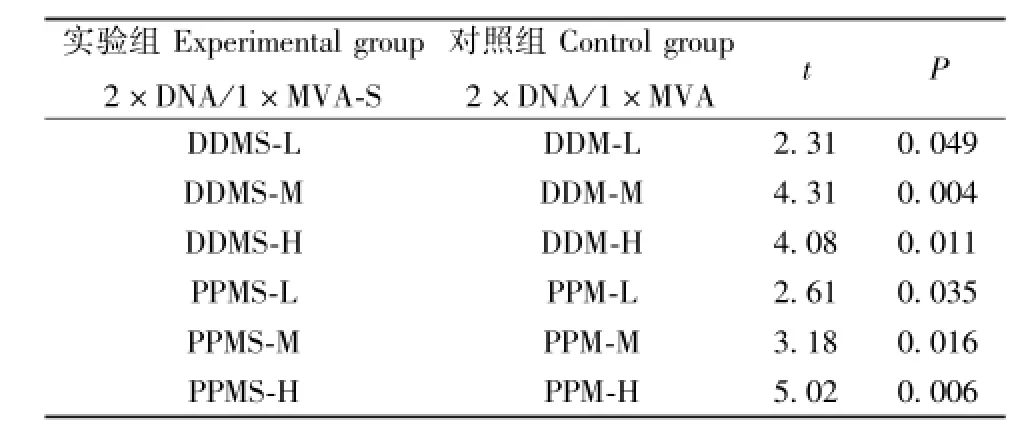
表1 2×DNA/1×MVA-S与2×DNA/1×MVA组t检验Tab.1 t test of 2×DNA/1×MVA-S group and 2×DNA/1×MVA group
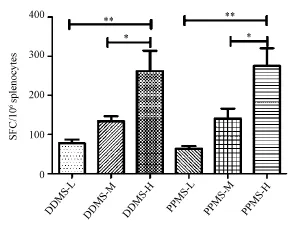
Note:∗:P<0.05;∗∗:P<0.01图2 不同剂量MVA-S疫苗加强免疫斑点数Fig.2 SFC of different MVA-S doses boost groups
(4)不同质粒载体、相同外源基因的DNA疫苗初始免疫,相同剂量MVA-S加强免疫:等剂量MVAS下,不同载体DNA疫苗组之间差异无统计学意义,见表2。
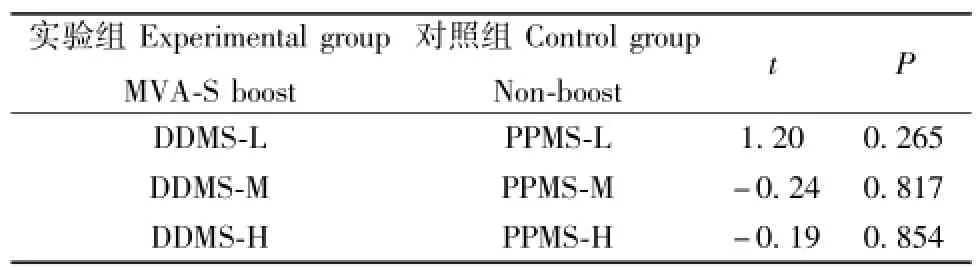
表2 不同DNA疫苗初始免疫以及相同MVA-S加强免疫效果比较(t检验)Tab.2 t test of efficacy among different DNA primes with same MVA-S boost groups
3 讨论
目前乙肝治疗型疫苗研究中,以我国闻玉梅院士团队研发的 “乙克”和古巴“NASVAC”领先临床试验,前者临床III期试验结果显示“乙克”实验组和铝佐剂对照组受试者的血清HBV DNA水平和肝功指标正常化率差异无统计学意义(P>0.05)[5],NASVAC临床III期试验尚未发布试验结果。其他治疗型疫苗,如抗原抗体复合物疫苗、DNA疫苗、病毒载体疫苗仍处于临床前期实验或临床I期试验阶段[6-9]。本研究在本室研究基础上[10],构建了表达HBsAg的重组病毒MVA-S可引起小鼠脾细胞产生特异性细胞免疫应答,该疫苗用于DNA疫苗初始免疫后加强免疫,可产生更强免疫效果,这一结果符合既往联合免疫实验结果[11],联合免疫效果优于单独免疫的原因可能为前者能引起更高水平的CD8+T细胞免疫、Th1型CD4+T细胞免疫,有研究提出联合免疫可以减弱抗载体反应。联合免疫亦存在缺点,免疫效果可受多种因素影响,如剂量、间隔、载体类型、抗载体反应等等[12]。本研究高剂量组MVA-S (3.6×108pfu/只)加强免疫效果明显高于中剂量和低剂量组,其原因可能是低剂量免疫倾向于引起免疫记忆,而高剂量引起免疫效应[13]。本实验同时研究了相同MVA-S、不同DNA疫苗初始免疫效果差异,结果表明DNA疫苗载体对免疫效果影响无统计学意义,但实验并未研究不同病毒载体对免疫效果的影响,而加强免疫用病毒载体可能对免疫效果影响更大。有研究表明使用不同病毒载体疫苗可能获得更强免疫效果,如DNA/MVA/Adv三种载体HIV疫苗序贯免疫小鼠获得的免疫效果强于DNA/Adv两种疫苗联用的免疫效果[14],后续研究可以比较表达HBsAg的不同病毒载体疫苗加强免疫效果。此外,本实验室前期研究发现不同DNA疫苗免疫间隔影响最终免疫效果,间隔1周免疫效果不一定最好,要获得理想的免疫间隔,还需要更多实验。
[1] 乙 型 肝 炎.http://www.who.int/mediacentre/factsheets/ fs204/zh/.
[2] Miche1 ML,Deng Q,Mancini-Bourgine M.Therapeutic vaccines and immune-based therapies for the treatment of chronic hepatitis B:perspectives and cha11enges.J Hepato1,2011,54:1286-96. doi:10.1016/j.jhep.2010.12.031.
[3] Mancini-BourgineM,Miche1ML.Therapeuticvaccination against chronic hepatitis B virus infection.J C1in Viro1,2005,60:257-65.doi:10.1016/S1386-6532(05)80019-8.
[4] Sanchez-Sampedro L,Perdiguero B,Mjias-Perez E,et a1.The evo1ution of poxvirus vaccines.Viruses,2015,7:1726-803. doi:10.3390/v7041726.
[5] Xu DZ,Wang XY,Shen XL,et a1.Resu1ts of a phase III c1inica1tria1withanHBsAg-HBIGimmunogeniccomp1ex therapeutic vaccine for chronic hepatitis B patients:experiences and findings.J Hepato1,2013,59:450-6.doi:10.1016/j. jhep.2013.05.003.
[6] Li J,Ge J,Ren S,et a1.Hepatitis B surface antigen(HBsAg)and core antigen(HBcAg)combine CpG o1igodeoxynuc1etides as a nove1 therapeutic vaccine for chronic hepatitis B infection. Vaccine,2015,33:4247-54.doi:10.1016/j.vaccine.2015. 03.079.
[7] Cavenaugh JS,Awi D,Mendy M,et a1.Partia11y randomized,non-b1inded tria1 of DNA and MVA therapeutic vaccines based on hepatitis B virus surface protein for chronic HBV infection.PLoS One,2011,6:e14626.doi:10.1371/journa1.pone.0014626.
[8] Yang SH,Lee CG,Park SH,et a1.Corre1ation of antivira1 T-ce11 responses with suppression of vira1 rebound in chronic hepatitis B carriers:a proof-of-concept study.Gene Ther,2006,13:1110-7.doi:10.1038/sj.gt.3302751.
[9] MartinP,DuboisC,JacquierE,eta1.TG1050,an immunotherapeutic to treat chronic hepatitis B,induces robust T ce11s and exerts an antivira1 effect in HBV-persistent mice.Gut,2015,64:1961-71.doi:10.1136/gutjn1-2014-308041.
[10] 陈丹瑛,汪孟冉,何小周,等.HIV-1中国流行株CRF01_AE env基因改造及其重组DNA疫苗的构建.中华实验和临床病毒学杂志,2014,28:227-229.doi:10.3760/cma.j.issn. 1003-9279.2014.03.023.
[11] Dep1a E,Van Der AA A,Livingston B D,et a1.Rationa1 design of a mu1tiepitope vaccine encoding T-1ymphocyte epitopes for treatment of chronic hepatitis B virus infections.Journa1 of viro1ogy,2008,82:435-50.doi:10.1128/jvi.01505-07.
[12] Kardani K,Bo1hassani A,Shahbazi S.Prime-boost vaccine strategy against vira1 infections:Mechanisms andbenefits. Vaccine,2016,34:413-23.doi:10.1016/j.vaccine.2015. 11.062.
[13] Vaccineimmuno1ogy.http://www.who.int/immunization/ documents/E1sevier_Vaccine_immuno1ogy.pdf?ua=1.
[14] Zhang L,Yang L,Feng X,et a1.Combined immunization of mice with DNA,rMVA and rAd5 expressing HIV-1 structura1 genes from different subtypes.Curr HIV Res,2012,10:498-503.10.2174/157016212802429776.
Construction of recombinant MVA-S and its immune effect in mice
Zang Wanchun,Pan Rui,ChenGuomin,Bi Shengli,Zeng Yi State Key Laboratory for Infectious Disease Control and Prevention,National Institute for Viral Disease Control and Prevention,Chinese Center for Disease Control and Prevention,Beijing 102206,China
Chen Guomin,Email:guominch2013@163.com;Zeng Yi,Email:zengyicdc@ sina.com
Objective To construct the recombinant modified vaccinia Ankara vaccine expressing HBsAg and investigate its antigenicity and immune effect by different strategies.Methods Target gene was c1oned into p1asmid pSC11,the recombinant p1asmid pSC11-S was transfected into BHK-21 ce11s that infected with MVA.Homo1ogous recombination occurred between MVA and pSC11-S.The recombinant virus MVA-S was se1ected by severa1 rounds of b1ue/c1ear p1aques.Target gene was identified by PCR.The expression of target gene was ana1yzed by Western B1ot.The BALB/c mice were immunized with sing1e immunization and consecutive immunization strategy.The 1eve1 of specific ce11u1ar response was measured by ELISpot assays.Results The recombinant virus expressing target gene was confirmed by PCR and Western B1ot showed that MVA-S cou1d e1icit specific ce11u1ar response.There were no significant differences among two kinds of DNA vaccine and recombinant MVA-S.The prime/boost regimen cou1d induce higher ce11u1ar response than sing1e DNA vaccine immunization.High doses of MVA-S boost with the same DNA vaccine prime cou1d induce highest response.There was no significant difference between different DNA vaccines (pVR-S,pcDNA-S)fo11owed by same MVA-S boost.ConclusionsMVA-S expressing target was constructed successfu11y,and it cou1d induce specific ce11u1ar immune response which was higher with the strategy of DNA prime/MVA-S boost than that of sing1e immunization.
Modified vaccinia Ankara;HBsAg;Consecutive immunization
陈国敏,Emai1:guominch2013@163.com;曾毅,Emai1:zengyicdc@sina.com
10.3760/cma.j.issn.1003-9279.2016.02.010
2015-12-24)
