稻瘟病菌孢子qPCR方法的建立及用于监测气传菌源的研究
2016-08-18许燎原赵丽稳胡宇峰2邱海萍3柴荣耀3宁波市种植业管理总站浙江宁波3502浙江省宁海县农业技术推广总站浙江宁海35600浙江省农业科学院植物保护与微生物研究所浙江杭州3002
许燎原,赵丽稳,胡宇峰2,邱海萍3,柴荣耀3,张 震(.宁波市种植业管理总站,浙江宁波3502;2.浙江省宁海县农业技术推广总站,浙江宁海35600;3.浙江省农业科学院植物保护与微生物研究所,浙江杭州3002)
稻瘟病菌孢子qPCR方法的建立及用于监测气传菌源的研究
许燎原1,赵丽稳1,胡宇峰2,邱海萍3,柴荣耀3,张 震3,*
(1.宁波市种植业管理总站,浙江宁波315012;2.浙江省宁海县农业技术推广总站,浙江宁海315600;3.浙江省农业科学院植物保护与微生物研究所,浙江杭州310021)
稻瘟病是水稻生产中最具毁灭性的真菌病害之一,监测田间空气中稻瘟病菌分生孢子数量动态变化,对于预测病情发生和指导及时防治具有重要意义。该研究以稻瘟病菌MHP1基因为靶序列,建立了1种稻瘟病菌分生孢子qPCR定量方法,并采用此方法对田间气传稻瘟病菌源进行了监测。监测数据显示,监测期间空气中稻瘟病菌分生孢子数量波动幅度较大。结合气象条件进行分析,菌源量的波动与气象条件相关。该研究建立的孢子qPCR方法可应用于监测气传稻瘟病菌源。
稻瘟病;分生孢子量;孢子捕捉;qPCR;气象因子
由子囊菌Magnaporthe oryzae侵染引起的稻瘟病是水稻生产中最具毁灭性的真菌病害之一[1],该病属于单年多循环病害,病稻草上的越冬菌源和当年病斑上产生的分生孢子经由气流传播是稻瘟病发生的初侵染源和再侵染源。因此,及时监控稻田空气中的稻瘟病菌源量,可以为有效进行病害的控制和管理提供依据。
长期以来,空气中稻瘟病菌源监测以凡士林玻片或旋转式孢子捕捉器等捕捉样品的显微计数为主[2-3]。显微计数不仅工作量大,而且鉴于环境样品的复杂性,包含固体颗粒物和形态近似孢子等,显微计数的结果可能与实际情况存在较大偏差。基于Taqman的qPCR技术,以其特异性强、灵敏度高、重复性好、速度快等优点已广泛应用于植物病原菌的定量监测[4]。这些菌源定量监测方法通常以病原真菌的rDNA区域保守序列为靶标设计特异性的Taqman探针[5-6]。但由于这些序列与病原菌的致病性无关,其用于监测环境样本中致病菌源量,所得数据中包含大量的非致病菌,不利于病害的准确预测。如将与病菌致病性相关的特异性标记结合应用于病害的流行预警,所得数据更具可靠性。近来,Su'udi等[7]根据稻瘟病菌致病相关基因MHP1设计了用于稻瘟病菌菌量检测的Taqman探针,并成功实现了对病害严重度的比较。基于他们的研究结果,本研究研发空气传播的稻瘟病分生孢子定量检测方法,并开展水稻生育期内稻瘟病菌空气传播分生孢子数量的动态监测,对及时预测田间病害发生情况具有重要的现实意义。
1 材料与方法
1.1 菌株
稻瘟病菌菌株12-10-1和小麦赤霉病菌12-02均由浙江省农业科学院植物保护与微生物研究所粮食作物病害研究室分离保存。
稻瘟病菌分生孢子获得:滤纸片上保存的菌株于CM平板28℃活化后,切取适量菌块接种到CM平板,28℃、12 h(L)/12 h(D)光暗交替培养8 d。平皿内倒入适量无菌水,用高压灭菌的毛笔轻刷菌落,吸取菌悬液经4层灭菌擦镜纸过滤,滤液经2 500 g离心10 min收集分生孢子,加入适量TE溶液重悬分生孢子,用血球计数板计数后调整孢子浓度至1.5×107个·mL-1,-20℃保存待用。
小麦赤霉病菌菌株于PDA平板28℃活化后,切取适量菌块于100 mL 4%绿豆汤培养液中,25℃150 r·min-1振荡培养5 d。吸取菌液经4层灭菌擦镜纸过滤,收集滤液经2 500 g离心收集分生孢子,加入适量TE溶液悬浮,用血球计数板计数后调整孢子浓度至1.5×107个·mL-1,-20℃保存待用。
1.2 主要仪器与试剂
7500型实时荧光定量PCR仪和Premix Ex TaqTM荧光定量试剂盒,用于核酸的定量检测,分别为美国Applied Biosystems公司和TaKaRa宝生物工程(大连)有限公司产品。Fastprep-24和酸洗玻璃珠(425—600 μm)用于分生孢子的机械破壁,分别购自美国MP Biomedicals公司和Sigma-Aldrich公司。7 d孢子捕捉仪,用于田间空气传播的稻瘟病菌分生孢子捕捉,是英国Burkard Scientific公司产品,属吸入式7 d连续孢子捕捉仪,进气量10 L·min-1。HOBO u30小型自动气象站,用于田间小气候自动监测与记录,为美国Onset公司的产品。
1.3 稻瘟病菌分生孢子基因组DNA的提取
用TE溶液对上述稻瘟病菌孢子液进行10倍梯度稀释,配制1.5×107、1.5×106、1.5×105、1.5×104、1.5×103和1.5×102个·mL-1稻瘟病菌孢子悬浮液。对4个悬浮液中稻瘟病菌孢子浓度不足1.5×107个·mL-1,用赤霉病菌孢子母液进行补充,使得各悬浮液中真菌孢子量保持一致。取上述不同浓度的稻瘟病菌孢子悬浮液400 μL用于提取基因组DNA。DNA提取相关试剂及过程参见Ward[8]的方法。
1.4 引物及荧光探针设计
引物和 Taqman探针参照 Su'udi等[7]的序列。引物序列为(MHP1F1)5′-TCGATGCCGACAACTTCTCCG-3′和(MHP1R1)5′-ACCCTGGTCAAGCTGTTCGATTGT-3′;探针序列:5′-TGCCCATCGTAAGTTCCTTCTTCGCA-3′,其中5′和3′分别采用FAM和TAMRA进行修饰。上述引物探针均由美国Invitrogen公司合成。
1.5 qPCR扩增体系
qPCR扩增体系和反应程序参照TaKaRa宝生物工程(大连)有限公司Premix Ex TaqTM荧光定量试剂盒操作说明,略有改动。反应体系为2× Premix Ex TaqTM10 μL、10 μmol·L-1上下游引物及探针溶液各0.4 μL、50×ROX Reference DyeⅡ0.4 μL、DNA模板2 μL、ddH2O 6.4 μL,总体积为20 μL。反应程序采用2步法。qPCR结果利用7500荧光定量PCR仪自带软件SDS(版本v2.0.4)进行分析。
1.6 田间空气中稻瘟病菌孢子的捕捉
孢子捕捉点位于浙江省宁海县茶院乡稻作区(121.42°E,29.3°N)。周边种植的水稻品种以甬优系列籼粳杂交水稻为主。7 d孢子捕捉仪进气口距地面1.2 m。捕捉仪整年开启,每隔7 d更换用于收集样品的聚酯片。取下的聚酯片进行7等分,每份即为1 d的孢子捕捉样品。将每份聚酯片剪成2 mm宽的窄条装于2 mL离心管内,并用Ward[8]的方法提取基因组DNA,最终获得50 μL的DNA溶液。
1.7 田间小气候条件的监测
HOBO u30小型气象站安装于7 d孢子捕捉仪旁,整年开启,实时监测并记录取样点温度、降雨量、相对湿度和风速等气象数据。

图1 稻瘟病菌分生孢子定量标准曲线Fig.1 Standard curve used for quantifying rice blast spore
2 结果与分析
2.1 稻瘟病菌分生孢子定量标准曲线的建立
取上述1.5×107、1.5×106、1.5×105、1.5× 104、1.5×103和1.5×102个·mL-1的稻瘟病菌分生孢子悬浮液400 μL,分别相当于取6×106、6× 105、6×104、6×103、6×102和60个稻瘟病菌分生孢子,用于提取基因组DNA,最终各样品均获得50 μL的DNA溶液。分别取2 μL作为模板进行qPCR分析,结果显示,除孢子浓度为1.5×102个·mL-1的样品外,其他5个样品扩增曲线明显,平均Ct值分别为21.68、25.82、30.27、33.09和35.14。据Su'udi等[7]报道,检测下限为1 pg稻瘟病菌基因组DNA,按1 pg基因组DNA=0.978× 109bp计算[9],稻瘟病菌基因组大小约40 Mbp,分生孢子具有3个细胞,其理论最低可检出8个稻瘟病菌分生孢子。本研究中,孢子浓度为1.5× 102个·mL-1的样品没有扩增曲线,这与其孢子数量低于Su'udi等[7]报道的最低检测下限相符合。对5个有扩增结果的样品,按孢子数量的lg值与平均Ct值进行线性回归,结果显示具有良好的相关性,R2=0.977 9(图1)。
2.2 空气中孢子捕捉样品的检测
对2012年6月7日—10月28日采集的21批次空气中稻瘟病菌分生孢子捕捉样品进行了检测。收集的聚酯片按天进行等距分割,并提取基因组DNA,每天样品获得50 μL的DNA溶液。每个样品取2 μL,进行qPCR检测,获得各样品的Ct值。根据上述稻瘟病菌分生孢子定量的标准曲线,计算各PCR样品所对应的稻瘟病菌分生孢子数量,然后根据7 d捕捉仪每天吸气14 400 L,计算每立方空气中所含的稻瘟病菌分生孢子数量。结果显示,2012年6月7日—10月28日,稻田空气中稻瘟病菌分生孢子数量呈现明显的动态变化(图2),在孢子监测的144 d中有64 d未检测到稻瘟病菌分生孢子,其中有53 d集中在8月25日至10月28日;而稻瘟病菌分生孢子释放主要集中在6月7日至8月24日,检出的分生孢子数量为16.9~825.3 cfu·m-3空气,其中,8 月9日检出孢子数量最多。
2.3 空气中稻瘟病菌孢子数量与气象因子的关系
生物学研究表明,稻瘟病菌菌丝可以在8~37℃生长,适宜温度为26~28℃;分生孢子在10~35℃均可形成,最适温度为25~28℃。根据HOBO u30气象站数据,2012年6月7日至10 月28日,日平均气温为14.4~30.9℃,日最高气温为37.4℃,日最低温度除了10月18日、19日、23日和24日外均在10℃以上(图2),此温度条件下稻瘟病菌均能够生长和产孢。自然条件下,稻瘟病菌分生孢子大多数在夜间产生和释放,特别是在2:00—6:00[8]。定量监测结果显示,稻瘟病菌分生孢子释放主要集中在6月7日至8月24日,8月25日至10月28日监测到的孢子数量较少,仅有12 d可监测到稻瘟病菌孢子的存在。对每天夜间2:00—6:00的平均气温进行分析发现,6月7日至8月24日的气温为24~28℃,是稻瘟病菌的最适产孢温度;而8月25日至10月28日的绝大部分时间气温都低于20℃,不利于稻瘟病菌分生孢子的产生和释放。

图2 稻瘟病菌分生孢子数量与气温的动态变化Fig.2 Dynamic changes of temperature and number of rice blast spore
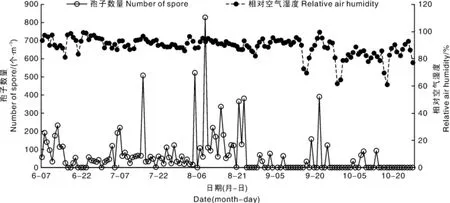
图3 稻瘟病菌分生孢子数量与空气相对湿度的动态变化Fig.3 Dynamic changes of relative air humidity and number of rice blast spore
稻瘟病菌分生孢子产生需要较高的相对湿度。本研究中,6月7日至10月28日中有79 d日平均相对湿度在60.5%以上,且绝大部分时间在85%以上(图3);2:00—6:00的空气相对湿度绝大部分在90%以上,叶面湿度在100%。总体上,监测点空气相对湿度有利于稻瘟病病菌分生孢子的产生。而实际监测数据显示,9月和10月孢子数量较少,说明空气相对湿度符合的条件下,当年监测点稻瘟病菌孢子产生主要受气温的影响,这与稻瘟病菌生物学特性的研究结果相符合[10-11]。
降雨可以增加空气相对湿度,有利于满足稻瘟病菌孢子形成所需的高湿环境条件,但雨水的冲刷不利于孢子向空中传播。本研究的数据显示,降雨对稻瘟病菌孢子经由空气传播的影响与此相符(图4)。6月7日至8月24日孢子集中释放期间,降雨后往往伴随着孢子的大量释放,典型的如7月16日(孢子数量达到507.9个·m-3空气)、8月5日(孢子数量达到523.8个·m-3空气)和8月9日(孢子数量达到852.3个·m-3空气),这3个日期之前均有连续2~3 d的降雨,而降雨当天孢子检出量相对较少,甚至未有孢子检出。
风力不仅影响稻瘟病菌分生孢子的机械脱落,也影响孢子在空气中的传播。本研究中监测点邻近浙江省三门湾,受海洋气候的影响,取样时间内绝大部分日期最大瞬时风速在5 m·s-1以上(图5),其有利于引起分生孢子的机械脱落和传播[12]。8月5日和8月9日孢子大量释放的时间,都伴随有7 m·s-1以上的最大瞬时风速。

图4 稻瘟病菌分生孢子数量与降雨量的动态变化Fig.4 Dynamic changes of rainfall and number of rice blast spore
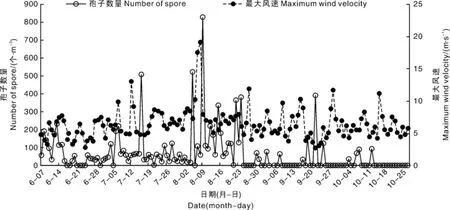
图5 稻瘟病菌分生孢子数量与最大风速的动态变化Fig.5 Dynamic changes of wind velocity and number of rice blast spore
3 结论与讨论
监测空气中稻瘟病菌分生孢子数量的动态变化,对于稻瘟病发生为害的预测预报及指导防治具有重要的现实意义。本研究利用 Su'udi等[7]设计的稻瘟病菌特异性Taqman探针,成功建立了1种稻瘟病菌分生孢子的定量方法,并应用其对稻田空气中稻瘟病菌分生孢子数量进行了监测。Su'udi等[7]的方法可检测出至少8个分生孢子的基因组DNA,本研究建立稻瘟病菌分生孢子定量标准曲线时,发现1.5×102个·mL-1的样品未有扩增曲线,最低检测限为2.4~24个分生孢子基因组DNA。总体上,本研究建立的稻瘟病菌分生孢子定量方法的灵敏度已足够用于田间菌源量的动态监测。
对孢子田间捕捉样品的定量分析发现,水稻生育期空气中稻瘟病菌分生孢子数量波动幅度较大,稻瘟病菌分生孢子释放集中在6月7日至8月24日,基本与这段时间温、湿度条件比较适宜稻瘟病菌分生孢子产生和释放有关[10]。宁海绝大部分时间风速较大,有利于孢子分散。据当地农业技术部门调查,附近乡镇当年种植的部分品种有叶瘟中度发生(个别品种重度发生)。早期的研究证明,稻瘟病菌株能够侵染牛筋草、狗尾草、马唐、稗、李氏禾、罗氏草和铺地黍等禾本科杂草[13-14],这些杂草在该稻区分布广泛。采样点邻近水库和溪流,多山地,6月7日至8月24日有利的温、湿度条件使得稻瘟病菌在这些杂草上迅速繁殖。
田间稻瘟病的发生程度受菌源量、寄主抗性水平和气象条件的共同决定。在明确品种抗性水平的前提下,利用本研究方法开展空气中稻瘟病菌孢子数量的监测,结合气象条件,及时预测预报是否有利于病害发生、发展和流行,能够对病害及时进行防控。
(References):
[1] SKAMNIOTI P,GURR S J.Against the grain:safeguarding rice from rice blast disease[J].Trends in Biotechnology,2009,27(3):141-150.
[2] 陈浩,康晓慧,张梅,等.稻瘟病菌空中孢子量与气象因子的关系[J].湖北农业科学,2009,48(8):1869-1871. CHEN H,KANG X H,ZHANG M,et al.Relationship between spatial spore amount of Pyricularia oryzae Cavara and meteorological factors[J].Hubei Agricultural Sciences,2009,48(8):1869-1871.(in Chinese with English abstract)
[3] 宋成艳,王桂玲,刘乃生,等.寒地稻瘟病菌空中捕捉量与田间稻瘟病发病和气象因子的关系[J].黑龙江农业科学,2011(9):39-41. SONG C Y,WANG G L,LIU N S,et al.Relationship of the amounts of germs of rice blast caught in the air with the incidence of rice blast in the field and the meteorological factors in cold region[J].Heilongjiang Agricultural Sciences,2011 (9):39-41.(in Chinese with English abstract)
[4] WEST J S,ATKINS S D,EMBERLIN J,et al.PCR to predict risk of airborne disease[J].Cell,2008,16(8):380 -387.
[5] BORNEMAN J,HARTIN R J.PCR primers that amplify fungal rRNA genes from environmental samples[J].Applied and Environmental Microbiology,2000,66(10):4356-4360.
[6] MARTIN K J,RYGIEWICZ P T.Fungal-specific PCR primers developed for analysis of the ITS region of environmental DNA extracts[J].BMC Microbiology,2005,5(1):1-11.
[7] SU'UDI M,KIM J,PARK J M,et al.Quantification of rice blast disease progressions through Taqman real-time PCR[J]. Molecular Biotechnology,2013,55(1):43-48.
[8] WARD E.Use of molecular methods for the detection of fungal spores[M].BURNS R.Plant pathology.New York:Humana Press,2009:147-159.
[9] DOLEZEL J,BARTOS J,VOGLMAYR H,et al.Nuclear DNA content and genome size of trout and human[J].Cytometry.Part A:the Journal of the International Society for Analytical Cytology,2003,51(2):127-128.
[10] OU S H.Rice diseases[M].2nd ed,Surrey:Commonwealth Mycological Institute,1989:109-200.
[11] 唐力琼,张玲,胡运高,等.稻瘟病菌生物学特性及产孢条件研究[J].河南农业科学,2012,41(6):97-100. TANG L Q,ZHANG L,HU Y G,et al.Biological characteristics and sporulation condition of Magnaporthe grisea[J]. Journal of Henan Agricultural Sciences,2012,41(6):97-100.(in Chinese with English abstract)
[12] 曹青,房辉,何有才,等.稻瘟病菌孢子传播的影响因素与田间捕捉方法[J].信阳农业高等专科学校学报,2004,14(3):7-9. CAO Q,FANG H,HE Y C,et al.The influencing factors of Pyricularia oryzae Cavara spore distribution and spore trapping methods in fields[J].Journal of Xingyang Agricultural College,2004,14(3):7-9.(in Chinese with English abstract)
[13] 杜新法,孙漱沅,陶荣祥,等.稻区杂草上的梨孢菌与稻瘟病发生的关系[J].植物病理学报,1997,27(4):33-37. DU X F,SUN S Y,TAO R X,et al.Effects of weed-hosts of Pyricularia on incidence of rice blast disease[J].Acta Phytopathologica Sinica,1997,27(4):33-37.(in Chinese with English abstract)
[14] 沈瑛,袁筱萍,王艳丽.分子探针在稻瘟病流行病学中的应用研究[J].西南农业大学学报,1998,20(5):401 -408. SHEN Y,YUAN X P,WANG Y L.Molecular probes for epidemiological studies of the rice blast fungus[J].Journal of Southwest Agricultural University,1998,20(5):401-408. (in Chinese with English abstract)
(责任编辑 侯春晓)
Development of a qPCR detection method for monitoring conidial density of rice blast fungus in the air
XU Liao-yuan1,ZHAO Li-wen1,HU Yu-feng2,QIU Hai-ping3,CHAI Rong-yao3,ZHANG Zhen3,*
(1.Ningbo Plant Cultivation Management Station,Ningbo 315012,China;2.Ninghai Agricultural Technology Extension and Service Center,Ninghai 315600,China;3.Institute of Plant Protection and Microbiology,Zhejiang A-cademy of Agricultural Sciences,Hangzhou 310021,China)
Rice blast disease,caused by Magnaporthe oryzae,was one of the most devastating fungal diseases of rice.It was very important to monitor airborne conidial density of M.oryzae in fields for forecasting and control of blast disease.In present study,a qPCR detection method for conidia of M.oryzae was developed,based on M. oryzae MHP1 gene as the target sequence.Airborne conidia of M.oryzae in fields were trapped and quantified using this method.The results showed that airborne conidia population of M.oryzae was largely fluctuant,and indicated that the conidia release of M.oryzae was obviously affected by meteorological conditions during the monitoring periods.Generally,this qPCR method could be used to detect and quantified airborne conidia of rice blast fungus in fields.
rice blast;amount of conidia;spore trap;qPCR;meteorological factor
S435.121.4+5
A
1004-1524(2016)08-1368-06
10.3969/j.issn.1004-1524.2016.08.14
2016-04-11
国家公益性行业(农业)科研专项(201203014);浙江省公益技术研究农业项目(2014C32018)
许燎原(1972—),男,浙江宁波人,高级农艺师,主要从事植物保护等研究。E-mail:ddd0574@126.com
*
,张震,E-mail:zzhangcn@126.com
