羊肚菌菌丝体蛋白的理化特性及抗氧化活性
2016-08-18吴彩娥1南京林业大学轻工科学与工程学院江苏南京210037安徽科技学院生命科学学院安徽蚌埠233100
张 强,吴彩娥1,*(1.南京林业大学轻工科学与工程学院,江苏南京210037;2.安徽科技学院生命科学学院,安徽蚌埠233100)
羊肚菌菌丝体蛋白的理化特性及抗氧化活性
张 强1,2,吴彩娥1,*
(1.南京林业大学轻工科学与工程学院,江苏南京210037;2.安徽科技学院生命科学学院,安徽蚌埠233100)
为了探讨羊肚菌菌丝体蛋白在食品和保健品行业中应用的可能性,以液态发酵生产的羊肚菌菌丝体为原料,采用碱溶酸沉法提取菌丝体蛋白,对其理化特性和体外抗氧化活性进行了研究。结果表明,羊肚菌菌丝体蛋白具有良好的乳化性、乳化稳定性、起泡性与泡沫稳定性,其等电点为4.1,含有7种人体必需氨基酸,占氨基酸总含量的38.09%;羊肚菌菌丝体蛋白的总抗氧化能力和还原力的半抑制浓度(IC50)分别为(6.93±0.05)和(4.24±0.16)mg·mL-1,抗坏血酸(VC)当量分别为(11.74±0.48)和(10.15±0.48)mg· g-1,对DPPH自由基、超氧阴离子自由基、羟基自由基及ABTS自由基具有不同效果的清除活性。羊肚菌菌丝体蛋白可作为功能性食品和保健品开发的良好基料。
羊肚菌菌丝体;蛋白质;理化特性;抗氧化活性;氨基酸组成
羊肚菌(Morchella esculenta)名羊肚菜、羊肚蘑,隶属子囊菌亚门、盘菌纲、羊肚菌属,多生于潮湿阔叶林地上,表面呈羊肚状,味美,营养价值高,是一种珍贵的药食两用真菌[1]。羊肚菌富含多糖、蛋白质、氨基酸、不饱和脂肪酸、微量元素和维生素等多种对人体有益的活性物质,具有抗氧化、降血脂、增强人体免疫力、防癌抗癌、抗疲劳、抗病毒、抗辐射、抑制肿瘤生长等诸多功效[2-3]。随着液态深层发酵技术的快速发展,羊肚菌源功能性食品的开发已呈现出极为广阔的前景,但是目前相关的研究多集中于其粗提物或多糖组分上[4-6],对蛋白质组分的研究报道鲜见。
羊肚菌的粗蛋白含量在20%以上,氨基酸含量居所有食用菌之首,并含有顺-3-氨基-L-脯氨酸、2,4-二氨基异丁酸和α-氨基异丁酸等使羊肚菌具有独特风味的一些稀有氨基酸,是国际上公认的极好的蛋白质来源[7]。因此,本文以液态发酵生产的羊肚菌菌丝体为试验材料,利用碱溶酸沉法提取羊肚菌菌丝体蛋白,研究其理化特性及体外抗氧化活性,旨在为羊肚菌菌丝体蛋白在功能性食品及保健品方面的开发利用提供理论基础和试验依据。
1 材料与方法
1.1 试验材料
羊肚菌菌种GIM 5.69,由广东省微生物研究所菌种保藏中心提供;斜面培养基:马铃薯提取液20%、蔗糖2%、蛋白胨0.5%、KH2PO40.3%、MgSO4·7H2O 0.1%、琼脂1.8%;种子培养基:马铃薯提取液25%、蔗糖3%、KH2PO40.3%、Mg-SO4·7H2O 0.1%、蛋白胨0.5%;发酵培养基:葡萄糖 3.5%、酵母粉 0.5%、蛋白胨 0.5%、KH2PO40.3%,MgSO4·7H2O 0.1%;1,1-二苯基苦基苯肼(DPPH)、2,2'-连氮基-双-(3-乙基苯并二氢噻唑啉-6-磺酸)二铵盐(ABTS)购自Sigma公司;铁氰化钾、氯化亚铁、三氯乙酸、焦性没食子酸、水杨酸及四水合钼酸铵等试剂均为国产分析纯。
1.2 主要仪器设备
PP-15酸度仪(Sartorius公司);TU-1810紫外可见分光光度计(北京普析通仪器有限公司);5804R低温冷冻离心机(德国Eppendorf公司);FD-1A-50真空冷冻干燥机(北京博医康实验仪器有限公司);NICOLET 380红外光谱仪(美国赛默飞世尔科技公司);FUS-50L发酵罐(上海国强生化工程装备有限公司);日立8900全自动氨基酸分析仪(日立高新技术公司)。
1.3 试验方法
1.3.1 羊肚菌菌丝体的制备
将羊肚菌菌株接种于斜面培养基上,25℃恒温培养,待菌丝长满斜面后,将3块黄豆粒大小的斜面菌丝接种到装有50 mL种子培养基的250 mL三角瓶中,将三角瓶置于25℃摇床,180 r· min-1振荡培养7 d,得液体种子;液体种子用高速分散器打碎,按15%的接种量接种于50 L发酵罐中,转速180 r·min-1,25℃发酵培养7 d,发酵液用双层纱布过滤、蒸馏水洗涤,冷冻干燥得羊肚菌菌丝体。
1.3.2 羊肚菌菌丝体蛋白的提取
羊肚菌菌丝体经粉碎机粉碎,过80目筛,按料液比1∶35添加蒸馏水,用1 mol·L-1NaOH调pH值至12.0,50℃水浴浸提1 h,3 600 g离心10 min。上清液用1 mol·L-1HCl调pH值至4.0,3 600 g离心10 min。弃上清,沉淀装入7 ku的透析袋,用蒸馏水4℃透析,隔6 h换1次水,透析48 h,将透析袋中的溶液冷冻干燥,得羊肚菌菌丝体蛋白。
1.3.3 等电点的测定
配制9份10 mg·mL-1的羊肚菌菌丝体蛋白溶液,用0.1 mol·L-1的HCl或NaOH将其pH值分别调至3.0、3.5、3.7、3.9、4.0、4.1、4.3、4.5和5.0,室温下搅拌30 min,1 400 g离心15 min,沉淀不溶性蛋白,采用考马斯亮蓝(Bradford)法测定上清液中蛋白含量。上清液中蛋白质剩余率最低时对应的溶液pH值即为羊肚菌菌丝体蛋白的等电点。
蛋白质剩余率(%)=上清液中的蛋白质含量/溶液中蛋白质总量×100。
1.3.4 乳化性及其稳定性测定
参照薛蕾等[8]的方法。称取一定量的蛋白样品,用蒸馏水溶解制备成20 mL不同浓度、pH、温度和离子强度(以氯化钠质量浓度表示)梯度的分散系,移入至50 mL的刻度离心管中,使用高速分散器在12 000 r·min-1下均质2 min,然后加入10 mL大豆油,再用高速分散器在12 000 r· min-1下均质2 min,2 500 g离心5 min,测量离心管液体总高度和乳化层高度。将离心管置于60℃恒温水浴锅中放置30 min,用自来水冷却至室温,2 500 g离心5 min,取出离心管,测量乳化层高度。
乳化性(%)=乳化层高度(cm)/离心管液体总高度(cm)×100;
乳化稳定性(%)=离心后的乳化层高度(cm)/初始乳化层高度(cm)×100。
1.3.5 起泡性及其稳定性的测定
用蒸馏水把样品蛋白配制成不同浓度、pH、温度和离子强度(以氯化钠质量浓度表示)梯度的分散系,量取20 mL,移入至100 mL量筒中,用高速分散器10 000 r·min-1均质2 min,尽快记录泡沫体积;30 min之后再记录泡沫体积。试验重复3次,羊肚菌菌丝体蛋白的起泡性和泡沫稳定性按下式计算[9]:
起泡能力/%=均质停止时泡沫体积/均质前液体体积×100;
泡沫稳定性/%=30 min后泡沫体积/均质停止时泡沫体积×100。
1.3.6 红外光谱分析
将完全干燥的样品蛋白与干燥的溴化钾粉末混合,在玛瑙研钵中研磨均匀,置于模具中压片,用傅立叶变换红外光谱仪于400~4 000 cm-1进行扫描,观察最大吸收峰位置,获取样品相关基团的信息。
1.3.7 氨基酸组成分析
样品蛋白用6 mol·L-1HCl于110℃水解24 h,然后将水解液蒸干,加5 mL 0.02 mol·L-1HCl溶解,用氨基酸自动分析仪进行氨基酸组成的测定(测定1次)。
1.3.8 抗氧化活性测定
总抗氧化能力的测定采用磷钼酸铵比色法[10];还原力的测定采用普鲁士蓝法[11];清除DPPH自由基和ABTS自由基能力的测定采用直接比色法[12-13];清除超氧阴离子自由基能力的测定采用邻苯三酚自氧化法[14];清除羟基自由基能力的测定采用水杨酸比色法[15]。总抗氧化能力和还原力的测定中,吸光度值越大表明活性越强;对DPPH自由基、ABTS自由基、超氧阴离子自由基和羟基自由基的清除能力的测定中,清除率越大,表明活性越强。清除率按式(1)计算。

式中,R表示清除率;D0表示对照管的吸光度;D表示样品管的吸光度。
所有试验均以VC作阳性对照,根据试验结果计算样品和VC的IC50(总抗氧化能力和还原力为吸光度值为0.5时对应的样品浓度;其他为清除率50%时对应的样品浓度),并计算样品的VC当量(每克羊肚菌菌丝体蛋白相当于VC的毫克数,即 VC的 IC50除以羊肚菌菌丝体蛋白的IC50)。
1.3.9 数据处理
无特殊说明,试验平行测定3次,用Excel进行数据处理,用Origin Pro 8.5软件作图。
2 结果与分析
2.1 羊肚菌菌丝体蛋白的等电点
两性物质处于等点状态时,净电荷为零,在溶液中的溶解度最低,容易沉淀析出,所以,通过测定不同pH条件下离心上清液中的蛋白质剩余率可以判定蛋白质的等电点。由图1可知,当pH为3.0~5.0时,随着pH的增加,蛋白质剩余率先降低后升高,当pH为4.1时,蛋白质剩余率最低,所以羊肚菌菌丝体蛋白的等电点约为4.1。
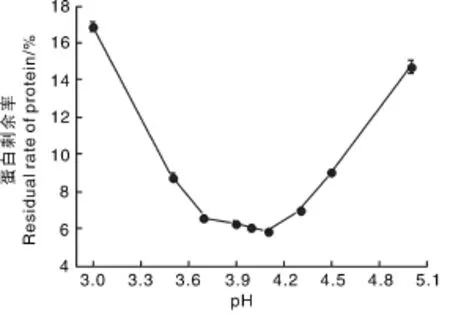
图1 羊肚菌菌丝体蛋白的等电点Fig.1 Isoelectric point of protein from Morchella esculenta mycelium
2.2 羊肚菌菌丝体蛋白的乳化性及乳化稳定性
乳化性是蛋白质促进油水混合,形成乳状液的能力,而乳化稳定性是指蛋白质乳化特性对外界条件的抗应变能力,两者都是食品加工过程中非常重要的质量控制指标[16]。羊肚菌菌丝体蛋白的乳化性及其稳定性与pH值、温度、NaCl浓度及蛋白质浓度的关系见图2。
从图2-A可以看出,羊肚菌菌丝体蛋白的乳化性及乳化稳定性随pH值的变化均呈V型曲线,在pH 4.0时,均达到最低,可能是由于在等电点附近时,静电斥力缺乏,故乳化性及乳化稳定性较低。pH小于或大于4.0时,蛋白质分子带有静电荷,分子间由于相互排斥而分散开,导致乳化性及乳化稳定性增大。
由图2-B可知,在20~40℃,羊肚菌菌丝体蛋白的乳化性及其稳定性随温度的上升而增加,40℃时,达到最大值,之后温度升高乳化性及其稳定性下降。可能的原因是适度的热处理会使蛋白分子的伸展程度增大,更加容易吸附在油水界面上,从而使乳化性及其稳定性增加,但温度继续升高,乳化颗粒的运动加剧,蛋白质凝胶作用降低,蛋白质膜黏度和硬度降低,使乳化性及其乳化稳定性下降。
图2-C表明,随着NaCl浓度的不断增大,羊肚菌菌丝体蛋白的乳化性和乳化稳定性均呈现先升后降的趋势。原因在于,低NaCl浓度作用下,由于盐溶作用,蛋白质分子的溶解度增大,表面电荷数量增多,阻止了油滴的相互靠近,表现为乳化性提高,但当NaCl浓度过高时,由于盐析作用,破坏了维持蛋白质胶体稳定的2个因素——净电荷和水化膜,表现为乳化能力下降。
从图2-D可知,随着羊肚菌菌丝体蛋白浓度的增加,乳化性及乳化稳定性呈现增大趋势,当质量浓度达到2%时,乳化性增幅趋于平缓。这可能是因为随着蛋白质浓度增大,界面膜的厚度和强度增加,乳化性能得到提高;当浓度增大到一定数值时,参与界面作用的蛋白质趋于饱和状态,乳化能力不再提高。

图2 羊肚菌菌丝体蛋白的乳化性及乳化稳定性Fig.2 Emulsifying ability and stability of protein from Morchella esculenta mycelium
2.3 羊肚菌菌丝体蛋白的起泡性及泡沫稳定性
起泡性是由于蛋白质能够降低气—液界面的张力来推动空气与液体相结合所致,并通过吸附在气液界面形成保护膜来使泡沫稳定存在;泡沫稳定性是指泡沫形成后的维持能力,即泡沫间液膜保持液体不被析出的能力。利用蛋白的起泡性和泡沫稳定性可以赋予食品以疏松的结构和良好的口感,用于加工奶油、蛋糕、冰激凌等泡沫型产品[17]。羊肚菌菌丝体蛋白的起泡性及泡沫稳定性与pH值、温度、NaCl浓度及蛋白质浓度的关系见图3。
从图3-A可知,pH为4.0时,羊肚菌菌丝体蛋白质的起泡性及泡沫稳定性均最差,原因是pH 4.0处于羊肚菌菌丝体蛋白等电点附近,此时参与形成泡沫的蛋白质浓度最低,其泡沫量最少,稳定性最差,随着pH的升高,蛋白质的溶解性增大,起泡能力增强,但过高的pH可能会影响到蛋白质分子表面基团的解离,从而导致泡沫稳定性降低。

图3 羊肚菌菌丝体蛋白的起泡性及泡沫稳定性Fig.3 Foaming ability and foam stability of protein from Morchella esculenta mycelium
由图3-B可以得出,随着温度的提高,羊肚菌菌丝体蛋白的起泡性明显增强,而稳定性则下降。可能是温度升高使得蛋白质分子的结构发生部分解聚,从而提高了蛋白质的起泡性。但温度升高也导致决定泡沫稳定性的蛋白质分子间的相互作用力,如范德华力、氢键以及疏水作用力等变弱,从而使泡沫稳定性下降。
图3-C表明,NaCl质量浓度对蛋白质的起泡性有明显的影响,NaCl浓度为0.2~0.8 mol·L-1时,随着NaCl质量浓度的提高,羊肚菌菌丝体蛋白的起泡性及泡沫稳定性均上升,这可能是由于NaCl的加入使蛋白质的溶解度、黏度、展开和聚集等向有益于提高蛋白起泡性和泡沫稳定性的方向改变,而当NaCl浓度超过0.8 mol·L-1时,羊肚菌菌丝体蛋白的起泡性及泡沫稳定性均呈现下降的趋势,这可能是因为NaCl质量浓度过高,出现盐析现象,降低了羊肚菌菌丝体蛋白的溶解性,从而使起泡性及泡沫稳定性降低。
图3-D可以看出,随着蛋白质浓度的升高,其起泡性及泡沫稳定性都呈上升的趋势。这是由于蛋白质的起泡性受蛋白质分子表面张力的影响,而在一定范围内,蛋白质表面张力随着蛋白质浓度的上升而降低,从而使蛋白质起泡性以及泡沫稳定性上升。
2.4 羊肚菌菌丝体蛋白的红外光谱
羊肚菌菌丝体蛋白的红外光谱见图4。羊肚菌菌丝体蛋白的酰胺A出现在3 419 cm-1处,该峰的出现与蛋白质羟基及N—H的伸缩振动有关,也表明了氢键的存在。Doyle等[18]的研究表明,自由的N—H伸缩振动一般在3 400~3 440 cm-1处,当肽键中的N—H基团包含在氢键中时,其振动的波数会下降。酰胺B出现于2 925 cm-1处,这是蛋白质中常出现的波数,同 Kittiphattanabawon[19]的研究结果一致。羊肚菌菌丝体蛋白的酰胺Ⅰ出现在1 649 cm-1处,表示了C=O的伸缩振动,该条带和蛋白质的二级结构有关;酰胺Ⅱ出现在1 540 cm-1处,这是由N—H的弯曲振动和C—N的伸缩振动引起的;酰胺Ⅲ在1 240 cm-1处,来自C—H伸缩振动和N—H的弯曲振动,该波数同1 454 cm-1的比值接近1,表明了3股螺旋结构的存在[20]。
2.5 羊肚菌菌丝体蛋白的氨基酸组成

图4 羊肚菌菌丝体蛋白的红外光谱Fig.4 Infrared spectra of protein from Morchella esculenta mycelium
羊肚菌菌丝体蛋白的氨基酸组成如表1所示。羊肚菌菌丝体蛋白经酸法水解共检测到17种氨基酸,其中甘氨酸、谷氨酸和天冬氨酸含量最为丰富,摩尔分数分别为10.77%、10.23%和 9.22%;含有7种人体必需的氨基酸(Thr、Val、Met、Ile、Leu、Phe、Lys),占羊肚菌菌丝体蛋白氨基酸总含量的38.09%,必需氨基酸与非必需氨基酸含量的比值为0.68,分别与FAO/WHO标准规定的40%和0.6相接近,可认为是1种优质的蛋白质来源。
2.6 羊肚菌菌丝体蛋白的抗氧化活性
羊肚菌菌丝体蛋白的抗氧化活性如表2所示。羊肚菌菌丝体蛋白具有较好的总抗氧化能力和还原力,IC50分别为(6.93±0.05)和(4.24± 0.16)mg·mL-1,VC当量分别为(11.74±0.48)和(10.15±0.48)mg·g-1;对DPPH自由基、超氧阴离子自由基、羟基自由基及ABTS自由基具有不同效果的清除活性,从VC当量来看,羊肚菌菌丝体蛋白对羟基自由基的清除能力最强,对各种自由基清除能力依次为羟基自由基>ABTS自由基>超氧阴离子自由基>DPPH自由基。羊肚菌菌丝体蛋白对DPPH自由基的清除能力优于麦胚蛋白(2.0 mg·mL-1,清除率23.27%)[21],对羟基自由基的清除能力与黄芪蛋白(5 mg·mL-1,清除率66%)[22]相当,对超氧阴离子自由基的清除能力优于菜籽清蛋白 (IC5033.36 mg· mL-1)[23]。羊肚菌菌丝体蛋白的抗氧化能力虽然远不及VC,但是它属于天然产物,与合成的抗氧化剂相比,使用起来更加安全。而且,通过酶切、自由基降解等适当的理化修饰处理,其抗氧化能力有望大幅度提高。

表1 羊肚菌菌丝体蛋白的氨基酸组成Table 1 Amino acid composition of protein from Morchella esculenta mycelium

表2 羊肚菌菌丝体蛋白的抗氧化活性Table 2 Antioxidant activities of protein from Morchella esculenta mycelium
3 结论
羊肚菌菌丝体蛋白具有较好的乳化性、乳化稳定性、起泡性与泡沫稳定性,其等电点为4.1,通过调节pH值、温度、NaCl质量浓度及蛋白浓度等因素,可以明显改善羊肚菌菌丝体蛋白的各项功能特性。同时,羊肚菌菌丝体蛋白氨基酸组成合理,必需氨基酸占氨基酸总量的38.09%,必需氨基酸与非必需氨基酸含量的比值为0.68,具有很高的营养价值。此外,羊肚菌菌丝体蛋白具有较好的总抗氧化能力和还原能力,对DPPH自由基、超氧阴离子自由基、羟基自由基及ABTS自由基具有不同效果的清除活性。因此,羊肚菌菌丝体蛋白在功能性食品和保健品开发方面具有很大的潜力,值得进一步研究。
(References):
[1] 李娟.泰山羊肚菌液体培养条件优化及富铁,锌,硒研究初探[D].泰安:山东农业大学,2005. LI J.Studies on the submerged fermentation conditions of Morchella esculenta and its bioaccumulation of ferrum,zinc,selenium[D].Tai'an:Shandong Agricultural University,2005.(in Chinese with English abstract)
[2] HELENO S A,STOJKOVI C′D,BARROS L,et al.A comparative study of chemical composition,antioxidant and antimicrobial properties of Morchella esculenta(L.)Pers.from Portugal and Serbia[J].Food Research International,2013,51 (1):236-243.
[3] MENG F,ZHOU B,LIN R,et al.Extraction optimization and in vivo antioxidant activities of exopolysaccharide by Morchella esculenta SO-01[J].Bioresource Technology,2010,101(12):4564-4569.
[4] NITHA B,FIJESH P V,JANARDHANAN K K.Hepatoprotective activity of cultured mycelium of Morel mushroom,Morchella esculenta[J].Experimental and Toxicologic Pathology,2013,65(1):105-112.
[5] MENG F,LIU X,JIA L,et al.Optimization for the production of exopolysaccharides from Morchella esculenta SO-02 in submerged culture and its antioxidant activities in vitro[J]. Carbohydrate Polymers,2010,79(3):700-704.
[6] NITHA B,JANARDHANAN K K.Aqueous-ethanolic extract of morel mushroom mycelium Morchella esculenta,protects cisplatin and gentamicin induced nephrotoxicity in mice[J]. Food and Chemical Toxicology,2008,46(9):3193-3199.
[7] 付天宇.基于深层发酵的羊肚菌功能性食品研究[D].长春:吉林大学,2013. FU T Y.Study of Morchella esculenta functional food based on the submerged fermentation[D].Changchun:Jilin University,2013.(in Chinese with English abstract)
[8] 薛蕾,李大文,尉芹,等.苦杏仁蛋白的功能特性[J].食品科学,2013,34(7):70-75. XUE L,LI D W,WEI Q,et al.Functional properties of bitter almond protein[J].Food Science,2013,34(7):70-75. (in Chinese with English abstract)
[9] LIU Y,ZHAO G,ZHAO M,et al.Improvement of functional properties of peanut protein isolate by conjugation with dextran through Maillard reaction[J].Food Chemistry,2012,131 (3):901-906.
[10] UMAYAPARVATHI S,MEENAKSHI S,VIMALRAJ V,et al.Antioxidant activity and anticancer effect of bioactive peptide from enzymatic hydrolysate of oyster(Saccostrea cucullata)[J].Biomedicine&Preventive Nutrition,2014,4(3):343-353.
[11] DUAN X,OCEN D,WU F,et al.Purification and characterization of a natural antioxidant peptide from fertilized eggs [J].Food Research International,2014,56(2):18-24.
[12] WANG Q,LI W,HE Y,et al.Novel antioxidative peptides from the protein hydrolysate of oysters(Crassostrea talienwhanensis)[J].Food Chemistry,2014,145(2):991 -996.
[13] HONG J,CHEN T T,Hu P,et al.Purification and characterization of an antioxidant peptide(GSQ)from Chinese leek (Allium tuberosum Rottler)seeds[J].Journal of Functional Foods,2014,10(9):144-153.
[14] LIU D,SHENG J,LI Z,et al.Antioxidant activity of polysaccharide fractions extracted from Athyrium multidentatum (Doll.)Ching[J].International Journal of Biological Macromolecules,2013,56(5):1-5.
[15] ZHUANG H,TANG N,YUAN Y.Purification and identification of antioxidant peptides from corn gluten meal[J]. Journal of Functional Foods,2013,5(4):1810-1821.
[16] DEL MAR YUST M,PEDROCHE J,DEL CARMEN MILLÁNLINARES M,et al.Improvement of functional properties of chickpea proteins by hydrolysis with immobilised Alcalase[J]. Food Chemistry,2010,122(4):1212-1217.
[17] 庞雪风,何东平,胡传荣,等.牡丹籽蛋白功能特性的研究[J].中国粮油学报,2014,29(7):45-48. PANG X F,HE D P,HU C R,et al.Functional characteristics of peony seed protein[J].Joumal of the Chinese Cereals and Oils Association,2014,29(7):45-48.(in Chinese with English abstract)
[18] DOYLE B B,BENDIT E G,BLOUT E R.Infrared spectroscopy of collagen and collagen-like polypeptides[J].Biopolymers,1975,14(5):937-957.
[19] KITTIPHATTANABAWON P,BENJAKUL S,VISESSANGUAN W,et al.Isolation and characterisation of collagen from the skin of brownbanded bamboo shark(Chiloscyllium punctatum)[J].Food Chemistry,2010,119(4):1519 -1526.
[20] GUZZI PLIPIS A M D,GOISSIS G,DAS-GUPTA D K.Dielectric and pyroelectric characterization of anionic and native collagen[J].Polymer Engineering&Science,1996,36 (24):2932-2938.
[21] 孙婕,尹国友,刘文霞,等.小麦麦胚蛋白提取工艺及抗氧化活性初探[J].粮食与饲料工业,2014(3):26-29. SUN J,YIN G Y,LIU W X,et al.Extraction process and antioxidant activity of wheat germ protein[J].Cereal&Feed Industry,2014(3):26-29.(in Chinese with English abstract)
[22] 李敏,闫帅,薛慧清,等.黄芪蛋白组分的抗氧化性测定[J].世界中西医结合杂志,2015,10(5):642-644. LI M,YAN S,XUE H Q,et al.Measurement of the oxidation resistance in the protein components of Astragalus membranaceus[J].World Journal of Integrated Traditional and Western Medicine,2015,10(5):642-644.(in Chinese with English abstract)
[23] 赵蓓,李欣蓉,魏瑞芝,等.超声辅助提取对菜籽清蛋白抗氧化活性的影响[J].食品科技,2015(8):235-239. ZHAO B,LI X R,WEI R Z,et al.Effect on the antioxidant activity of rapeseed albumin of ultrasonic-assisted extraction [J].Food Science and Technology,2015(8):235-239. (in Chinese with English abstract)
(责任编辑 侯春晓)
Physicochemical properties and antioxidant activities of protein from Morchella esculenta mycelium
ZHANG Qiang1,2WU Cai-e1,*
(1.College of Light Industry Science and Engineering,Nanjing Forestry University,Nanjing 210037,China;2.College of Life Science,Anhui Science and Technology University,Bengbu 233100,China)
In this study,Morchella esculenta protein was extracted by alkaline dissosution and acid precipitation from Morchella esculenta mycelium obtained by liquid-state fermentation,and its physicochemical properties and in vitro antioxidant activity were investigated in order to explore the application possibility in food and health care products industry.The results showed that the protein had an isoelectric point of 4.1,contained 7 kinds of essential amino acids,which accounted for 38.09%of the total amino acids,exhibited excellent emulsifying ability and stability as well as admirable foaming ability and stability.The protein showed good performance of the total antioxidant activity,with IC50value of(6.93±0.05)mg·mL-1and VCequivalent of(11.74±0.48)mg·g-1,and also the reducing power,with IC50value of(4.24±0.16)mg·mL-1and VC equivalent of(10.15±0.48)mg·g-1.Furthermore,the protein exhibited different scavenging effects on DPPH,superoxide,hydroxyl and ABTS radicals.It was concluded that the protein could be served as an excellent material for the development of functional foods and health care products.
Morchella esculenta mycelium;protein;physicochemical properties;antioxidant activities;amino acid composition
TS202.1
A
1004-1524(2016)08-1408-08
10.3969/j.issn.1004-1524.2016.08.20
2015-11-26
江苏省普通高校研究生科研创新计划项目(KYLX15_0916);南京林业大学优秀博士学位论文创新基金项目;安徽科技学院重点学科项目(AKZDXK2015B02)
张强(1979—),男,辽宁锦州人,博士,副教授,从事天然产物开发与利用方面的研究。E-mail:zq7964@163.com
*
,吴彩娥,E-mail:sxwucaie@163.com
