新生隐球菌通过S100A10活化尿激酶-纤溶酶系统侵袭血脑屏障的机制研究
2016-08-16邱天文朱红梅温海
邱天文 朱红梅 温海
(上海市长征医院皮肤科 上海市医学真菌分子生物学重点实验室,上海 200003)
·论著·
新生隐球菌通过S100A10活化尿激酶-纤溶酶系统侵袭血脑屏障的机制研究
邱天文朱红梅温海
(上海市长征医院皮肤科 上海市医学真菌分子生物学重点实验室,上海 200003)
目的验证隐球菌可以上调脑微血管内皮细胞S100A10基因来活化尿激酶-纤溶酶系统,从而更易穿过血脑屏障。方法①将小鼠脑微血管内皮细胞bEnd.3和新生隐球菌B3501共孵育,检测加菌的实验组和不加菌对照组S100A10、UPA基因和蛋白的表达量。②用慢病毒感染血管内皮细胞,比较S100A10基因正常组和沉默组的S100A10和UPA基因和蛋白的表达量。③构建Transwell血脑屏障模型,比较S100A10基因正常组和沉默组隐球菌通过的差异性,用底物显色法检测尿激酶-纤溶酶系统的相关活化情况。结果①新生隐球菌B3501和bEnd.3共孵育,Real-time PCR显示S100A10和UPA的mRNA高表达;Western-blot显示S100A10目的蛋白和UPA蛋白高表达。②沉默S100A10基因后,S100A10和UPA基因及蛋白表达分别受到抑制。③隐球菌添加到Transwell体外血脑屏障模型中,S100A10基因未沉默组通过血脑屏障的隐球菌数量比S100A10基因沉默组多,尤其是8 h、16 h、24 h,两组差异有统计学意义,P<0.05;未沉默S100A10基因的对照组的纤溶酶原和尿激酶的活化程度高于沉默S100A10基因的实验组,其中纤溶酶原在8 h、16 h、24 h,尿激酶在16 h、24 h,两组差异有统计学意义,P<0.05。结论隐球菌能同时使内皮细胞S100A10基因、UPA基因的高表达,活化尿激酶-纤溶酶系统,提高其通过血脑屏障的能力。
隐球菌;S100A10;尿激酶;纤溶酶;血脑屏障
[Chin J Mycol,2016,11(3):129-134]
隐球菌是一种环境腐生菌,也是一种机会致病菌,常引起免疫功能低下人群的感染,如艾滋病、组织器官移植、血液肿瘤等[1]。在西北太平洋地区曾有隐球菌病暴发流行的报道[2-3]。近年来,有关格特隐球菌引起的正常人群的感染已逐渐引起科学家的重视[4-5]。在南非等艾滋病高发的发展中国家,隐球菌病的发病率呈逐年上升的趋势,已经成为一种严重危害人类健康的疾病[6]。目前隐球菌病的病死率仍然较高,一旦发生隐球菌性脑膜炎/脑膜脑炎 (CME),其病死率高达40%[7],因此,隐球菌病严重危害着人类的健康,如何有效防治中枢神经系统隐球菌的感染,是我们目前急需解决的问题。隐球菌侵袭中枢系统需要跨越我们重要的屏障血脑屏障。脑微血管内皮细胞是血脑屏障最重要的细胞。前期研究表明隐球菌和小鼠脑微血管内皮细胞共孵育能够上调血管内皮细胞S100A10基因的mRNA表达[8],为进一步研究隐球菌侵袭中枢系统机制,我们将新生隐球菌B3501与小鼠脑微血管内皮细胞共孵育,研究小鼠内皮细胞S100A10基因在mRNA和蛋白水平上的表达变化以及通过构建Transwell对照和实验组模型,分析敲除S100A10基因后隐球菌的通过率、纤溶酶、尿激酶等的变化。
1 材料与方法
1.1材料
菌株新生隐球菌B3501 (血清D型):上海市医学真菌分子生物学实验室。
细胞与细胞培养基bend.3细胞系 (小鼠脑微血管内皮细胞)购自ATCC美国模式菌收集中心。DMEM高糖型培养基 (GIBCO,11965-092)、胎牛血清均购自Thermo fisher公司。
分子生物试剂Trizol (TaKara公司),引物合成与测序 (上海生工),反转CDNA试剂盒 (全式金公司),Real-Time PCR试剂盒 (全式金公司),BCA蛋白检测试剂盒、细胞裂解液 (beyotime公司),S100A10蛋白小鼠来源一抗、兔抗鼠二抗 (Cell Signaling Technology公司),UPA蛋白小鼠来源一抗、羊抗鼠二抗 (abcam公司),β-actin蛋白兔来源一抗、羊抗兔二抗 (北京庄盟公司),Western预染标准品 (invitrogen公司),慢病毒试剂盒 (上海吉凯基因公司),Transwell 6孔板 (Corning公司),跨膜电阻仪TEER (美国Millipore公司)。
主要仪器PCR仪、Real-Time PCR仪、Western电泳和转膜仪 (BIO-RAD公司),酶标仪 (Bio-Gene Technology公司)。
1.2方法
与新生隐球菌共孵育后,内皮细胞S100A10与UPA mRNA、蛋白的变化摇菌将新生隐球菌B3501菌株接种入20 mL YEPD培养基中,30℃条件下摇床过夜培养20 h。再使用离心机收集菌体,离心速度为3 000 r/min,5 min,弃上清。使用PBS溶液重悬沉淀,再3 000 r/min,5 min重复离心,弃上清,DMEM培养基重悬沉淀,使之成为B3501菌悬液,用计数器将菌悬液密度调整至1×108个/mL,4℃保存待用。
细胞培养和接种取处于对数生长期的小鼠脑微血管内皮细胞系用PBS洗两遍,0.25%胰蛋白酶消化2~3 min,培养基加入终止消化,900 r/min 4 min离心,弃上清,加入适量新培养基制备bEnd.3细胞悬液。分别接种于两批6孔培养板中,每孔细胞为5×105个,37℃、5%CO2的培养箱中培养。24 h后吸去培养基,PBS洗两遍,每孔加入2 mL含有10%FBS的DMEM培养基。其中实验组加入已制备的新生隐球菌悬液100 μL,放回培养箱。空白对照组不加菌。
样本收集新生隐球菌B3501野生株与bEnd.3细胞共培养,分别孵育0、2、4、8、16、24 h后终止共培养。吸走6孔培养板中的细胞培养基,用已过滤的PBS清洗两遍。
Trizol法抽提细胞总RNA清洗后的6孔板,每孔加入0.5 mL 4℃预冷的Trizol后,用移液枪吹打培养板底部1 min,充分使细胞游离和裂解,收集培养皿底部的细胞;吸入混合液到新的DEPC水处理的1.5 mL离心管中,室温放置5 min;而后加入100 μL的氯仿,并且用漩涡混合仪混匀离心管中的标本15 s,室温静置5 min,12 000 r/min、4℃离心15 min。将最上层的上清液再次转移到新的DEPC水处理的1.5 mL离心管中,加入250 μL异丙醇,用漩涡混合仪混匀后,-20℃静置30 min,12 000 r/min、4℃离心15 min。离心管弃上清,配置一定量的DEPC水配制的75%的乙醇溶液,每个离心管加入1 mL,漩涡混合仪振荡1 min,12 000 r/min、4℃离心10 min。用1 mL和100 μL的枪头分别吸出上清,不要碰到沉淀,通风橱中晾干约10 min,用10 μL DEPC水溶解沉淀的RNA,80℃冰箱里保存。
逆转录合成CDNA反应体系20 μL,2×TS Reaction Mix 10 μL,TransScript RT/RI Enzyme Mix 1 μL,gDNA Remover 1 μL,Anchored Oigo (dT) 18Primer 1 μL,Total RNA/mRNA 800 ng,Nase-free Water若干。将各个孔的20 μL反应体系混匀后置于PCR仪,42℃ 30 min,再85℃ 5 s加热失活TransScript RT/RI和gDNA Remover,即合成cDNA。
Real-time PCR检测内皮细胞S100A10和UPA基因扩增体系和反应条件:扩增体系20 μL体系,采用GPADH作为内参,PCR引物由上海bio-tnt生物公司合成 (见表1)。反应条件:2×TransStart Top Green Qpcr SuperMix 10 μL,内参和目的基因引物各2 μL,cDNA模板1 μL,加去离子水至20 L。步骤:①94℃ 30 s,②94℃ 5 s,③60℃ 30 s (步骤②-③重复扩增40个循环),④溶解曲线分析,表达水平以2-ΔΔct表示。

表1 Realtime Quantitative PCR所采用的引物
Western Blot法检测用碧云天细胞裂解液收集6孔板培养皿中的细胞,抽提蛋白。按照BCA蛋白浓度检测法,进行蛋白定量分析,调整浓度,100℃煮沸。每个样品取20 μL进行SDS-聚丙烯酰胺凝胶电泳,之后电转移。10%脱脂牛奶封闭1 h后,S100A10一抗抗体和内参GAPDH一抗抗体4℃孵育过夜,第2天TBST洗膜3遍,二抗室温孵育1 h,TBST洗3遍,每遍15 min,ECL显色,最后成像。
内皮细胞S100A10基因沉默后S100A10与UPA mRNA、蛋白的变化慢病毒试剂盒由上海吉凯基因公司构建后,浓度为3×105个/μL。Lenti-S100A10-GFP慢病毒以MOI值为20 (前期实验已验证)感染小鼠血管内皮细胞,12 h后换培养基,感染2 d后荧光显微镜下观察,若发出绿色荧光,说明感染有效。
验证慢病毒有效后,设立实验组和对照组,用慢病毒去感染实验组的内皮细胞,成功感染72 h后,用Real-time PCR和Western Blot法分别检测实验组 (S100A10基因沉默组)与对照组 (未加慢病毒的S100A10基因正常组)的S100A10及UPA的mRNA和目的蛋白水平。
构建S100A10基因沉默组与正常组Transwell模型,比较隐球菌通过数量及纤溶酶和尿激酶活化量慢病毒感染后的小鼠血管内皮细胞为实验组,未感染的小鼠血管内皮细胞作对照组,接种细胞于6孔Transwell板中后,按每孔5×105个细胞接种在小室内,小室下方加2.5 μL完全培养基,小室内加1.5 μL培养基。37℃、5%CO2培养,2 d后,用跨膜电阻仪 (TEER)测电阻,检测细胞生长的情况,达到标准值>80 Ω后,每个上室加入包被纤溶酶原新生隐球菌B3501 1×107个,按照时间点0、2、4、8、16、24 h分别取小室嵌套膜下层的细胞培养液300 μL,其中100 μL稀释10倍后涂板,用于比较通过Transwell模型的隐球菌数量,其余200 μL用于底物显色法检测尿激酶和纤溶酶。
1.3统计分析
2 结 果
2.1与新生隐球菌共孵育后,内皮细胞S100A10与UPA mRNA、蛋白的变化
新生隐球菌B3501野生株与bEnd.3细胞共孵育0、2、4、8、16、24 h后,实验组内皮细胞S100A10的mRNA水平明显升高 (见图1),不加隐球菌的对照组S100A10的mRNA水平变化不明显,在2 h、16 h、24 h,两组比较差异有统计学意义,P<0.05;实验组UPA的mRNA水平先下降后升高 (见图2),对照组UPA的mRNA水平变化不明显,在16 h、24 h,两组比较P<0.05。

图1新生隐球菌和bEnd.3细胞共孵育0 h、2 h、4 h、8 h、16 h、24 h后S100A10基因的表达情况:Real-time PCR方法检测S100A10基因mRNA相对表达量 (与对照组相比,*.P<0.05,**.P<0.01)图2新生隐球菌和bEnd.3细胞共孵育0 h、2 h、4 h、8 h、16 h、24 h后UPA基因的表达情况:Real-time PCR方法检测UPA基因mRNA相对表达量 (与对照组相比,*.P<0.05,**.P<0.01)
Fig.1Results of gene expression of S100A10 after neoformans and bEnd.3 cells were incubated 0 h,2 h,4 h,8 h,16 h,24 h.Results of gReal Time Quantitative PCR method to detect gene mRNA relative expression of S100A10Fig.2Results of gene expression of UPA after neoformans and bEnd.3 cells were incubated on 0 h,2 h,4 h,8 h,16 h,24 h.Results of Real Time PCR method to detect gene mRNA relative expression of UPA
Western-Blot法检测S100A10目的蛋白在实验组24 h时显著增加 (见图3a),实验组24 h与对照组0 h灰度值比 (见图3b)相比,P<0.05。UPA目的蛋白在24 h显著增加 (见图4a),实验组8 h、16 h、24 h与对照组0 h灰度值比 (见图4b)相比,P<0.05。
2.2内皮细胞S100A10基因沉默后S100A10与UPA mRNA、蛋白的变化
构建Lenti-S100A10-GFP慢病毒载体,进而感染bEnd.3小鼠微血管内皮细胞,MOI为20,可在荧光显微镜下高倍视野下观察到近乎满视野绿色荧光 (见图5a),且细胞状态良好。同时用Real-time PCR和Western Blot的方法检测发现基因沉默组S100A10和UPA基因的mRNA相对表达量 (见图5b,c)和目的蛋白 (见图5d,e),与S100A10基因正常的对照组比较,都呈低表达状态,P<0.05。
2.3构建S100A10基因沉默组与正常组Transwell模型,比较隐球菌通过数量及纤溶酶和尿激酶活化量
隐球菌添加到Transwell体外血脑屏障模型中,S100A10基因未沉默组通过血脑屏障的隐球菌数量比S100A10基因沉默组多,尤其是8 h、16 h、24 h,两组差异有统计学意义,P<0.05 (见图6a);未沉默S100A10基因的对照组的纤溶酶原和尿激酶的活化程度高于的沉默S100A10基因的实验组,其中纤溶酶原在8 h、16 h、24 h (见图6b),尿激酶在16 h、24 h (见图6c),两组差异有统计学意义,P<0.05。
3 讨 论
隐球菌的特殊之处在于,除了侵犯肺部、皮肤、骨骼等系统外,该菌具有明显的嗜中枢性[9-11],说明该菌具备一些穿越血脑屏障的能力和途径。目前学者们公认隐球菌侵袭血脑屏障的机制主要有“跨内皮细胞途径”“特洛伊木马”机制 (通过单核巨噬细胞吞噬)以及“细胞旁途径”。本文研究证实的隐球菌利用S100A10通过尿激酶-纤溶酶系统侵袭血脑屏障的机制属于“细胞旁路途径”中的一种。国外曾有研究发现,新生隐球菌荚膜上包裹着纤溶酶原和小鼠脑微血管内皮细胞共同孵育,不需要tPA的情况下,隐球菌荚膜的外表面还是可以检测到激活的纤溶酶,且隐球菌侵袭体外血脑屏障Transwell模型的能力大大增强[12]。进一步研究,使用尿激酶的特异性抑制剂的方法,发现纤溶酶原被激活的量就大大的减少,且实验中新型隐球菌的侵袭能力也有明显的下降[13]。Stie[13]的研究成果表明,隐球菌会使内皮细胞UPA高表达,进而激活纤溶酶原,侵袭血脑屏障。而对于S100A10基因的作用,Jung等[14]证明S100A10是作为一个调节丝状肌动蛋白网络起作用。有研究发现沉默S100A10基因后,小鼠脑微血管内皮细胞吞噬新生隐球菌的能力受损,以及被吞噬后的隐球菌在细胞内的发芽率大大下降[15]。表明S100A10能促进进入小鼠内皮细胞后的菌的生长。有研究发现S100A10蛋白可以调节细胞膜上的钙离子通道蛋白TRPV5/6[16]。还有研究指出,由于脑微血管内皮细胞靠的是紧密连接而缺少胞饮的囊泡[17],在隐球菌侵袭过程中,隐球菌需要通过内皮细胞内的丝状肌动蛋白的激活,然后才能以细胞内吞的形式进入细胞,完成跨细胞机制的第一步。因此结合以上的研究结果,推测S100A10蛋白很有可能在隐球菌通过跨细胞途径进入内皮细胞,进而侵犯血脑屏障时,可以通过调节细胞内的纤维丝状肌动蛋白的运动,使隐球菌进入血管内皮细胞。
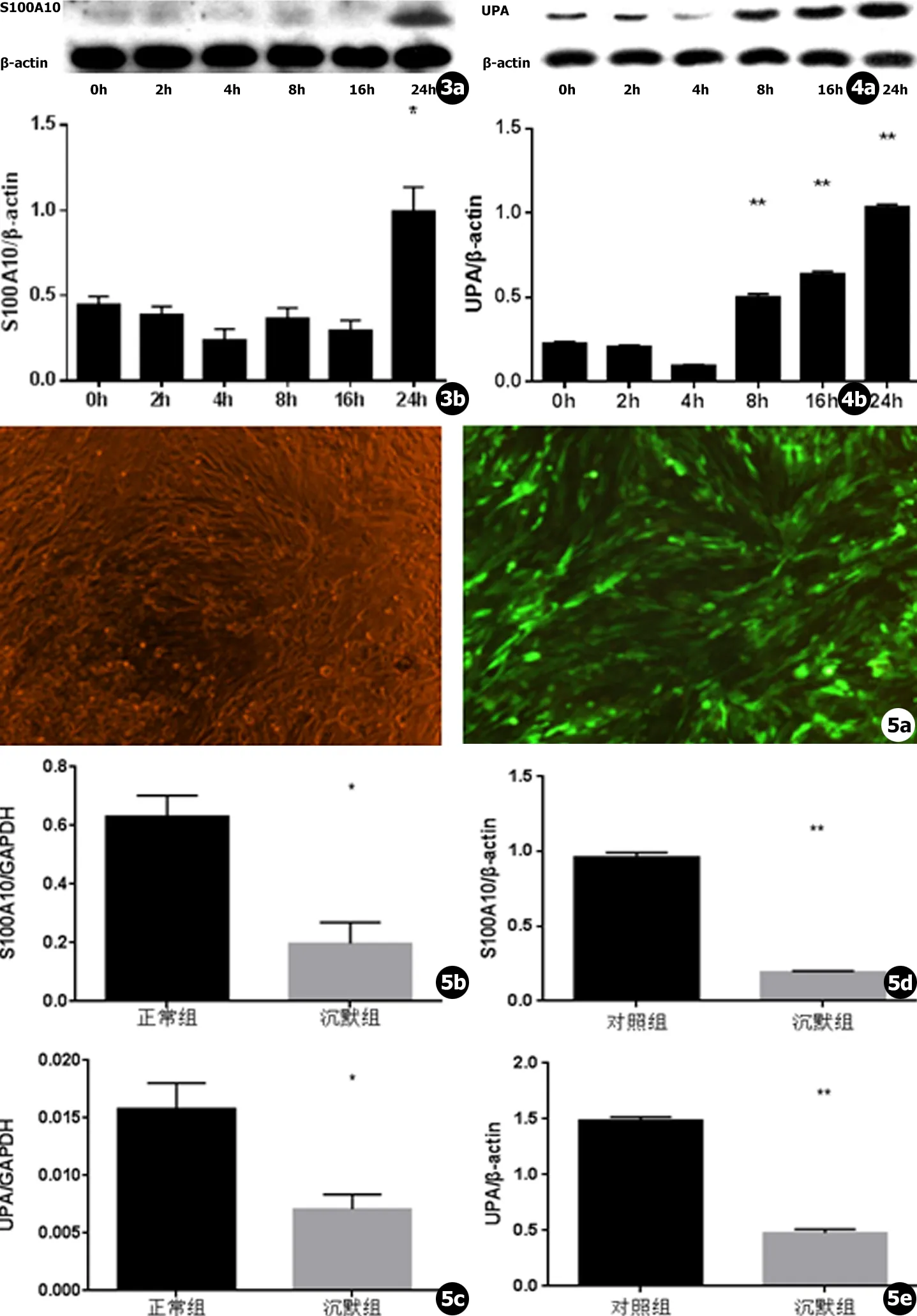
图3新生隐球菌和bEnd.3细胞共孵育0 h、2 h、4 h、8 h、16 h、24 h后S100A10基因的表达情况:a.Western-Blot法检测S100A10目的蛋白表达情况,b.Western-Blot灰度比值,24 h组实验组与0 h对照组相比P<0.05 (与对照组相比,*.P<0.05,**.P<0.01)图4新生隐球菌和bEnd.3细胞共孵育0 h、2 h、4 h、8 h、16 h、24 h后UPA基因的表达情况:a.Western-Blot法检测UPA目的蛋白表达情况,b.Western-blot灰度比值,8 h、16 h、24 h实验组与0 h对照组相比,P<0.05 (与对照组相比,*.P<0.05,**.P<0.01)图5慢病毒感染bEnd.3后免疫荧光显微镜下的感染状况,以及S100A10和UPA基因的表达情况 (与对照组相比,*.P<0.05,**.P<0.01):a.高倍 (100×)光镜下明场视野Lenti-S100A10-GFP感染后bEnd.3细胞 (左),高倍 (100×)免疫荧光Lenti-S100A10-GFP感染后bEnd.3细胞 (右);b.方法检测S100A10基因沉默后mRNA相对表达量;c.Real-time PCR方法检测S100A10基因沉默后,UPA mRNA相对表达量;d.Western-Blot法检测S100A10基因沉默后目的蛋白表达情况;e.Western-Blot法检测S100A10基因沉默后,UPA目的蛋白表达情况
Fig.3Results of gene expression of S100A10 after neoformans and bEnd.3 cells were incubated 0 h,2 h,4 h,8 h,16 h,24 h (a.Western-Blot assay S100A10 protein expression,b.Western-blot gray ratios of experiment group compared with the control group 0 h)Fig.4Results of gene expression of UPA after neoformans and bEnd.3 cells were incubated on 0 h,2 h,4 h,8 h,16 h,24 h (a.Western-Blot assay UPA protein expression,b.Western-blot gray ratiosof experiment group compared with the control group 0 h)Fig.5bEnd.under immunofluorescence microscopy after infected with lentivirus,and the the expression of S100A10 gene and UPA:a.bEnd.3 under high magnification (100×) Immunofluorescence after infected withLenti-S100A10-GFP cells;b.mRNA expression of S100A10 after S100A10 gene silencing;c.Real Time Quantitative PCR results of S100A10 and UPA mRNA after S100A10 gene silencing;d.Western-Blot assay results of S100A10 protein expression after S100A10 gene silencing;e.After detected S100A10 gene silencing,UPA protein expression by Western-Blot
本实验将新生隐球菌和bEnd.3小鼠微血管内皮细胞共孵育后,发现随着孵育时间的延长,血管内皮细胞S100A10和UPA的基因和蛋白表达增加。成功构建Lenti-S100A10-GFP慢病毒载体,进而感染bEnd.3小鼠微血管内皮细胞,用Real-time PCR和Western Blot的方法检测,发现S100A10和UPA的mRNA和蛋白水平都处于低表达状态。实验发现抑制S100A10基因,同时也可以影响UPA基因的表达,说明两者上下游基因在隐球菌侵袭血脑屏障中可能存在某种相互联系,S100A10基因起到更重要的作用。Brown等[18]的研究中发现小鼠bEnd.3内皮细胞间的蛋白ZO.1、ZO.2、闭锁蛋白Occludin和封闭蛋白Claudin是紧密连接的主要蛋白,是构成血脑屏障的模型原理的主要蛋白。李平等[19]在其研究中发现,沉默S100A10基因后,不影响以上小鼠脑微血管内皮细胞之间的紧密连接蛋白。说明在利用沉默S100A10基因后的Transwell模型在进行本实验,不影响血脑屏障的完整性。其进一步研究发现,当敲除S100A10基因的内皮细胞实验组和对照组分别和包被纤溶酶原的隐球菌孵育时,实验组激活的纤溶酶和对照组相比有明显的下降。其再用不包被纤溶酶的隐球菌和两组细胞再次孵育时,发现两组激活的纤溶酶的量很相近且没有明显的差异。这就说明,包被纤溶酶原的隐球菌依赖纤溶酶的大量被激活后通过“细胞旁途径”破坏细胞的紧密连接从而达到大举入侵血脑屏障进入模型大脑一侧的目的。本实验发现,隐球菌在侵袭血脑屏障体外模型中,对照组的隐球菌能更易穿越血脑屏障,且纤溶酶、尿激酶的活化量高于实验组。这说明抑制S100A10基因后,尿激酶-纤溶酶系统的活化受到影响,且很可能隐球菌利用该系统通过“细胞旁途径”侵袭血脑屏障受到抑制。与此同时,隐球菌通过“跨细胞内皮途径”侵袭血脑屏障中因为S100A10基因受到抑制,此条途径也很可能受到影响。

图6新生隐球菌B3501和Transwell体外血脑屏障模型共孵育后,通过模型的菌量和纤溶酶原、尿激酶激活的量:a.新生隐球菌通过Transewell体外血脑屏障模型的菌量;b.新生隐球菌和bEnd.3细胞共孵育后,纤溶酶原激活情况;c.新生隐球菌和bEnd.3细胞共孵育后,尿激酶激活情况 (与对照组相比,*.P<0.05,**.P<0.01)
Fig.6The amounts ofCryptococcusneoformanspassed throughinvitroBBB model and the activation of plasminogen and urokinase.a.The amounts ofCryptococcusneoformanspassed throughinvitroBBB model transwell;b.Plasminogen activation in bEnd.3 cells after co-incubated withC.neoformans;c.Activation of urokinase in bEnd.3 cells after co-incubated withC.neoformans
本实验证明,隐球菌的确可以通过S100A10蛋白激活尿激酶-纤溶酶途径,并且通过后两者的活化,帮助隐球菌通过细胞旁途径进入血脑屏障的大脑一侧。同时也表明,隐球菌通过尿激酶-纤溶酶途径侵袭血脑屏障的必要前提是S100A10基因和UPA基因都需要同时高表达。至于隐球菌在侵袭血脑屏障中,S100A10基因对尿激酶基因的表达有什么具体的影响以及隐球菌在侵袭动物实验模型中,是否也是使S100A10基因和UPA基因都同时高表达,激活尿激酶-纤溶酶途径,通过细胞旁路途径达到侵袭血脑屏障的目的,这些需要进一步的研究和探讨。
[1] Ritter M,Goldman DL.Pharmacotherapy of cryptococcosis[J].Expert Opin Pharmacother,2009,10(15):2433-2443.
[2] Bartlett KH,Kidd SE,Kronstad JW.The Emergence ofCryptococcusgattiiin British Columbia and the Pacific Northwest[J].Curr Infect Dis Rep,2008,10(1):58-65.
[3] Datta K,Bartlett KH,Baer R,et al.Spread ofCryptococcusgattiiinto Pacific Northwest region of the United States[J].Emerg Infect Dis,2009,15(8):1185-1191.
[4] Bartlett KH,Cheng PY,Duncan C,et al.A decade of experience:Cryptococcusgattiiin British Columbia[J].Mycopathologia,2012,173(5-6):311-319.
[5] Harris JR,Lockhart SR,Debess E,et al.Cryptococcusgattiiin the United States:clinical aspects of infection with an emerging pathogen[J].Clin Infect Dis,2011,53(12):1188-1195.
[6] McCarthy KM,Morgan J,Wannemuehler KA,et al.Population-based surveillance for cryptococcosis in an antiretroviral-naive South African province with a high HIV seroprevalence[J].AIDS,2006,20(17):2199-2206.
[7] Lortholary O,Poizat G,Zeller V,et al.Long-term outcome of AIDS-associated cryptococcosis in the era of combination antiretroviral therapy[J].AIDS,2006,20(17):2183-2191.
[8] 陈裕充,温海,陈江汉,等.新生隐球菌共孵育后小鼠脑血管内皮细胞S100A10基因的表达水平变化[J].中国真菌学杂志,2009,4(5):273-275.
[9] Subramanian S,Mathai D.Clinical manifestations and management of cryptococcal infection[J].J Postgrad Med,2005,51 (Suppl 1):S21-26.
[10]Lambertucci JR,Franco R,de Queiroz LC.Cryptococcal meningoencephalitis and pulmonary noduleinnon-HIV-infectedimmunocompetentpatient[J].Rev Soc Bras Med Trop,2005,38(2):207-208.
[11]Drouet A,Amah Y,Pavic M.Subacute meningoradiculomyeloencephalitis due to cryptococcosis infection[J].Rev Med Interne,2005,26(5):403-408.
[12]Stie J,Fox D.Blood-brain barrier invasion byCryptococcusneoformansis enhanced by functional interactions with plasmin[J].Microbiology,2012,158(Pt 1):240-258.
[13]Stie J,Fox D.Induction of brain microvascular endothelial cell urokinase expression byCryptococcusneoformansfacilitates blood-brain barrier invasion[J].PLoS One,2012,7(11):e49402.
[14]Jung MJ,Murzik U,Wehder L,et al.Regulation of cellularactin architecture by S100A10[J].Exp Cell Res,2010,316(7):1234-1240.
[15]Chen YC,Chen Jh,Wen H,et al.S100A10 downregulation inhibits the phagocytosis ofCryptococcusneoformansby murine brain microvascular endothelial cells[J].Microb Pathog,2011,51(3):96-100.
[16]van de Graaf SF,Hoenderop JG,Gkika D,et al.Functional expression of the epithelial Ca(2+)channels (TRPV5 and TRPV6)requires association of the S100A10-annexin 2 complex[J].Embo J,2003,22(7):1478e87.
[17]PardridgeWM.Blood-brain barrier biology and methodology[J],Neurovirol,1999,5(6):556e69.
[18]Brown RC,Morris AP,O'Neil RG.Tight junction protein expression and barrierproperties of immortalized mouse brain microvessel endothelial cells[J].Brain Res,2007,1 130(1):17-30.
[19]李平.甘露糖受体MR参与隐球菌免疫逃逸及S100A10促进隐球菌穿过血脑屏障的机制研究[D].上海:第二军医大学,2013.
[本文编辑]卫凤莲
Cryptococcus traversal across the Blood-Brain Barrier though S100A10-dependent activation of urokinase-plasmin system
QIU Tian wen,ZHU Hong-mei,WEN Hai
(PLAKeyLaboratoryofFungalDiseasesandShanghaiKeyLaboratoryofMolecularMedicalMycology,Desect1mentofDermatology,ChangzhengHospital,SecondMilitaryMedicalUniversity,Shanghai200003,China)
ObjectiveTo find if Cryptococcus traversal across the blood-brain barrier though S100A10-dependent activation of urokinase-plasmin system.Methods①The mouse brain microvascular endothelial cells bEnd.3 andCryptococcusneoformansB3501 were co-incubated.Then the expression of S100A10 gene and UPA genewere tested.②Expressionof S100A10 and UPA in S100A10 normal and silent groups of endothelial cellsInfected with lentivirus were also compared.③The abilities of Cryptococcus S100A10 normal and silent groups traversal across the transwell blood-brain barrier model were compared.Urokinase-related activation of plasminogen was tested by the chromogenic substrate assay.Results①In bEnd.3 incubated withCryptococcusneoformansB3501,Real-time PCR display high expression of mRNA of S100A10 and UPA;Western-blot show S100A10 protein and UPA protein overexpression.②While S100A10 gene been silenced,S100A10 and UPA expressions were suppressed.③Cryptococcal traversal across the transwellinvitroBBB model in S100A10 silenced group was less than that of controlgroup.The diffences on 8 h,16 h,24 h were especially statistically significant,P<0.05.The activation of urokinase and plasmin was also lower than that of control group.The diffences of plasminogen activation on 8 h,16 h and 24 h in two groups,the diffences of urokinase activation on 16 h and 24 h in two groups,were statistically significant,respectively.ConclusionCryptococcus traversal across the blood-brain barrier might be though S100A10-dependent activation of urokinase-plasmin system.In the meantime,the S100A10 gene and UPA gene of brain microvascular endothelial cells were highly expressed.
Cryptococcusneoformans;S100A10;urokinase;plasmin;blood-brain barrier
2016-05-16
国家自然科学基金 (31470252,81271800,31270181)
邱天文,男 (汉族),硕士研究生在读.E-mail:872280290@qq.com
温海,E-mail:wenhaipfk@126.com;朱红梅,E-mail:hmzhu_cn@163.com
R 379.5
A
1673-3827(2016)11-0129-06
