天然产物TS抗念珠菌作用研究
2016-08-16夏晓萍叶红郑彩虹俸春红刘龙孝
夏晓萍 叶红 郑彩虹 俸春红 刘龙孝
(1.浙江大学药学院,杭州 310058;2.浙江大学医学院附属妇产科医院,杭州 310006;3.中国农业科学院茶叶研究所,杭州 310008)
天然产物TS抗念珠菌作用研究
夏晓萍1,2叶红2郑彩虹2俸春红3刘龙孝1
(1.浙江大学药学院,杭州 310058;2.浙江大学医学院附属妇产科医院,杭州 310006;3.中国农业科学院茶叶研究所,杭州 310008)
目的探讨天然产物TS体外抗念珠菌作用。方法采用微量液基稀释法测定最低抑菌浓度 (MIC),琼脂稀释法测定最低杀菌浓度 (MFC),透射电镜观察TS对念珠菌超微结构的影响。结果TS抗白念珠菌的MIC范围0.08~0.32 mg/mL,抗光滑念珠菌MIC范围0.08~0.16 mg/mL,抗热带念珠菌MIC范围0.32~0.64 mg/mL,抗近平滑念珠菌MIC 0.32 mg/mL,抗克柔念珠菌MIC 0.32 mg/mL。对白念珠菌具有杀菌作用,MFC 0.64 mg/mL。透射电镜下可见:细胞壁皱缩、破裂;细胞核异常;细胞质中可见较多空泡状结构;细胞中无完整细胞器结构。结论TS具有明确的抗念珠菌作用,可使其形态和超微结构发生明显
三萜皂苷;抗真菌;念珠菌
[Chin J Mycol,2016,11(3):149-152]
基于环境、气候因素,尤其近30 a来,临床上广谱抗生素、皮质类固醇、免疫抑制剂的广泛使用,器官移植技术的开展,艾滋病患者和糖尿病患者的增加,导致念珠菌感染临床高发,甚至成为免疫受损患者的重要死亡原因。念珠菌属 (Candida)属于子囊菌亚门、子囊菌纲、酵母菌目、酵母菌科。该属中最常见的致病性念珠菌是白念珠菌 (Candi-daalbicans),其他还有光滑念珠菌 (Candidaglabrata)、近平滑念珠菌 (Candidaparasilosis)、热带念珠菌 (Candidatropicalis)、克柔念珠菌 (Candidakrusei)、乳酒念珠菌 (Candidakefyr)等。白念珠菌最为多见,致病力最强,约占临床分离株的50%~70%不等。但流行病学资料显示:白念珠菌引起的感染近年有逐渐下降的趋势,而非白念珠菌的比例在逐渐升高[1-2]。
伴随着不断问世的人工合成抗真菌药,真菌的耐药问题日渐严重,因此从天然产物中筛选抗真菌药成为近年来研究的热点。
本文将探讨天然产物TS:来自山茶科 (Theaceae)山茶属 (Camellia)植物茶 (Camellia sinensis L)的三萜皂苷的抗念珠菌作用。
1 材料和方法
1.1受试药物
天然产物TS由课题组提取。原料由中国农业科学院茶叶研究所提供,采用醇提取法,再经重结晶得到。
1.2试验材料和仪器
RPMI-1640培养基 (含L-谷酰胺而不含碳酸氢钠,含pH指示剂)(上海生工生物);吗啉基丙磺酸 (MOPS)(上海生工生物);科玛嘉显色培养基 (郑州博赛生物技术有限公司);改良沙氏培养基 (青岛海博生物技术有限公司);YPD液体培养基 (青岛海博生物技术有限公司);生物安全柜 (The Baker Company);全自动微生物分析仪 (VITEK-Compact,法国生物梅里埃);漩涡混合器 (VORTEX-GENIE2);生化培养箱 (上海精实实验设备有限公司);透射电镜 (JEM-1200EX,日立)。
1.3受试菌株
标准质控菌株6株:白念珠菌4株 (ATCC64548,ATCC90029,ATCC64550,ATCC10231);近平滑念珠菌1株 (ATCC22019);克柔念珠菌1株 (ATCC6258)。(标准菌种均由中国药品生物制品鉴定所提供);临床分离株50株:其中白念珠菌32株;光滑念珠菌12株;热带念珠菌4株;近平滑念珠菌1株;克柔念珠菌1株。临床分离株均由浙江大学医学院妇产科医院临床分离得到,分别来自于阴道、肠道、口腔、表皮,经显色培养基鉴定为念珠菌。
1.4微量液基稀释法测定TS体外抗念珠菌活性 (MIC)[3-4]
供试药品的稀释先配制高浓度贮存液。实验时,再以RPMI液体培养基稀释成终浓度的2倍。其终浓度分别为2.56 mg/mL、1.28 mg/mL、0.64 mg/mL、0.32 mg/mL、0.16 mg/mL、0.08 mg/mL、0.04 mg/mL、0.02 mg/mL、0.01 mg/mL。
菌悬液的制备将受试菌株在沙氏培养基上连续转种2次,以确保纯度和活力。经35℃培养24 h,取5个直径大于1 mm的菌落于5 mL无菌生理盐水中震荡15 s,制成菌悬液。用血细胞计数板将其浓度调至菌浓度为 (1~5)×106CFU/mL。然后用RPMI液基1∶50稀释后再1∶20稀释 (即共稀释1 000倍),至菌浓度 (1~5)×103CFU/mL。
试验培养基RPMI-1640粉 (含L-谷酰胺而不含碳酸氢钠,含pH指示剂)10.4 g,MOPS (吗啉基丙磺酸)34.53 g,加入去离子水900 mL,用1 M NaOH调pH7.0 (25℃),定容至1 L。使MOPS终浓度为0.165 mol/L,最后用0.22 μm微孔滤膜过滤除菌,4℃保存备用。
接种取微孔96孔板,1~9列孔中由高浓度至低浓度分别加0.1 mL药液,再加0.1 mL菌悬液。11号孔加0.2 mL菌悬液 (阳性孔),12号孔加0.2 mL空白对照 (不加药物的液基)。
培养药敏板用塑料包裹后,35℃不摇动培养48 h。观察结果。
结果判定按照CLSI制定的标准进行结果判读。最小抑菌浓度 (MIC)为肉眼直接观察到的真菌生长的完全被抑制时的药物浓度。在一批实验中,所有被测菌株得到的MIC值为MIC范围;能抑制50%或80%受试菌所需的MIC值,分别为MIC50值和MIC80值。
1.5最低杀菌浓度 (MFC)测定[5-6]
选取白念珠菌菌株试验管。依次将未见白念珠菌生长的各管培养物各吸取0.1 mL涂布于沙氏培养基平板上,28℃培养7 d,平板上菌落数小于5个的最小稀释度的药物浓度即为最低杀菌浓度。
1.6透射电镜观察TS对白念珠菌细胞超微结构的影响[7]
将白念珠菌标准菌株在沙氏培养基上连续转种2次,以确保纯度和活力。取白念珠菌接种于YPD培养液中,150 r/min震荡培养至对数生长期。以和培养液1∶1的比例加入供试品 (试验终浓度0.64 mg/mL)继续培养10 h,1 000 r/min离心10 min,PBS (pH=7.2)漂洗3次,至上清液无色。
去上清液,加3%戊二醛5 mL于4℃固定过夜;再以PBS漂洗3次,1%锇酸固定;分别以乙醇、丙酮脱水;再以丙酮与包埋剂按不同比例混合后浸透样品。
包埋剂包埋样品,烘烤、聚合、定位、切片、铅铀染色,在透射电镜 (JEM-1200EX,日立)下观察。
2 结 果
2.1TS体外抗念珠菌作用的微量液基稀释法试验结果见表1
2.2最低杀菌浓度 (MFC)
将1~4号管培养液各取0.1 mL涂布于沙氏培养基平板上,培养后,可见2.56 mg/mL、1.28 mg/mL、0.64 mg/mL浓度的3个平板无菌生长,0.32 mg/mL有大于5个的菌落生长。
结果显示MFC为0.64 mg/mL,MFC/MIC=2。因为MFC/MIC<4,显示供试品药物有杀菌作用。
表1TS微量液基稀释法抗念珠菌作用
Tab.1Antifungal activity of TS againstCandidaspecies by microdilution antifungal susceptibility test

致病菌MIC范围(mg/mL)MIC50(mg/mL)MIC80(mg/mL)白念珠菌0.08~0.320.160.32光滑念珠菌0.08~0.160.080.08热带念珠菌0.32~0.640.320.32近平滑念珠菌0.320.320.32克柔念珠菌0.320.320.32
2.3电镜下白念珠菌在TS作用前后的变化
白念珠菌的正常细胞在电镜下观察显示:细胞形状规则;细胞壁完整,厚薄均匀;细胞基质均匀,细胞器丰富;细胞内可见清晰完整的细胞核、线粒体等 (见图1)。
经供试品作用过的白念珠菌在电镜下显示:细胞壁皱缩、破裂;细胞核异常;细胞质中可见较多空泡状结构;细胞中无完整细胞器结构 (见图2)。
3 讨 论
抗真菌药物敏感性试验是测定病原真菌对抗真菌药物的敏感性的体外试验方法。常用最低抑菌浓度 (minimal inhibitory concentration,MIC)表示,即药物完全抑制真菌生长的最低浓度。常用MIC范围、MIC50、MIC80等数值来评判[6]。
液基法是根据美国临床实验室标准化研究所 (Clinical and Laboratory Institute,CLSI)推出的方法,即“酵母菌液基稀释法抗真菌药物敏感实验参考方案文件”(M27-P),此后经修改至目前的M27-A2。该方法是针对酵母菌的抗真菌药敏实验方法,主要包括念珠菌和隐球菌。此法是用液体培养基配制一系列稀释度的药液,然后接种受试菌的菌悬液。经一定温度孵育后,测定药物在体外抑制真菌生长的最低药物浓度。微量液基法是采用一次性使用的无菌微量稀释板 (96孔板)进行药敏实验,将一系列稀释的药物液基加入每个小孔,再加入菌悬液,经培养后,观测MIC值。由于此法在微量孔中进行,操作简便,成本低,因此成为国内外抗真菌药物敏感实验的最常用方法。但缺陷是结果判定以肉眼观察是否澄清为主要标准,会有一定误差。
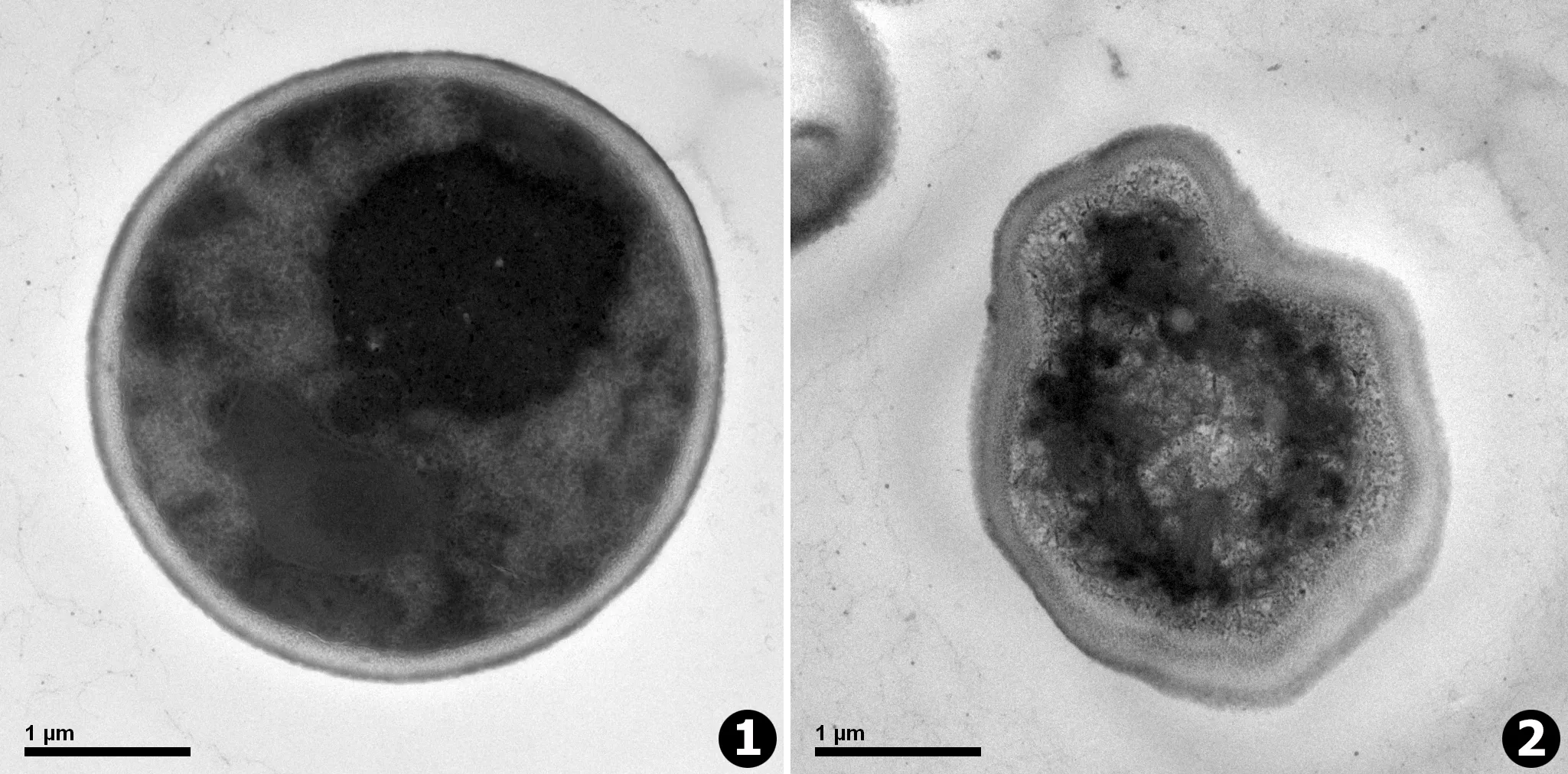
图1正常的白念珠菌超微结构电镜图谱 (对照组)(25 000×)图2TS作用后的念珠菌超微结构电镜图谱 (供试品组) (25 000×)
Fig.1Ultra microstructure ofCandidaalbicansby transmission electron microscope (25 000×)Fig.2Ultra microstructure ofCandidaalbicanswith Theasaponins action by transmission electron microscope (25 000×)
测定药物在体外对病原微生物 (真菌)有无杀灭作用,常用最低杀菌浓度 (minimal fungicidal concentration,MFC)表示,即杀死真菌所需的最低药物浓度。当药物浓度在稍高于MIC值浓度下的抑菌作用是不可逆的,称为杀菌作用。MFC值与MIC值之比,反应了抗菌药物杀菌能力的强弱。通常,当比值≤4时,认为该药具有杀菌作用,当比值>4时,则表示为抑菌药[1,6]。液基法由于菌体和药物能在液体里充分接触,结果更具精确性和重复性;且可进行再培养从而确定MFC。故本试验采用微量液基稀释法先测定MIC,再确定MFC。
体外药敏试验中,培养基、菌株等因素皆可影响试验结果。固体培养基和液体培养基所得到的MIC可能会有一定差异。菌株的来源不同,对药物的敏感性会有差异。故本试验采用标准质控菌株测定MFC。
真菌 (fungus)系真核生物,具有细胞壁、细胞膜、细胞核、细胞器等。透射电镜 (transmission electron microscope,TEM)是观察念珠菌的断面、横断的差别、各种细胞器、细胞膜、细胞壁等超微结构的理想工具。本试验结果显示:经过TS作用的念珠菌,其细胞的超微结构发生显著变化,为进一步的研究提供了理论依据。
[1]温海,李若瑜.医学真菌学[M].北京:人民卫生出版社,2012:13-21,116-120.
[2]贾战生,陈智.临床微生物学[M].北京:人民卫生出版社,2010.165-190.
[3]王文莉,郑玮清,李若瑜,等.采用NCCLS M27-A方案微量法检测念珠菌对抗真菌药物的敏感性[J].中华检验医学杂志,2001,24(2):107-108.
[4]李若瑜,刘伟.抗真菌药物体外药敏试验的应用前景[J].中华检验医学杂志,2007,30(1):6-8.
[5]马绪荣,苏德模.药品微生物学检验手册[M].北京:科学出版社(2000版):193-203.
[6]魏伟,吴希美,李元建.药理实验方法学[M].北京:人民卫生出版社,2010(第4版):1442-1446.
[7]郭晓奎.医学微生物实验技术[M].北京:人民卫生出版社,2010版:2-5.
[本文编辑]王飞
Invitroactivity of triterpene saponins from tea plant (Theaceae) againstCandidaspecies
XIA Xiao-ping1,2,YE Hong2,ZHENG Cai-hong2,FENG Chun-hong3,LIU Long-xiao1
(1.ZhejiangUniversity,Instituteofpharmaceutics,Hangzhou310058,China;2.ZhejiangUniversity,Women'sHospital,Hangzhou310006,China;3.TeaResearchInstitute,ChineseAcademyofAgriculturalSciences,Hangzhou310008,China)
ObjectiveTo explore the antifungtal activity of TS from Camellia sinensis L.againstCandida.MethodsThe minimal inhibitory concentration (MIC) was tested by broth microdilution method based on CLSI (Clinical and Laboratory Standards Institute).The minimal fungicidal concentration (MFC) was tested by agar plate dilution assay.The ultrastructure ofCandidaalbicanstreated with TS was observed by transmission electron microscopy.ResultThe range of inhibitory concentration of the antifungal activity againstCandidaalbicanswere from 0.08 mg/mL to 0.32 mg/mL.The minimal fungicidal concentration againstCandidaalbicanswas 0.64 mg/mL.Candidaalbicanstreated with TS showed that the cell wall shrinked and ruptured,the cell nucleus had the abnormal morphology and the cell organelles were imcomplete as well as vacuoles were formed under TEM.ConclusionTS has antifungal activity againstCandidaspeciesinvitro.
triterpene saponins;antifungal activity;Candidaalbicans
2015-09-17
浙江省自然科学基金 (LY12C20012),浙江省公益性技术研究项目 (2013C32084)
夏晓萍,女 (汉族),本科,副主任药师.E-mail:xiaxp@sohu.com
刘龙孝,E-mail:liulx@zju.edu.cn
R 379.4R 978.5
A
1673-3827(2016)11-0149-04
