临时配制的对乙酰氨基酚混悬液的稳定性与分剂量研究Δ
2016-08-15刘丽利张建民姬志强
刘丽利,张建民,姬志强,石 磊
(解放军第155中心医院药械科,河南 开封 475003)
临时配制的对乙酰氨基酚混悬液的稳定性与分剂量研究Δ
刘丽利*,张建民,姬志强,石磊#
(解放军第155中心医院药械科,河南 开封475003)
目的:探讨以单糖浆和水为稀释剂分别临时制备乙酰氨基酚混悬液的分剂量和稳定性。方法:将对乙酰氨基酚片剂研磨成粉状,分别加入至单糖浆和纯化水中配成混悬液,并分别进行稳定性试验和分剂量试验,考察其在室温(25 ℃)和2~10 ℃环境下72 h内的药物稳定性与0、4、8、24 h的分剂量准确性。结果:在稳定性试验中,放置72 h后2种混悬剂的浓度均在起始浓度的98%~102%范围内;在24 h内的分剂量试验中,以单糖浆为稀释剂的混悬剂各个时间点浓度的差异无统计学意义(P>0.05),而以纯化水为稀释剂的混悬剂的各个时间点浓度的差异有统计学意义(P<0.05)。结论:在室温(25 ℃)和2~10 ℃条件下,对乙酰氨基酚片剂磨粉后加入到单糖浆和水中放置72 h后稳定性均较好;而在24 h内的分剂量试验中,不管是在室温(25 ℃)还是2~10 ℃的环境下,以单糖浆为溶剂的药物的分剂量都较以纯化水为溶剂的分剂量准确。
对乙酰氨基酚; 稳定性; 分剂量
据统计,我国儿童约占总人口数的20%,有近90%的药物没有适合儿童使用的剂型,因此,在很多情况下需将成人片剂、胶囊剂或颗粒剂等药品分剂量给儿童使用,儿童用药剂型成人化相当严重。而国内的分剂量方法大都是将固体剂型磨粉分包或切割成小等份给儿童使用,但临床试验表明该分剂量方法易导致给药剂量错误,影响儿童用药安全。固体药物液体化具有分剂量准确和易于服用等优点,国外常用这种方法对药品进行分剂量。 对乙酰氨基酚是一种疗效肯定、不良反应小、适合儿童服用的常用解热镇痛药。而解放军第155中心医院(以下简称“我院”)缺少儿童专用剂型,儿科临床医师只能根据儿童的年龄、体质量、体表面积计算给药剂量,将成人片剂掰成1/2甚至1/5来用,而大量文献证明,这种方法易导致给药剂量错误[1-4],而给药剂量错误是增加儿科用药不良反应的重要原因之一[5]。糖浆剂具有矫正苦味和分剂量准确等优点,对于吞咽困难的儿童及成人来说,糖浆剂也是优于片剂等固体制剂的一项非常好的选择。本研究旨在考察对乙酰氨基酚片剂在单糖浆中的72 h内的稳定性和24 h内的分剂量问题,现报告如下。
1 材料
1.1仪器
LC2010CHT型高效液相色谱仪(日本岛津公司);岛津UV-2401PC型紫外分光光度计(日本岛津公司);TG-328A型电光分析天平(上海天平仪器总厂);TGL-16G飞鸽牌台式高速离心机(上海安亭科学仪器厂)。
1.2药品与试剂
对乙酰氨基酚原料药(河北冀衡药业有限公司,批号:1504018,纯度:98%~102%);对乙酰氨基酚片剂(我院自制制剂);单糖浆(根据《中华人民共和国药典》自制,批号:D20151105005)。
2 方法与结果
2.1含量测定方法
2.1.1色谱条件:流动相为乙腈-1%的醋酸(V∶V=10 ∶90),色谱柱为C18柱(4.6 mm×250 mm,5 μm),检测器为紫外检测器,选择的波长为254 nm,流速为1.0 ml/min,柱温30 ℃,进样量20 μl。
2.1.2方法学验证:精密称取14.82 mg对乙酰氨基酚原料药置50 ml容量瓶中,加入甲醇-水(V∶V=1 ∶1)20 ml,振摇至溶解,之后加入甲醇-水(V∶V=1 ∶1)至刻度,摇匀,超声10 min。得到质量浓度为296.4 μg/ml的储备溶液。之后分别移取1、2、4、6、8、10 ml的储备溶液于10 ml容量瓶中,加甲醇-水(V∶V=1 ∶1)至刻度,摇匀,超声,离心,各取20 μl进液相,得峰面积分别为2 545.9、4 897.3、9 703.4、14 475.0、18 758.1。以峰面积为纵坐标,浓度为纵坐标,得到回归方程:Y=78.662X+283.52 (r=0.999 7),对乙酰氨基酚在29.64~237.12 μg/ml质量浓度范围内,浓度与峰面积线性关系良好,日内精密度为0.13%,平均日间精密度为0.14%,加样回收率为101%,重复性良好,RSD为0.19%。
2.2样品的制备
2.2.1样品处理:将样品置于25 ml容量瓶中,并立即用甲醇-水(V∶V=1 ∶1)将样品药液全部冲洗至25 ml容量瓶中,最后稀释至规定刻度,摇匀,超声10 min,以4 000 r/min的转速离心5 min,过滤,取续滤液20 μl进液相。
2.2.2稳定性试验的样品制备:将对乙酰氨基酚片剂在研钵中彻底研磨成粉末,取适量粉末分别加入单糖浆和水中,配制质量浓度约为4.80 mg/ml的单糖浆混悬药液和水混悬药液,搅拌均匀,分别抽出15份1 ml混悬液放于室温(25 ℃),12份1 ml混悬液放到2~10 ℃冰箱里,放置0、24、48、72 h后处理样品。每次平行取出3个1 ml混悬剂按“2.2.1”项下方法处理样品。
2.2.3分剂量试验的样品制备:将对乙酰氨基酚片剂在研钵中彻底研磨成粉末,取适量粉末分别加入到单糖浆和水中,配制质量浓度为约2.95 mg/ml的单糖浆和水的混悬液各6份,搅拌均匀,放入2~10 ℃冰箱中。分别于0、4、8、24 h取样,每次取样前先搅匀,之后倒出5 ml混悬液,剩下的放回冰箱中。将倒出的5 ml混悬液水浴加热(35 ℃),加热后,精密量取1 ml置于25 ml容量瓶中,按“2.2.1”项下方法处理样品。
2.3数据处理
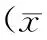
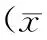
2.4稳定性试验结果
在稳定性试验考察过程中,对乙酰氨基酚粉末在单糖浆和水中分别放置72 h,观察其外观都没有明显的变化,图谱中也未发现有未知杂质峰出现,对乙酰氨基酚单糖浆混悬液在室温(25 ℃)和冰箱环境(2~10 ℃)下放置72 h后,各个时间点的浓度至少占起始质量浓度的99.3%以上,见表1;对乙酰氨基酚的水混悬液在室温(25 ℃)和冰箱环境(2~10 ℃)下放置72 h后,各个时间点的浓度至少在起始质量浓度的98.8%以上,见表2;两者都在98%~102%范围之内。由此判定,对乙酰氨基酚粉末在单糖浆和水中放置72 h后均较稳定。
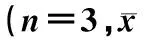


混悬液起始质量浓度/(μg/ml)占起始质量浓度的比例/%24h48h72h对乙酰氨基酚单糖浆混悬液192.04±1.1599.7±0.27100.2±0.87100.7±1.16对乙酰氨基酚的水混悬液192.20±1.47100.1±0.51101.2±0.52100.8±1.48

表2 2~10 ℃下对乙酰氨基酚稳定性测定结果Tab 2 Determination of stability of paracetamol at refrigerator(2-10 ℃)
2.5分剂量试验结果
在室温和冰箱环境下,以单糖浆为溶剂的药物浓度在各个阶段均未有显著变化,差异均无统计学意义(P>0.05),而以水为溶剂的样品浓度呈现逐渐增高的趋势,差异有统计学意义(P<0.05),见表3~4。

表3 室温(25 ℃)下对乙酰氨基酚在单糖浆和水中的分剂量结果±s,%)Tab 3 Divided dose of paracetamol powder with simple syrup and pure water at room temperature(25 ℃)±s,%)

表4 2~10 ℃下对乙酰氨基酚在单糖浆和水中的分剂量结果±s,%)Tab 4 Divided dose of paracetamol powder with simple syrup and pure water at refrigerator(2-10 ℃)±s,%)
3 讨论
稳定性试验结果显示,在2种稀释剂中放置72 h后药物浓度仍较稳定,可见对乙酰氨基酚的药物化学性质相对稳定,虽然单糖浆的糖度较高,微生物很难生存,但不同的包装材料有不同的保质期,未进行微生物检查,因此建议不要超过24 h,并在冰箱里保存。
分剂量试验结果显示,对于水的混悬液,可能由于药粉分散不均,从而导致分剂量不准确。由于对乙酰氨基酚微溶于水,在水中稍微静置片刻就会出现其药粉很快就聚集在下方,即时经过摇晃均匀后再进行分剂量,在分剂量时药粉仍然会快速聚集底部,导致底部浓度逐渐偏大。而单糖浆可能由于其有较好的悬浮性,测得的含量相对较稳定。由此可见,在儿科用药剂型单一的情况下可以考虑用单糖浆作为辅助稀释剂,但前提是需要证明其在单糖浆中的稳定性和药品的适宜性[6-8]。有文献表明,在国外常采用将上市片剂磨粉加入稀释剂中,这种做法虽然解决了分剂量的问题,但药物在稀释剂中的稳定性需要考察后才能放心使用[9-13]。本研究的不足是没有针对不同的人研磨粉末的程度做进一步研究,对研究结果可能会造成影响,需要进一步的改进。
综上所述,在室温(25 ℃)和2~10 ℃条件下,对乙酰氨基酚片剂磨粉后加入单糖浆和水中放置72 h后稳定性都较好;而在24 h内的分剂量试验中,在室温和冰箱环境下,以单糖浆为溶剂的药物的分剂量都较准确,而以水为溶剂的分剂量均不太准确;且单糖浆能够掩盖药物苦味,提高儿童用药依从性。此研究仅作为我院使用单糖浆作为稀释剂对对乙酰氨基酚片剂进行24 h内准确分剂量的依据。
[1]胡丽华,王晓玲.我院片剂分剂量使用现状调查分析[J].儿科药学杂志,2013,19(3):32-35.
[2]刘元江,缪经纬,陈景勇,等.片剂分剂量的原因、存在问题及对策[J].中国医院药学杂志,2011,31(8):692-695.
[3]赵瑞玲.儿童用药现状及严重不良反应/事件影响因素分析[D].太原:山西医科大学,2011.
[4]刘元江,缪经纬,陈景勇,等.儿科药品分剂量现状浅析[J].中国药房,2012,23(1):87-89.
[5]Broussard L.Small size,big risk:preventing neonatal and pediatric medication errors[J].Nurs Womens Health,2010,14(5):405-408.
[6]Johnson CE,Cober MP,Hawkins KA,et al.Stability of extempo-raneously prepared oxandrolone oral suspe-nsions[J].Am J Health Syst Pharm,2011,68(6):519-521.
[7]Pettit RS,Johnson CE,Caruthers RL.Stability of an extemporaneously prepared tadalafil suspension[J].Am J Health Syst Pharm,2012,69(7):592-594.
[8]Fohl AL, Johnson CE, Cober MP.Stability of extemporaneously prepared acetylcysteine 1% and 10% solutions for treatment of meconium ileus[J].Am J Health Syst Pharm,2011,68(1):69-72.
[9]Burnett JE, Balkin ER.Stability and viscosity of a flavored omeprazole oral suspe-nsion for pediatric use[J].Am J Health Syst Pharm,2006,63(22):2240-2247.
[10]Skillman KL, Caruthers RL, Johnson CE.Stability of an extempo-raneously prepared clopidogrel oral suspension[J].Am J Health Syst Pharm,2010,67(7):559-561.
[11]Haywood A, Glass BD.Liquid dosage forms extemporaneously prepared from commercially available products-considering new evidence on stability[J].J Pharm Pharm Sci,2013,16(3):441-455.
[12]Navid F, Christensen R,Inaba H,et al.Alternative formulations of sorafenib for use in children [J].Pediatr Blood Cancer,2013,60(10):1642-1646.
[13]Ensom MH,Kendrick J,Rudolph S,et al.Stability of propranolol in extemporaneously compounded suspensions[J].Can J Hosp Pharm,2013,66(2):118-124.
Research on Stability and Divided Dose of Extemporaneous Paracetamol SuspensionΔ
LIU Lili, ZHANG Jianmin, JI Zhiqiang, SHI Lei
(Dept.of Drug and Equipment, 155 Central Hospital of PLA, Henan Kaifeng 475003, China)
OBJECTIVE:To probe into the stability and divided dose of extemporaneous paracetamol suspension prepared by single syrup and pure water as diluents. METHODS: Paracetamol suspension tablets were crushed into powder, and simple syrup and pure water were added. Meanwhile, stability test and divided dose test were respectively conducted on the paracetamol suspension, the accuracy of the divided dose at 0, 4, 8, 24 h and the stability of the suspension stored at 72 hours afterward at room temperature (25 ℃) and the refrigerator (2-10 ℃) were evaluated. RESULTS: In the stability test, concentration of the two mixed suspension stored at 72 hours afterward were between 98%-102% of initial concentration; in the 24 h divided dose test, there were no significant difference in simple syrup suspension at different time points (P>0.05), but there were significant difference in pure water suspension at different time points (P<0.05). CONCLUSIONS: The stability of paracetamol powder with simple syrup and pure water stored at least 72 hours at room temperature (25 ℃)and the refrigerator (2-10 ℃) was relatively good; yet drugs in simple syrup are more accurate than those in aqueous solution in divided dose test in both environments.
Paracetamol; Stability; Divided dose
2016-04-13)
济南军区联勤部科研项目(No.CJN14R062)
主任药师。研究方向:医院药学。E-mail:382504796@qq.com
R971+.1
A
1672-2124(2016)07-0899-03
10.14009/j.issn.1672-2124.2016.07.013
*药师。研究方向:药品检验。E-mail:lilihappy158@163.com
