溶菌酶眼用膜剂的制备及相关性质考察
2016-08-12王笑笑姜同英王思玲
韩 旭,王笑笑,姜同英,王思玲
·药学研究·
溶菌酶眼用膜剂的制备及相关性质考察
韩旭1*,王笑笑2,姜同英2,王思玲2
1.中国医科大学口腔医学院药剂科,沈阳 110002;2.沈阳药科大学药学院,沈阳 110016
[摘要]目的制备溶菌酶眼用膜剂,为感染性眼部疾病提供新的药物治疗。方法以脱膜性、粘附性、柔韧度、膜性能等相关指标为依据,筛选处方,采用涂膜法制备了溶菌酶眼用膜剂,并考察眼用膜剂的体外释放特性及眼部刺激性。结果以PVA124为膜材、甘油为增塑剂制备的眼用膜剂,8 h时累计释放量达到80%以上,对家兔眼部单次及多次给药后,根据评分标准,评分均为0,多次给药后的组织病理切片表明,给药组家兔虹膜有轻微充血。结论溶菌酶眼用膜剂制备工艺简单,符合眼部用药标准。
[关键词]眼用膜剂;溶菌酶;体外释放;眼部刺激性
0 引言
眼膜剂系指药物与高分子聚合物制成的无菌药膜。可置于结膜囊内缓慢释放药物的眼用固体制剂。其特点是:药物以膜为载体,药膜在眼结膜囊内被泪液逐渐溶解,由于药液黏度大,不易溢出,减少了从鼻泪管中流出的损失,因此,能使药物在眼结膜囊中维持较久、有效的治疗浓度,解决了滴眼液眼部药物利用度低和眼膏剂使眼部不适的问题。
用于治疗感染性眼病的药物主要为抗菌药物滴眼液,但是其具有耐药性、不良反应大等缺点,且用于治疗细菌和病毒交叉感染的眼病效果差。溶菌酶(Lysozyme)是一种存在于人体正常体液及组织中的非特异性免疫因素,既具有抗菌作用又具有抗病毒的作用,且具有来源于生物体、无耐药性、组织刺激性和毒性极低等优点[1]。同时作为泪液的组成成分之一,文献报道溶菌酶有利于眼睛泪膜的稳定[2],有利于侵入眼睛细菌的清除[3]。因此,溶菌酶在治疗感染性眼病方面有令人期待的临床用途。溶菌酶为生物大分子,在溶液中容易发生聚集,因此本文制备了溶菌酶眼用膜剂,改善溶菌酶稳定性的同时,延长了药物与眼部的接触时间,提高了药物生物利用度。
1 仪器与材料
UV-2000紫外分光光度仪[尤尼柯(上海)仪器有限公司];DF-101S集热式恒温加热磁力搅拌器(巩义市予华仪器有限公司);CP225D电子天平(Sartorius)。PVA124(日本株式会社可乐丽);PVA1799(天津华昌源化工贸易限公司);溶菌酶(西宝生物科技有限公司);溶壁微球菌(南京建成生物有限公司);Na2HPO4·12H2O(西陇化工股份有限公司);NaH2PO4·2H2O(西陇化工股份有限公司);乙二胺四乙酸二钠盐(西陇化工股份有限公司);生理盐水(沈阳志鹰制药厂)。白色家兔,雌雄兼用,体重2.5~3.0 kg,沈阳药科大学实验动物中心提供。实验前24 h自由进食,饮水,并进行眼部检查,以确保无任何眼部疾病。
2 方法与结果
2.1溶菌酶眼用膜剂的制备
2.1.1膜材料的筛选通过文献调研[4],聚乙烯醇(PVA)是常用的成膜材料。PVA的特点是毒性和刺激性都很小[5],其水溶液对眼组织不仅无刺激性,还是一种良好的眼球润湿剂,能在角膜表面形成保护膜,而且不会影响角膜的生理活性,不影响视力[6]。同时,由于PVA表面活性作用使药物易于穿透角膜,故对深层角膜炎亦有较好的疗效[7]。因此初步确定膜材为PVA。选择PVA两种常见型号PVA124及PVA1799,通过对脱膜性、粘附性、柔韧度、有无气泡以及溶化时间等方面考察,确定最终膜材,结果见表1。

表1 成膜材料的筛选
注:溶化时间:在32 ℃时,测定膜溶解的时间
由表1可知,以PVA124为膜材,甘油为增塑剂时,成膜效果及膜的柔软度较好。
2.1.2膜性能考察膜的性能主要包括薄膜厚度、透光率及膜断裂伸长率等方面,以下主要考察这3个指标:①薄膜厚度测定:在每张需测定的膜上任取3个点,用薄膜厚度测定仪测定薄膜厚度,并取平均值;②透光度测定:将待测样品裁切成矩形,贴于比色皿外表面,在500 nm下测定其透光率,以透光率大小来表示膜透明度;③膜断裂伸长率测定:从膜材上截取长为a(3 cm),宽为b(1 cm)的一小块膜,用力拉长至膜刚好断裂时,测定此时的膜长c,计算c是原长a的倍数。
2.1.3膜厚度对膜性能的影响膜厚度为0.038 mm时,膜的各项指标较好。见表2。
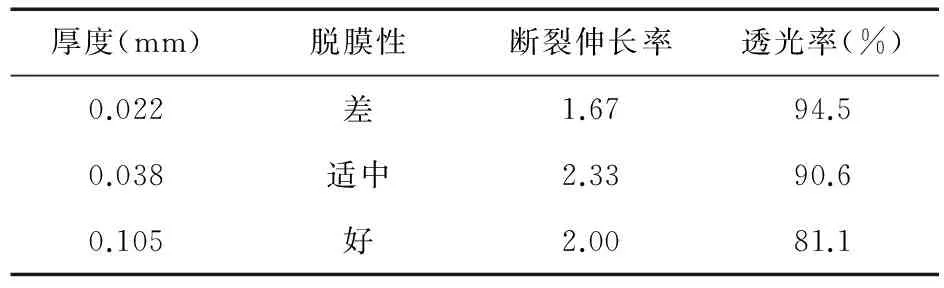
表2 膜厚度对膜性能的影响
2.1.4PVA浓度对膜性能的影响PVA浓度为10%时,膜的各项指标均较合适。见表3。
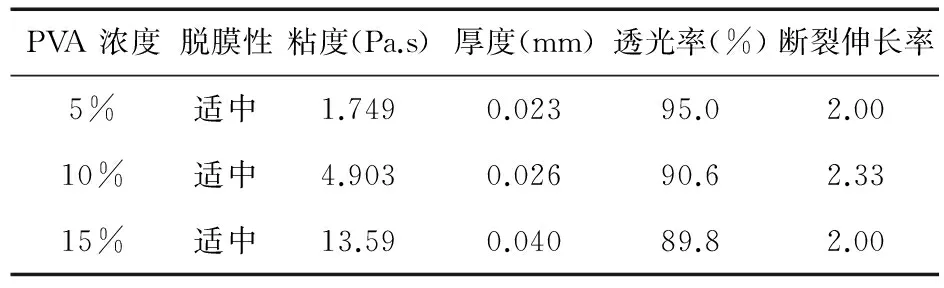
表3 PVA浓度对膜性能的影响
2.1.4增塑剂(甘油)的筛选甘油浓度为6%时,膜的各项指标较好。见表4。

表4 甘油对膜性能的影响
2.1.5溶菌酶眼用膜剂的最终处方及制备工艺制备工艺:称取PVA124 5 g,加入适量注射用水分散好,水浴加热至80 ℃溶解,制成浆液冷却至室温,称取甘油3 g加入其中,搅拌均匀,待用。另称取溶菌酶0.75 g,用注射用水溶解,加入已溶解成膜材料浆液中搅匀,最终使成膜浆液体积为60 mL。然后将其倾入预先涂有少量液体石蜡的玻璃板上,制膜2 000 cm2,经70~80 ℃的鼓风干燥箱15 min后,立即脱膜,取出,在紫外灯下灭菌30 min,切成0.5 cm×1 cm小块,无菌包装。见表5。

表5 溶菌酶眼用膜剂的最终处方
2.2溶菌酶活力测定酶活力测定参照文献[8],利用溶菌酶破坏溶壁微球菌细胞壁,从而降低细菌悬浮液浊度的原理,采用分光光度法测定。在25 ℃、pH 6.2的条件下,于450 nm处每分钟使吸光度值下降0.001即为1个酶活力单位(IU)。由此可得溶菌酶活力的计算公式如下:
单位为U/mg,a和A分别为0 s和60 s的吸光度,a′和A′分别为空白对照溶液的0 s和60 s的吸光度值。
2.3溶菌酶眼用膜剂的含量测定
2.3.1检测波长的确定称取溶菌酶25 mg,用磷酸盐缓冲液(pH 6.2)溶解并转移至100 mL容量瓶中,用磷酸盐缓冲液(pH 6.2)稀释并定容,配制适当浓度的溶菌酶磷酸盐溶液(约2.5 mg/mL),取适量溶菌酶眼用膜剂的基质溶解、转移并定容至100 mL的容量瓶中,以磷酸盐缓冲液为空白对照,按《中华人民共和国药典》2010版二部附录ⅣA紫外分光光度法,在200~400 nm波长范围内扫描,由结果可知,溶菌酶在281 nm处有最大吸收,在此波长处制剂中辅料对溶菌酶的含量测定没有影响,因此,选择281 nm作为溶菌酶含量测定波长。
2.3.2标准曲线的绘制精密称取溶菌酶对照品100.2 mg,加磷酸盐缓冲液(pH 6.2)溶解,稀释定容至100 mL容量瓶中。精密量取上述溶液1、2、3、4、5、6 mL分别至20 mL容量瓶中,加磷酸盐缓冲液(pH 6.2)稀释至刻度,摇匀,分别在281 nm处测吸光度,测定3次取平均值。得到吸光度(A)对溶液浓度(C)的工作曲线A=2.398 9 C+0.051 2,R2=0.999 8。浓度范围为0.05~0.4 mg/mL,浓度与吸光度线性关系良好。
2.3.3方法学验证①回收率实验:配制溶菌酶低、中、高浓度分别为0.050 1、0.150 3及0.300 6 mg/mL的样品溶液,按处方比例加入辅料,按含量测定项下的方法测定,记录吸光度,代入标准曲线计算,得到回收率分别为101.9%、100.6%和101.9%。
②精密度实验:配制溶菌酶浓度分别为0.050 1、0.150 3及0.300 6 mg/mL(低、中、高)的样品溶液,每个浓度配制3份样品,1 d内重复测定3次,计算日内相对标准偏差;每天测定1次,连续测定3 d,计算日间相对标准偏差。结果日内相对标准偏差分别为0.1%、0.2%和0.1%,日间相对标准偏差分别为0.9%、1.4%和1.4%,相对标准偏差均小于2%,符合方法学要求。
2.3.4含量测定取10 cm×10 cm(相当于200片)的载药膜,剪碎,放入烧杯中,加40 mL蒸馏水,在34 ℃水浴,100 r/min转速放置10 h后,转移到100 mL容量瓶中定容,再取4 mL至20 mL容量瓶中定容。过0.8 μm的微孔滤膜,取续滤液,在281 nm处测吸光度值A,代入标准曲线计算药物含量。
2.4溶菌酶眼用膜剂的体外释放
2.4.1溶菌酶眼用膜剂的体外释放行为采用Franz立式扩散池法测定溶菌酶眼膜体外释药行为,将膜夹在上下两池之间,膜有效扩散面积0.785 cm2,以脱气的人工泪液3 mL为溶剂,温度为34 ℃,转速为100 r/min。在5 min、15 min、30 min、1 h、2 h、5 h、8 h分别取样,每次3 mL,经0.8 μm微孔滤膜过滤,同时补充同温新鲜介质3 mL,在281 nm处测定吸光度。计算体外释药累计释放量,同时测定释放过程中的溶菌酶相对活力,结果见图1。

图1 溶菌酶眼用膜剂的释放曲线
由图1可知,溶菌酶眼用膜剂在体外释放8 h时,累计释放量可以达到80%以上,同时在释放过程中酶的相对活力未发生改变。
2.4.2溶菌酶眼用膜剂的体外释放机制[9-10]关于释药机制,存在诸多的释药模型体系[11-13]。常见有以下4种:零级释放:Q=a+bt;一级释放:ln(1-Q)=a+bt;Higuchi释放:Q=a+bt0.5和Ritger-Peppas释放:lnQ=a+blnt,式中:Q为药物累计释放百分数,t为取样时间,a为常数,b为释药速度常数。
对溶菌酶眼用膜剂体外释药行为进行以上4种模型的模拟,结果见表5。

表5 溶菌酶眼用膜剂体外释放方程参数
由表5可知,溶菌酶眼用膜剂就体外释放曲线对一级释放方程、Higuchi释放方程、Ritger-Peppas释放方程的拟合度都较好。
2.5溶菌酶眼用膜剂的眼部刺激性试验
2.5.1溶菌酶眼用膜剂对兔眼的单次给药眼刺激性试验取健康家兔4只,体重2~3 kg,左眼空白对照,右眼结膜囊内贴入溶菌酶眼用膜剂,贴入后轻轻闭合眼睑约10 s,分别于点药后1、2、4、24、48和72 h对眼部进行检查。根据国家食品药品监督管理局2014年《眼刺激反应分值标准》评分记录[14],结果显示,与对照组相比,给药组角膜透明,虹膜清晰,结膜未充血,无水肿及分泌物,手电配备放大镜检查角膜病变,评分为0。
2.5.2溶菌酶眼用膜剂对兔眼的多次给药眼刺激性试验取健康家兔4只,体重2~3 kg,左眼结膜囊内滴入0.1 mL生理盐水对照,右眼结膜囊内贴入溶菌酶眼用膜剂,贴入后轻轻闭合眼睑约10 s,每天4次,连续7 d,每天给药前及最后一次给药后1、2、4、24、48及72 h对眼部进行检查。根据国家食品药品监督管理局2014年《眼刺激反应分值标准》评分记录,结果显示,与对照组相比,给药组角膜透明,虹膜清晰,结膜未充血,无水肿及分泌物,手电配备放大镜检查角膜病变,评分为0。
多次刺激性实验结束后,耳缘静脉注射空气处死家兔。从双侧眼角处破开眼眶,突出眼球,剪断动眼肌及视神经丛,摘除眼球,冲去表面附着的血块,甲醛溶液(8%,w/v)固定24 h,乙醇梯度脱水,石蜡包埋,切片(厚度10 μm),脱蜡,苏木素(Hematologylin)与伊红(Eosin)对染(H.E.),脱水,封片,镜下观察各实验组家兔的组织病理切片,结果见图2、图3。
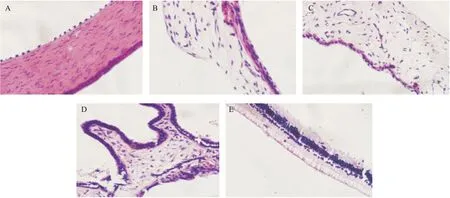
图2 对照组(生理盐水)家兔的眼部组织病理切片图

图3 给药组(溶菌酶眼用膜剂)家兔的眼部组织病理切片图
由家兔的组织病理切片结果可知,与对照组相比,给药组虹膜有轻微充血现象,根据国家食品药品监督管理局2014年《眼刺激反应分值标准》评分记录,属于无刺激性。
3 讨论
3.1溶菌酶是生物大分子,在体外释放实验中,除了考察药物释放量之外,还要考虑酶的活性。由体外释放结果可知,释放过程中溶菌酶活力基本保持不变,符合制剂要求。膜材PVA为可溶性高分子材料,与角结膜接触后逐渐被泪液溶解,随着膜材料的溶解,药物溶菌酶不断扩散。溶菌酶眼用膜剂的释药行为受扩散和溶蚀的双重影响。同时,膜材溶解后,表现出一定的黏性,粘附在角膜上,减少了药物的流失,并延长了药物的作用时间。
3.2眼睛是高度敏感的器官,其角膜上皮含有丰富的血管末梢神经,所以眼睛对刺激具有高度敏感性。溶菌酶眼用膜剂在兔眼刺激性实验过程中,在最初放入膜剂的2 min内,家兔眨眼次数较空白对照组增多,随后恢复正常,表明眼睛对溶菌酶眼用膜剂表现出一定的异物感,随着膜材的溶解,异物感消失。在多次给药的眼刺激试验中,病理组织切片结果反映了外来刺激物对多种组织的刺激效应。除了考察角膜损伤外,还对虹膜、结膜及其周围组织的炎症变化进行了全面系统的评价[15]。溶菌酶眼用膜剂使家兔虹膜轻微充血,但根据评分标准,仍属无刺激结果。
蛋白类药物溶菌酶制备成膜剂可以很好地避免其水溶液的不稳定性,如聚集和沉淀等,也可以更好地保持其生物活性。延长了药物与眼部的接触时间,提高药物生物利用度。
参考文献:
[1]赵龙飞,徐亚军.鸡蛋清中溶菌酶的应用性研究[J].食品工业,2006,(3):19-20.
[2]Mudgil P,Torres M,Millar TJ.Adsorption of lysozyme to phospholipid and meibomian lipid monolayer films [J].Colloids Surf B Biointerfaces,2006,(48):128-137.
[3]McDermott AM.Antimicrobial compounds in tears[J].Exp Eye Res,2013,117:53-61.
[4]金玲,王锦玉,仝燕,等.涂膜剂研究概述[J].中国实验方剂学杂志,2012,8:277-280.
[5]崔园园,冯超阳.用于生物材料的聚乙烯醇的研究进展[J].国际生物医学工程杂志,2009,32(5):302-305.
[6]康威.葛根总黄酮眼膜剂的制剂工艺和质量标准研究[D].北京:北京中医药大学,2006.
[7]陈英.膜剂的研究与临床应用进展[J].中国药师,2004,7(8):641-643.
[8]刘源岗,邓倩莹,廖问陶,等.溶菌酶的活性测定[J].食品科技,2005,10:71-73.
[9]Horvát G,Budai-Szücs M,Berkó S,et al.Comparative study of nanosized cross-linked sodium-,linear sodium- and zinc-hyaluronate as potential ocular mucoadhesive drug delivery systems[J].Int J Pharm,2015,494(1):321-328.
[10]张春盛,丘振文.新鱼腥草素钠眼用温敏原位凝胶的制备及其体外释药[J].中国医院药学杂志,2014,3:241-244.
[11]Kiran C,Anandrao RK,Tejraj MA.Blend microspheres of poly(3-hydroxybutyrate) and cellulose acetate phthalate for colon delivery of 5-fluorouracil[J].Industrial Engineering Chem Res,2011,50(18):10414-10423.
[12]Kajjari PB,Manjeshwar LS,Aminabhavi TM.Novel blend microspheres of cellulose triacetate and bee wax for the controlled release of nateglinide[J].J Industrial Engineering Chem,2014,20(2):397-404.
[13]Peppas NA,Bures P,Leobandung W,et al.Hydrogels in pharmaceutical formulations[J].Eur J Pharm Biopharm,2000,50(1):27-46.
[14]国家食品药品监督管理总局.关于发布药物安全药理学研究技术指导原则等8项技术指导原则的通告(第4号):药物刺激性、过敏性和溶血性研究技术指导原则[Z].2014.
[15]忻佳裕,纪宏宇,唐景玲,等.眼用制剂刺激性体内评价方法研究进展[J].中国药师,2015,4:644-646.
收稿日期:2015-10-25
*通信作者
DOI:10.14053/j.cnki.ppcr.201607028
Preparation and property evaluation of lysozyme ocular film
HAN Xu1*,WANG Xiao-xiao2,JIANG Tong-ying2,WANG Si-ling2
(1.Department of Pharmacy,School of Stomatology,China Medical University,Shenyang 110002,China;2.School of Pharmacy,Shenyang Pharmaceutical University,Shenyang 110016,China)
[Abstract]ObjectiveTo prepare and evaluate the lysozyme ocular film as a novel therapy for infectious eye diseases.MethodsVarious preparations were evaluated based on their attachment,detachment,flexibility and film performance.Lysozyme ocular film was prepared with coating method,and in vitro drug release characteristics and eye irritation were assessed.ResultsUsing PVA124 as film-forming material and glycerol as plasticizer,we found that cumulative drug release reached more than 80% at 8 hours.According to evaluation standard,the scores were both 0 for single and multiple dosing in eye irritation experiment in rabbits.Histopathologic examination revealed that multiple dosing of ocular film resulted in slight hyperemia of iris in the rabbit.ConclusionThe preparation process of lysozyme ocular film is simple and in accordance with the standard of ophthalmic drug.
Key words:Ocular film;Lysozyme;In vitro release;Eye irritation
