荧光光谱法研究亮蓝与溶菌酶的相互作用
2019-06-26张彦青王晓红
张彦青,王晓红
(衡水学院 化工学院,河北 衡水 053000)
亮蓝色素是一种常见的食用合成色素,合成成本较低,应用广泛。溶菌酶是一种的天然蛋白质,在人体多种组织中都广泛存在,稳定性很好,耐热,可在干燥条件下长期保存,分子质量较小。溶菌酶与药物的相互作用方面的文献报道不少[1-3], 但研究溶菌酶与食用合成色素结合相互作用的文献不多。本文利用荧光光谱法研究亮蓝与溶菌酶之间的相互作用。
1 实验部分
1.1 仪器与试剂
主要仪器:FA2204B电子天平-上海精密科学仪器股份有限公司;F-7000荧光分析仪-日立。
试剂:亮蓝-天津多福源实业有限公司;溶菌酶-上海伯奥生物科技有限公司。
2×10-5mol·L-1溶菌酶标准储备溶液;1×10-4mol·L-1亮蓝标准溶液。本实验所用试剂均为分析纯,实验用水为二次蒸馏水。
1.2 方法
1.2.1 荧光光谱分析
分别移取1.0×10-4mol/L的亮蓝标准溶液0、0.5、0.8、1.2、1.6、2.0、2.4 mL于10 mL比色管中,再分别加入2×10-5mol/L溶菌酶标准储备溶液1 mL,用二次蒸馏水定容,配成亮蓝-溶菌酶体系溶液,配置成三组,分别至于290、304、323 K三种不同的温度水浴锅中,稳定10 min,设置激发波长为280 nm、激发和发射单元狭缝均为5.0 nm,在波长范围300~450 nm内扫描亮蓝-溶菌酶体系的荧光谱图。
1.2.2 同步荧光光谱分析
分别吸取1.0×10-4mol/L的亮蓝标准溶液0、0.5、0.8、1.2、1.6、2.0、2.4 mL于10 mL比色管中,再分别加入2×10-5mol/L溶菌酶标准储备溶液1 mL,用二次蒸馏水定容,配制成以亮蓝为变量的亮蓝-溶菌酶体系溶液,设定Δλ=15 nm和Δλ=60 nm,扫描同步荧光光谱。
2 结果与讨论
2.1 亮蓝与溶菌酶体系的有荧光猝灭机理
2.1.1 荧光光谱
由图1可知,溶菌酶在344 nm处有最高峰值,随着亮蓝浓度的逐渐增高,溶菌酶的强度明显下降,说明亮蓝对于溶菌酶有猝灭作用[11]这说明亮蓝对溶菌酶能够产生荧光猝灭,更进一步说明两者可以发生相互作用。按方程(1)进行处理,数据如图2。
F0/F=1+Ksv[Q]=1+kqτ0[Q] (1)
式中Ksv为猝灭常数,L·mol-1;[Q]为亮蓝的浓度,mol-1·L;Kq是速率常数,L·mol-1·s-1;τ0为无猝灭剂存在下荧光分子的平均寿命,s。
根据直线的斜率可求得温度为290、304、323 K时的动态猝灭常数Ksv分别为7.70×104,4.17×104,3.41×104mol/L,Kq分别为7.70×1012,4.17×1012,3.41×1012mol/L,相关系数分别为0.9982,0.9976,0.9974,表明各条曲线呈线性。而亮蓝对溶菌酶的猝灭常数Ksv随温度升高而降低,表明只存在一种猝灭类型。通常情况下认为,各种荧光猝灭剂对生物大分子的动态猝灭速率常数的最大值约为2.0×1010L·mol-1·s-1。本实验在290、304、323 K时亮蓝对溶菌酶的猝灭常数远大于2.0×1010L·mol-1·s-1,因此可知亮蓝对溶菌酶的猝灭过程属于静态猝灭。

图1 290 K亮蓝-溶菌酶体系荧光光谱图
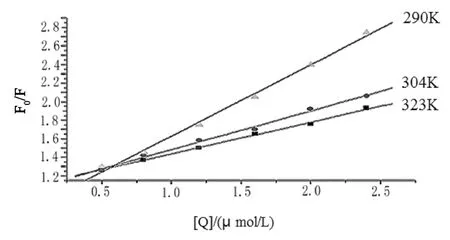
图2 不同温度时亮蓝对溶菌酶的荧光猝灭Stern-Volmer曲线
2.1.2 亮蓝-溶菌酶的结合常数
对于静态猝灭,亮蓝-溶菌酶作用之间的结合常数、结合位点数用公式(2)[4]求得
lg[(F0-F)/F]=lgKA+nlg[Q] (2)
式中:F0、F分别为加入亮蓝前后溶菌酶的荧光强度;K为结合常数,L·mol-1;n为结合位点数;[Q]为亮蓝的浓度,mol-1·L。由表1可知在不同的温度体系下结合常数K较大,说明两者之间的结合作用较大。
2.1.3 热力学参数
化学小分子与生物大分子之间的作用力通常有有疏水作用、范德华力、氢键作用、静电作用[5],它们间的作用力可以根据反应前后热力学焓变(ΔH)和熵变(ΔS)的相对大小求得。即ΔH>0,ΔS<0,主要为疏水作用;若ΔH<0,ΔS<0,则主要是范德华力和氢键作用;若ΔH<0,ΔS>0,则是静电作用。根据公式 (3)(4)(5)可求得ΔH,△G和ΔS,结果见表1。由表1可知,不同温度下的△G均小于0,表明亮蓝和溶菌酶之间的相互作用是自发的。由焓变和熵变可知,亮蓝与溶菌酶之间的主要作用力为范德华力和氢键[13]。
ln(K2/K1) =(1/T1-1/T2)(ΔH/R) (3)
ΔG=-RTlnK (4)
ΔG=ΔH-TΔS (5)

表 1 亮蓝与溶菌酶之间的热力学参数
2.2 亮蓝与溶菌酶体系的同步荧光光谱
分别将的Δλ设定为15和60 nm,扫描即得到溶菌酶在加入亮蓝前后酪氨酸和色氨酸残基的同步荧光特征光谱[6],结果见图3。
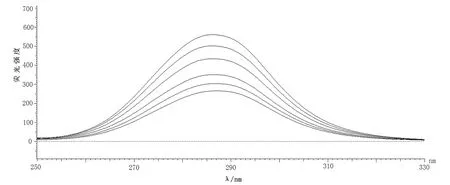
当Δλ为15nm时亮蓝-溶菌酶体系的同步荧光光谱图
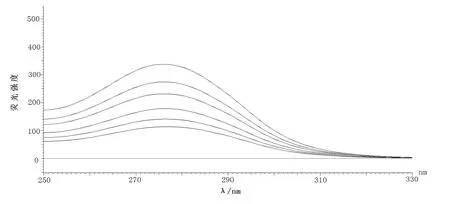
当Δλ为60nm时亮蓝-溶菌酶体系的同步荧光光谱图图3 亮蓝浓度对溶菌酶同步荧光光谱的影响
由图3可知,随着亮蓝浓度的增加而荧光强度降低,溶菌酶的峰形基本保持不变,说明没有改变溶菌酶的构象,Δλ=60荧光强度下降较为明显,所以结合位点更接近色氨酸残基,进一步表明亮蓝-溶菌酶之间发生了荧光猝灭。
3 结论
本实验采用荧光光谱法亮蓝与溶菌酶的相互作用,研究表明亮蓝与溶菌酶是静态猝灭,两者之间的作用力主要是范德华力和氢键作用;从同步荧光光谱中可以得知亮蓝没有改变溶菌酶的构象。这些结论对于溶菌酶的进一步探究提供了积极意义。
