反相高效液相色谱法测定人血浆中伏立康唑的浓度
2016-08-12李宇张蕾邓明影张永煌陈卫东史天陆
李宇,张蕾,邓明影,张永煌,陈卫东,史天陆
(1.安徽中医药大学药代动力学研究室,安徽 合肥 230031; 2.安徽省立医院药剂科,安徽 合肥 230001)
反相高效液相色谱法测定人血浆中伏立康唑的浓度
李宇1,2,张蕾2,邓明影2,张永煌1,2,陈卫东1,史天陆1,2
(1.安徽中医药大学药代动力学研究室,安徽 合肥230031; 2.安徽省立医院药剂科,安徽 合肥230001)
摘要:目的建立反相高效液相色谱法(Reversed Phase High Performance Liquid Chromatography,RP-HPLC)测定人血浆中伏立康唑的浓度。方法Syncronis C18柱(5 μm,4.6 mm ×250 mm);流动相:0.025 mol·L-1磷酸二氢钾缓冲溶液pH=5.25(加三乙胺62.5 μL)∶乙腈∶甲醇=35∶45∶20;流速:1.0 mL·min-1;紫外检测波长260 nm;柱温:30 ℃,以酮康唑为内标,血浆样品经乙腈沉淀蛋白,20 μL进样检测。结果伏立康唑血浆浓度在0.2~10 mg·L-1范围内线性关系良好,LLOQ为0.2 mg·L-1,标准曲线为As=0.460 9C+0.0301(r2=0.999 6,n=5),低浓度、中浓度、高浓度的日内和日间变异RSD均小于7%,准确度范围为98%~103%,提取回收率在86%~95%。稳定性考察RSD<8%。结论本方法操作简便,灵敏度和准确度均较高,稳定性好,适用于伏立康唑血药浓度检测,为临床实施伏立康唑的个体化药物治疗提供依据。
关键词:色谱法,反相;伏立康唑;血药浓度
伏立康唑是一种临床疗效非常确切和使用较广泛的抗真菌药物,主要用于治疗严重的念珠菌和曲霉菌真菌感染[1-2]。与其他抗真菌药物相比,伏立康唑的抗菌谱较宽,抗菌活性强,已成为治疗深部真菌感染的一线药物[3-4]。虽然伏立康唑的抗菌谱广,有较高的抑菌活性,但体内代谢呈非线性药代动学力特性,个体差异较大,且其血药浓度受多种药物显著影响,如患者的性别、年龄、疾病、药物等非遗传因素,其中最主要的影响因素是转运及代谢酶的基因多态性,所以其临床疗效和不良反应具有显著个体差异,临床使用剂量难以把握[5]。同时,应用伏立康唑时可出现肝毒性、视觉障碍等不良反应,有研究通过对伏立康唑不良反应分析表明伏立康唑引起肝功能异常不良反应较高,可能与有较高的血药浓度和(或)剂量有关[6]。
患者体内药物浓度与其基因型的相关性研究是我们课题组主要研究方向之一。鉴于此,本文拟通过先建立伏立康唑的血药浓度反相高效液相色谱法(RP-HPLC)测定方法,来监测患者用药后血药浓度状况,为后期研究伏立康唑的血药浓度与CYP2C19的相关性奠定基础,为最终指导临床个体化使用伏立康唑提供依据。
1 仪器与试药
1.1仪器Thermo高效液相色谱仪(ultiMate 3000,赛默飞世尔科技(上海)有限公司);百色龙色谱数据工作站;VORTEX-5漩涡混合器;HC-2518高速离心机(安徽中科中佳科学仪器有限公司);ME204E电子天平(瑞士梅特勒)。
1.2试药伏立康唑(中国食品药品检定研究院,生产批号:100862-201402,纯度99.7%);酮康唑(中国食品药品检定研究院,生产批号:100294-201203,纯度99.4%);甲醇(色谱纯,OCEANPAK);乙腈(色谱纯,OCEANPAK);磷酸二氢钾(分析纯,国药集团化学试剂有限公司);三乙胺(分析纯,天津光复精细化工研究所);纯化水。
2 方法与结果
2.1色谱条件Syncronis C18柱(5 μm,4.6 mm ×250 mm);流动相:0.025 mol·L-1磷酸二氢钾缓冲溶液pH=5.25(加三乙胺62.5 μL)∶乙腈∶甲醇=35∶45∶20;流速1.0 mL·min-1;紫外检测波长260 nm;进样量20 μL。柱温:30 ℃。
2.2贮备液配制精确称量伏立康唑对照品0.010 g,用甲醇溶解后定容至刻度线,得到伏立康唑贮备液(浓度为1.0 g·L-1),临用前用甲醇稀释贮备液配置成标准工作液备用;精确称量酮康唑对照品0.012 g,用甲醇溶解后定容至刻度线,得到酮康唑贮备液(浓度为1.2 g·L-1)。
2.3血浆样品处理精密吸取200 μL血浆样品于1.5 mL EP管中,加入20 μL酮康唑对照品(50 mg·L-1),涡旋混匀1 min,加入300 μL乙腈沉淀蛋白,涡旋混匀3 min,然后14 000 r·min-1离心10 min,20 μL进样检测。
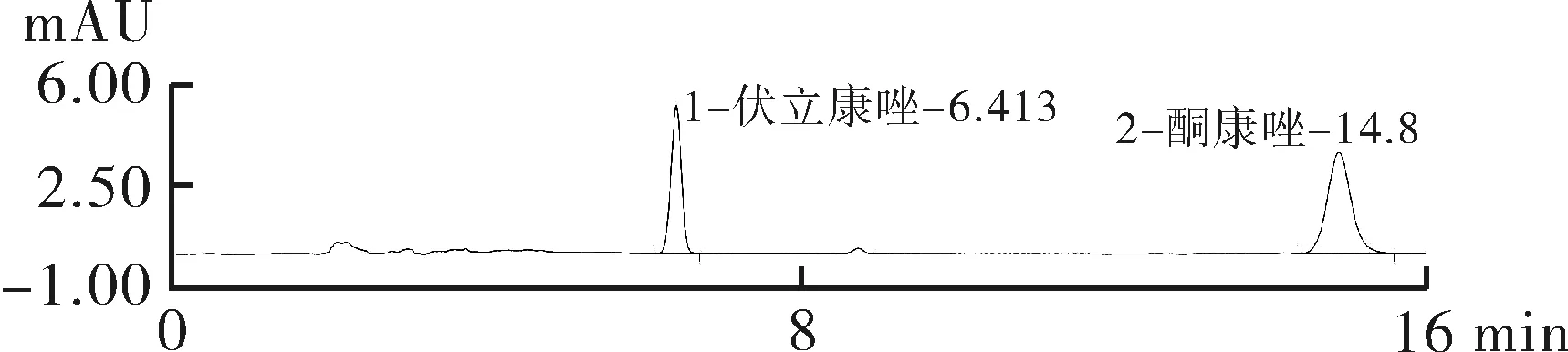
2.4专属性考察在本色谱条件下,伏立康唑和内标酮康唑分离度和拖尾因子均能满足要求且峰形较好,空白血浆无内源性杂质干扰,伏立康唑和酮康唑的保留时间(tR)分别为6.4 min和14.9 min,色谱图见图1。
2.5标准曲线及定量下限取180 μL空白血浆加入20 μL伏立康唑标准工作液液,配制成一系列浓度0.2、0.5、1.0、2.0、4.0、8.0、10 mg·L-1的血浆样品,按照2.3项下处理,20 μL进样检测。记录伏立康唑峰面积 A1 与酮康唑峰面积 A2,以血浆浓度(C)与峰面积比As(A1 / A2)作线性回归分析,得回归方程:As=0.460 9C+0.030 1(r2=0.999 6),LLOQ为0.2 mg·L-1,伏立康唑血浆浓度在0.2~10 mg·L-1范围内线性关系良好。

A
B

C

D
注:A.空白血浆色谱图, B.对照品色谱图(2 mg·L-1), C.空白血浆加药物色谱图(2 mg·L-1),D.患者色谱图。
图1伏立康唑色谱图
2.6精密度及准确度配制3批0.5、2.0、8.0 mg·L-13个浓度的血浆样品各5份,按照2.3项下处理,20 μL进样检测,1 d测定1批样品,连续测定3 d。计算日内和日间精密度及准确度。精密度的实测平均值代入回归方程得实测浓度与实际浓度的比值百分数即为准确度,结果见表1。

表1 伏立康唑精密度与准确度试验
2.7提取回收率配制0.5、2.0、8.0 mg·L-13个不同浓度的含药血浆样品各5份,按照2.3项下处理,20 μL进样检测,测得伏立康唑面积为A1。取180 μL空白血浆,按照2.3项下操作,取全部上清液于离心管中,再加20 μL低、中、高三种不同浓度对照品溶液各5份,然后加20 μL酮康唑内标溶液,混匀后进样检测,测得伏立康唑面积为A2。A1与A2比值百分数即为提取回收率,结果见表2。
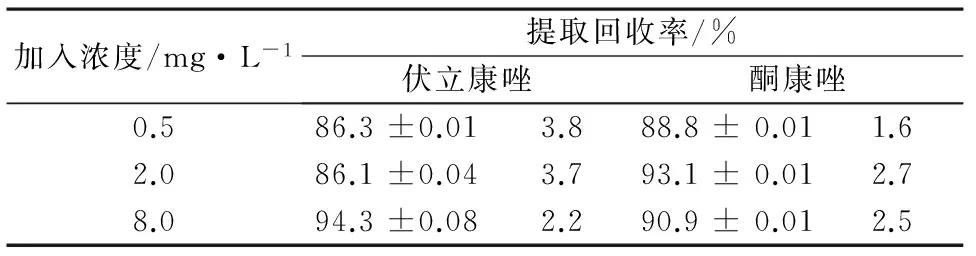
表2 伏立康唑提取回收率(n=5)
2.8稳定性考察
2.8.1反复冻融稳定性配制0.5、2.0、8.0 mg·L-13个不同浓度的血浆样品各5份,反复冻融3次后,按照2.3项下处理,20 μL进样检测,结果见表3。
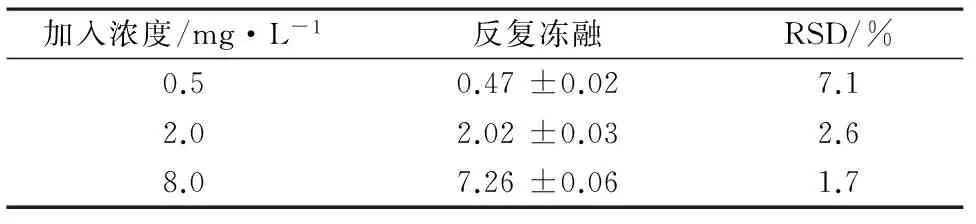
表3 伏立康唑反复冻融稳定性(n=5)
2.8.2室温放置稳定性配制0.5、2.0、8.0 mg·L-13个不同浓度的血浆样品各5份,按照2.3项下处理,分别放置0,12,24 h后测定分析,结果见表4。
2.8.3储备液稳定性将0.5、2.0、8.0 mg·L-13个浓度伏立康唑储备液与内标储备液放置在4℃冰箱,分别于第0、7、14天按照2.3项下处理,20 μL进样检测,结果见表5。
2.9临床应用共收集使用伏立康唑抗真菌治疗患者10例。给药方法为: 成人每次200 mg,q12h,静脉滴注或口服;儿童每次4 mg·kg-1,q12h静脉滴注或口服。临床结果评定标准:改善或缓解为临床有效; 症状持续存在或未改善为临床无效。应用上述建立的HPLC法检测真菌感染患者伏立康唑的血药谷浓度,10例患者平均血药谷浓度为(2.86±3.14)mg·L-1,其中有3例患者出现不良反应,4例患者使用伏立康唑治疗无效。
3 讨论
目前伏立康唑的血药浓度监测方法主要HPLC-MS和 HPLC等,因HPLC-MS成本较高,不适于常规开展伏立康唑的临床血药浓度监测。因此,本文通过优化HPLC相关方法条件,筛选出了最佳蛋白沉淀剂和优化了蛋白沉淀剂的体积;并通过加入三乙胺调整峰形,使其满足生物样品分析要求。通过查阅相关文献[7-10],发现多采用乙腈-磷酸盐缓冲溶液或水为流动相,但在实验中发现伏立康唑和酮康唑出峰条件均较差,选用乙腈-甲醇-磷酸盐缓冲溶液为流动相,用三乙胺调节PH在4.8~6.0之间,通过反复实验发现流动相的比例明显影响伏立康唑和酮康唑的出峰时间,磷酸盐缓冲溶液的pH显著影响峰形;最终通过摸索,确定以乙腈-甲醇-磷酸二氢钾缓冲溶液(pH=5.25)(45∶20∶35)为流动相。实验结果表明,在此条件下,伏立康唑和酮康唑能够与血浆中的杂质完全分离,不会出现拖尾现象,保留时间适中,能够满足临床大批量样本的监测分析。
此外,在血样处理方面,文献报道一般采用萃取法处理样品,样品预处理操作烦琐、耗时长、系统误差较大,而直接沉淀法则较为简单易行,更适合临床上样品的分析[8,11]。所以,本实验分别考察了甲醇、乙腈、15%高氯酸三种常用蛋白沉淀剂的沉淀效果,最终选择乙腈作为蛋白沉淀剂,通过优化最终选用1.5倍体积乙腈进行沉淀,蛋白沉淀较为彻底且回收率较高。
一些独立研究发现伏立康唑血浆谷浓度(Cmin)与临床疗效和不良反应的关系,如肝毒性和幻觉。基于不同的统计方法目标Cmin被确定最大限度地提高治疗反应和减少肝毒性。例如,有Meta分析表明伏立康唑Cmin范围是1.0~4.0 mg·L-1是最有效和安全的[12]。独立研究通过Logistic回归分析显示Cmin范围是1.7~5 mg·L-1[13]。本研究有3例患者出现不良反应,4例患者使用伏立康唑无效,故认为对伏立康唑进行血药浓度监测是有必要的。
综上所述,本研究建立的人血浆中伏立康唑的RP-HPLC测定方法灵敏度和准确度均较高,专属性强,分析快速,操作简便,符合生物样本分析要求,可满足临床血药浓度的常规监测需要,可为伏立康唑的血药浓度与CYP2C19基因型相关性研究奠定基础,为指导伏立康唑的临床个体化用药提供依据。

表4 样品处理后室温放置稳定性(n=5)
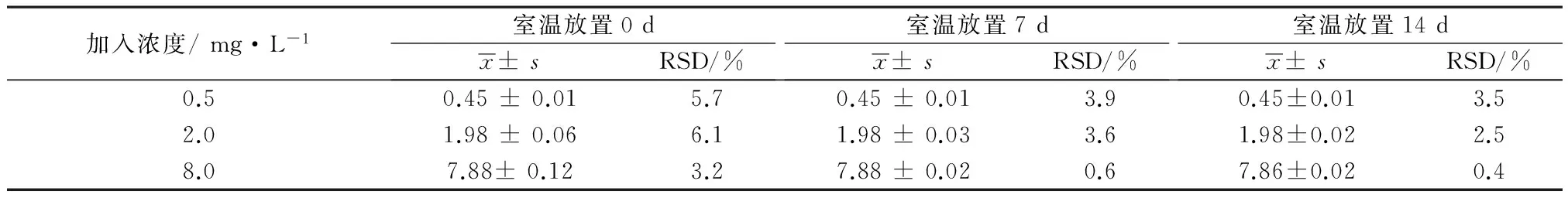
表5 伏立康唑储备液稳定性(n=5)
参考文献
[1]Li SX,Song YJ,Zhang LL,et al.An in vitro and in vivo study on the synergistic effect and mechanism of itraconazole or voriconazole alone and in combination with tetrandrine against Aspergillus fumigatus[J].J Med Microbiol,2015,64(9):1008-1020.
[2]Karthaus M,Lehrnbecher T,Lipp HP,et al.Therapeutic drug monitoring in the treatment of invasive aspergillosis with voriconazole in cancer patients-an evidence-based approach[J].Ann Hematol,2015,94(4):547-556.
[3]Oyake T,Kowata S,Murai K,et al.Comparison of micafungin and voriconazole as empirical antifungal therapies in febrile neutropenic patients with hematological disorders:a randomized controlled trial[J].Eur J Haematol,2015,7:28.
[4]Xue M,Gao X,Ferreira CN,et al.Cost analysis of voriconazole versus liposomal amphotericin B for primary therapy of invasive aspergillosis among high-risk hematologic cancer patients in Brazil[J].Value Health,2015,18(7):820.
[5]陈文瑛,黄思琪,谢白露,等.伏立康唑个体化给药研究新进展[J].中国医院药学杂志,2013,(14):1181-1184.
[6]朱萍,蒋正立.伏立康唑的不良反应综述[J].中国药业,2011,(23):95-96.
[7]Johnson HJ,Han K,Capitano B,et al.Voriconazole pharmacokinetics in liver transplant recipients[J].Antimicrob Agents Chemother,2010,54(2):852-9.
[8]肖翔林,银雪艳,孟冬梅,等.伏立康唑血药浓度的测定与方法学考察[J].抗感染药学,2014,11(4):292-294.
[9]Sangsiriwut K,Chayakulkeeree M.Rapid high performance liquid chromatographic assay for determination of voriconazole concentration in human plasma[J].J Med Assoc Thai,2013,96(Suppl 2):98-103.
[10] Gomez-Lopez A,Cendejas-Bueno E,Cuesta I,et al.Voriconazole serum levels measured by high-performance liquid chromatography:a monocentric study in treated patients[J].Med Mycol,2012,50(4):439-445.
[11] 李顺炜,袁孔现,朱虹,等.反相高效液相色谱法测定血液中去甲万古霉素浓度的研究[J].安徽医药,2015,19(8):1470-1473.
[12] Hamada Y,Seto Y,Yago K,et al.Investigation and threshold of optimum blood concentration of voriconazole:a descriptive statistical meta-analysis[J].J Infect Chemother,2012,18(4):501-507.
[13] Dolton MJ,Ray JE,Chen SC,et al.Multicenter study of voriconazole pharmacokinetics and therapeutic drug monitoring[J].Antimicrob Agents Chemother,2012,56(9):4793-4799.
基金项目:安徽省软科学研究计划基金资助项目(12020503083),安徽中医药大学研究生科技创新基金项目(201506)
通信作者:史天陆,男,主任药师,硕士生导师,研究方向:药物代谢动力学,E-mail:tianlu828@163.com
doi:10.3969/j.issn.1009-6469.2016.07.015
(收稿日期:2016-02-23,修回日期:2016-04-08)
Determination of voriconazole in human plasma by RP-HPLC
LI Yu1,2,ZHANG Lei1,DENG Mingying1,et al
(1.PharmacokineticsLaboratory,AnhuiUniversityofTraditionalChineseMedicine,Hefei,Anhui230031,China;2.DepartmentofPharmacy,AnhuiProvincialHospital,Hefei,Anhui230001,China)
Abstract:ObjectiveTo establish RP-HPLC method for the determination of voriconazole in human plasma.MethodsSyncronis C18column(5 μm,4.6 mm×250 mm) was adopted.The mobile phase was 0.025 mol·L-1potassium dihydrogen phosphate buffer solution(pH = 5.25,added with triethylamine 62.5 μL) and acetonitrile and methanol( 35∶45∶20).The flow rate was 1.0 mL·min-1,the detection wavelength was 260 nm,and the column temperature was 30℃.Ketoconazole was used as internal standard,20 μL injected directly after plasma samples were extracted by acetonitrile.ResultsA linearity was obtained within the range of voriconazole concentrations from 0.2 to 10 mg·L-1.LLOQ was 0.2 mg·L-1.The standard curve was As=0.460 9C+0.030 1(r2=0.999 6,n=5).The intra-day and inter-day RSD were less than 7%.The accuracy of voriconazole was between 98% and 103%,and the extraction recoveries of voriconazole was between 86% and 95%.The stable inspection RSD was less than 8%.ConclusionThe method was simple,high sensitive,accurate,and well stable for the determination of voriconazole in human plasma,which provided a basis for individualized voriconazole treatment.
Key words:Chromatography,Reverse-Phase;voriconazole;PLASMA CONCENTRATION
