春季东印度洋次表层亚硝酸盐最大值的分布特征及影响因素*
2016-08-12张文全王保栋韦钦胜王子成
张文全,王保栋,韦钦胜,孙 霞,辛 明,王子成
(国家海洋局 第一海洋研究所,山东 青岛266061)
春季东印度洋次表层亚硝酸盐最大值的分布特征及影响因素*
张文全,王保栋*,韦钦胜,孙霞,辛明,王子成
(国家海洋局 第一海洋研究所,山东 青岛266061)
根据2013年春季东印度洋现场调查资料,研究了次表层亚硝酸盐最大值的空间分布特征及其形成机制。结果表明,春季东印度洋次表层亚硝酸盐最大值(PNM)一般位于75~100 m水层中,且呈现斑块状分布,在赤道附近PNM所处深度较深,随着南北纬度的增加,PNM水深相应抬升。PNM位于温密跃层/营养盐跃层的中上部,且与次表层叶绿素最大值层(SCM)存在显著的相关关系。在深度上,PNM一般位于SCM层内下半部,且PNM深度随SCM深度的增加而增加;在量值上,PNM量值与同层叶绿素a质量浓度呈现显著正相关关系。结合PNM的影响因素分析,认为东印度洋PNM主要是源自浮游植物的释放。
东印度洋;亚硝酸盐;空间分布;次表层亚硝酸盐最大值(PNM);影响因素
亚硝酸盐是硝酸盐和铵盐转化的中间体,是海水溶解无机氮中量最少的组分,其总量不足全球海洋固定总氮库存(6.6×1011t)的0.025%[1],但海洋中亚硝酸盐浓度的动态变化能为海洋生物地球化学过程的研究提供重要信息,尤其是在研究海洋氮循环和营养盐动力学中,亚硝酸盐是不可或缺的载体之一。调查研究表明,在近海和大洋的层化区域,真光层底部亚硝酸盐浓度通常达到一个极大值,而在更浅或更深的水层亚硝酸盐的浓度接近于零[2]。此现象被称为次表层亚硝酸盐最大值,又称第一亚硝酸盐最大值(Primary Nitrite Maximum,PNM)[3-4]。早在20世纪30年代,Gilson在阿拉伯海首次报道了亚硝酸盐最大值现象[5],50—60年代先后在东北太平洋和南太平洋广大海域以及马尾藻海观测到PNM现象[6-8],近30 a来对PNM的观测与研究更是呈现热点化[9-11],众多观测研究表明,PNM是近海和大洋中一个普遍存在的现象。
虽然对PNM现象的研究报道众多,但其形成机制问题仍一直是人们争论的焦点。一种观点认为,在真光层的底部由于光强较弱,浮游植物吸收硝酸盐后不能将其完全还原为氨,只能不完全还原为亚硝酸盐并释放至水体中,在真光层的底部区域累积而形成PNM。半个世纪前Rakestraw和Vaccaro等就提到了PNM现象中浮游植物在亚硝酸盐来源中的重要性[8,12]。Brandhorst及Wooster等人先后在东北太平洋和南太平洋广大海域观测到PNM并发现其分布和形成与叶绿素存在着一定的关系[6-7],但直到Kiffer等提出的模型试验才证明浮游植物在形成PNM中起着重要作用及其有效性[13]。后来French等人通过观察墨西哥湾PNM现象中亚硝酸盐的昼夜变化重现了浮游植物释放亚硝酸盐对形成PNM的重要作用[14];Zafiriou和Lipschultz等人通过观察马尾藻海的PNM现象及数据分析,也认为浮游植物对亚硝酸盐的排泄是PNM形成的主要原因[15-16]。本世纪在红海的观测研究以及阿卡巴湾相关要素的昼夜变化分析,均认为浮游植物对PNM的形成起着重要作用[10,17]。
热带东印度洋位于阿拉伯海东南部、孟加拉湾以南、苏门答腊岛的西面、10°S以北,包括赤道印度洋东侧及其南部相关海域,通过马六甲海峡和安达曼海与南中国海相通,既是印度洋-太平洋暖池的重要组成部分,也是海上的关键运输要道。我们根据春季东印度洋的调查数据,通过分析PNM的空间分布特征及其与次表层叶绿素最大值(SCM)、温密跃层和营养盐等因素的关系,对春季东印度洋PNM现象的形成机制进行探讨。
1 调查与方法
我们的数据源自2013-03—05国家海洋局第一海洋研究所科研人员在东印度洋南部水体综合调查春季航次的调查实测数据,该航次在东印度洋海域布设了3条东西断面(I04,I05和I06)和1条南北断面(I07)总共4条断面88个站位(图1)。
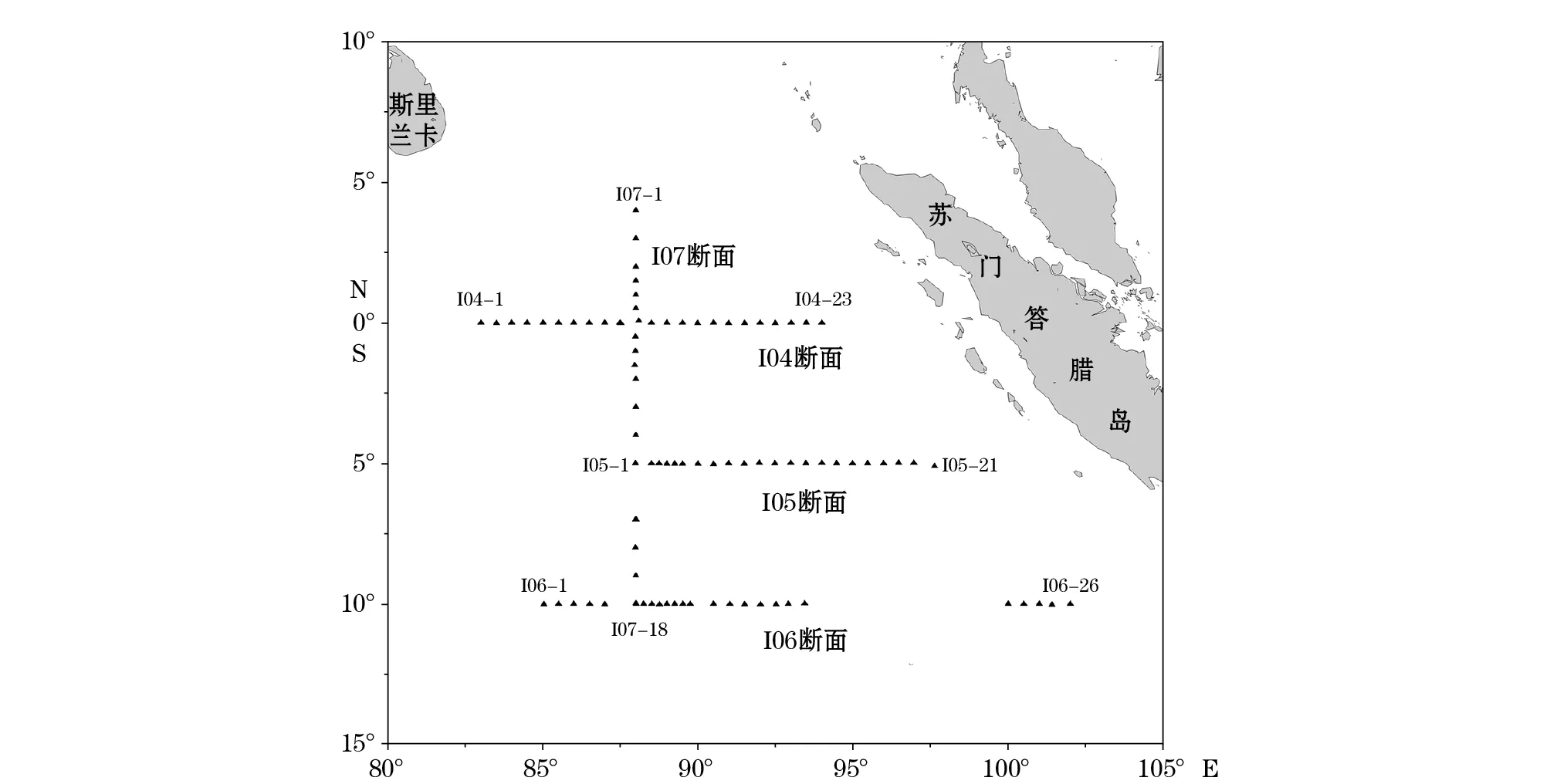
图1 东印度洋海域调查站位(▲)Fig.1 Sampling stations(▲) in the East Indian Ocean in the spring 2013
海水温度、盐度由SBE-911直读式CTD进行现场测定。各个水层的水样通过悬挂在CTD周围的Niskin采水器采集,采样层次分别为2,30,75,100,150和300 m。营养盐样品按照《海洋调查规范》规定的方法[28],经0.45 μm的醋酸纤维素滤膜(体积分数为1%的稀盐酸浸泡24 h后用Mili-Q水冲洗至中性)过滤后,用分光光度计现场测定。叶绿素a采用萃取荧光法,每个水层的样品经0.45 μm GF/F膜过滤,滤膜冷冻保存,经丙酮和水体积比为9∶1的溶液萃取24 h 后,用Turner-Designs荧光计进行测定。
2 结果与讨论
2.1PNM的空间分布特征
在上混合层(0~30 m),亚硝酸盐浓度普遍小于0.1 μmol/L,大多接近检出限或未检出;在温密跃层以下(>150 m),亚硝酸盐浓度普遍小于0.1 μmol/L;但在次表层(75~100 m)普遍存在PNM现象(图2),并且在该层次内亚硝酸盐浓度最小值在0.1 μmol/L左右,所以我们在此以亚硝酸盐浓度>0.1 μmol/L为PNM的统计标准,统计得到春季东印度洋南部水体PNM现象的出现频率为90%,调查海域PNM呈现斑状分布。
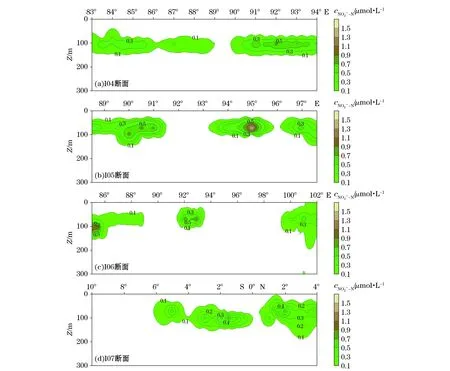
图2 春季东印度洋亚硝酸盐的断面分布Fig.2 Vertical profiles of PNM in the East Indian Ocean in spring
春季东印度洋PNM的分布呈现空间差异。I04断面东印度洋赤道附近,PNM的位置相对较深,均在100 m左右,断面东段量值相对较大(>0.5 μmol/L)。I05断面PNM的深度比I04断面的总体上略浅,均在75 m左右,但在90°E与97°30′E附近,PNM深度仍然处在100 m左右。I06断面两端PNM深度均能达到100 m,而在靠近断面中间位置(92°E附近)PNM的位置较浅,约为75 m。但在南北方向上,PNM总体呈现着特定的空间分布规律:随着南北纬度的增加,PNM位置逐渐抬升,并且量值逐渐减小,出现PNM现象的频率亦有所减小。I07断面的PNM分布图可进一步反映出其在赤道南北海域空间分布的差异,赤道附近PNM位置较深(接近100 m),而随着自赤道向南北两端的扩展,PNM位置有逐渐抬升的迹象。
2.2PNM与温密跃层及营养盐跃层的关系
东印度洋上层各化学要素的分布与水文状况密切相关。春季东印度洋南部水体温度的垂直分布趋势大致相同,典型站位温度的垂直分布(图3)显示出,自表层到300 m水深,温度有逐渐减小的趋势,一般表层温度大于28 ℃,300 m水深温度小于12 ℃。在80~120 m等温线较为密集,形成较强的温跃层。
由典型站位垂直分布(图3)表明,春季东印度洋海水层化现象明显,营养盐跃层(硝酸盐、磷酸盐、硅酸盐)与密度跃层一致。PNM位于密度跃层和营养盐跃层内,且位于其层内中部或上界略下,营养盐作为浮游植物进行光合作用的重要化学要素,它们量的多寡可以直接影响着浮游植物的生长繁殖,在营养盐跃层的中上部,那里硝酸盐浓度较上混合层明显增大,足以支持浮游植物的生长、乃至形成次表层叶绿素最大值(SCM)。
亚硝酸盐的产生速率必须大于物理扩散速率才能形成PNM,因此物理扰动扩散常常限制亚硝酸盐的积聚[29-31],而春季东印度洋海水强烈层化现象可减小这种限制,使亚硝酸盐可以最大程度地聚集在温密跃层及营养盐跃层以内,对于维持PNM起着重要作用。

图3 典型站位(I05-8和I07-11)PNM与温度、密度和营养盐跃层的关系Fig.3 Vertical distributions of temperature, density and nutrients at typical St. I05-8 and St. I07-11
2.3PNM与SCM的关系
春季东印度洋PNM与SCM具有密切的关系(图4)。在深度上,PNM深度随着SCM深度的增加而增加。在赤道附近,SCM位置较深;随着赤道向南北两端海域扩展,SCM深度逐渐变浅,而PNM深度的分布具有与SCM很好的跟进性。图5也能很好地说明这一规律:I05-8站位SCM所处深度为75 m左右,PNM相应深度在75 m左右;I07-11站位SCM所处深度为75 m左右,PNM所处深度在100 m左右。虽然PNM具有对SCM的“追随”效应[32],且有时两者在同一水层位置出现,但PNM层一般位于SCM层的下半部。
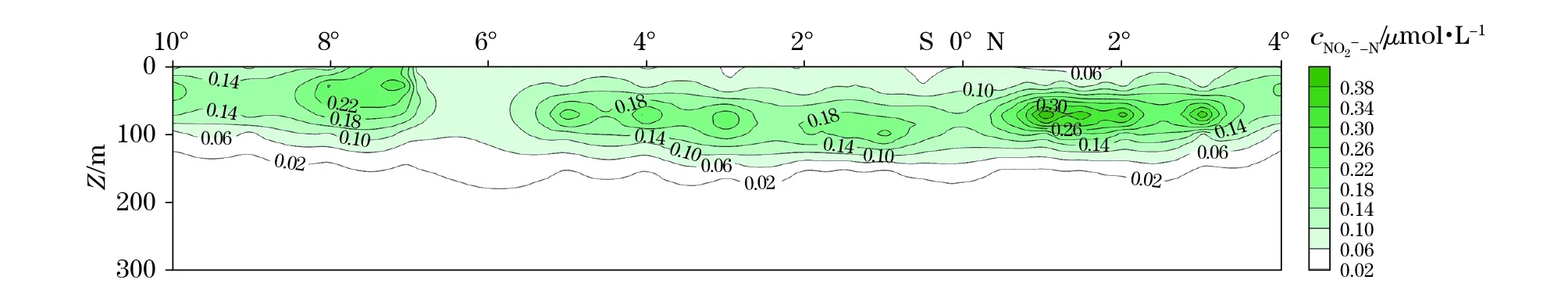
图4 春季东印度洋I07断面SCM的断面分布图Fig.4 Vertical profiles of SCM in section I07 in the East Indian Ocean in spring

图5 典型站位(I05-8和I07-11)亚硝酸盐浓度和叶绿素a质量浓度垂直分布Fig.5 Vertical distributions of nitrite and chlorophyll a at typical St. I05-8 and St. I07-11
在量值关系上,PNM层中亚硝酸盐最大值与同深度叶绿素a质量浓度呈显著的正相关关系(图6),这说明PNM的量值在一定程度上受浮游植物生长的控制。此外,100 m水层PNM与叶绿素a的相关关系明显好于75 m水层,可能是在较深的低光照、高硝酸盐的环境中,浮游植物吸收硝酸盐转化为铵盐的能量不足,导致中间代谢产物亚硝酸盐的释放速率增大。
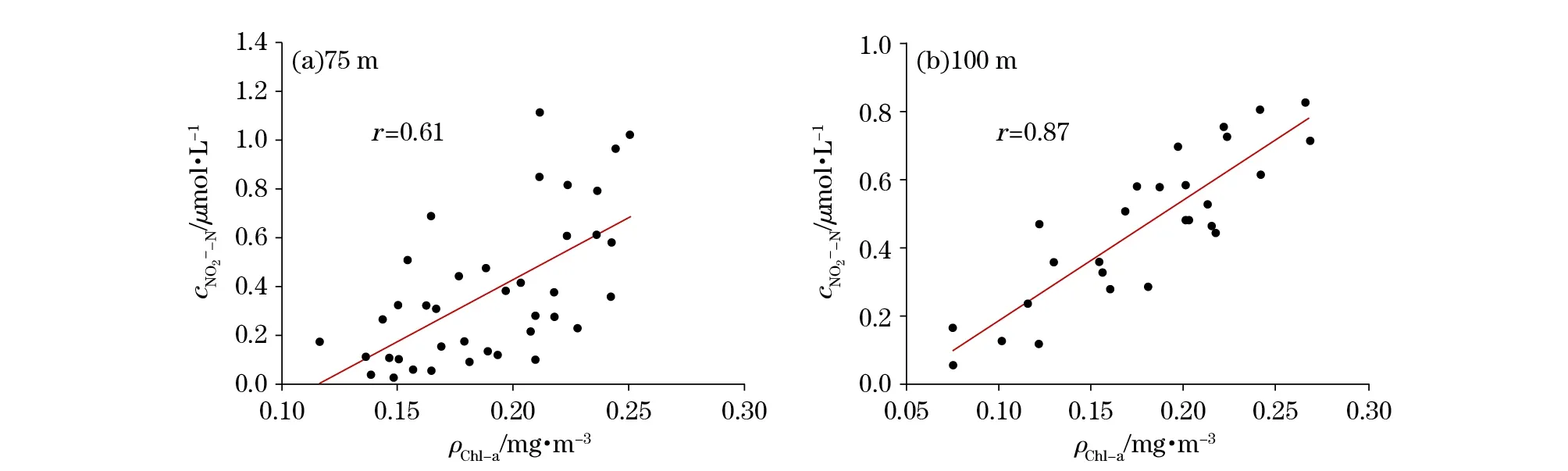
图6 春季东印度洋75 m和100 m水层PNM与对应的叶绿素a的关系Fig.6 Relationship between nitrite maximum and corresponding chlorophyll a at 75 m and 100 m
2.4PNM的形成机制
大洋海水中亚硝酸盐的来源一般有2个途径:1)在氨氧化细菌(AOB)的作用下将氨氧化为亚硝酸盐;2)硝酸盐还原为亚硝酸盐的反应,可通过浮游植物对吸收的硝酸盐的不完全还原,或硝酸还原细菌对水体中硝酸盐的还原来完成。但后者只有在厌氧环境(如海洋中氧最小值层,即OMZ)中才可能发生,这也就是第二亚硝酸盐最大值(SNM)的形成机制[33-35]。但是春季东印度洋OMZ深度在200 m左右,而PNM深度在75~100 m区域,所以PNM的形成不是硝酸还原细菌对硝酸盐的还原所致。因此,大洋上层PNM层中亚硝酸盐的来源主要是氨氧化细菌(AOB)作用下的氨氧化或浮游植物的排泄释放。
PNM一般位于营养盐跃层的中上部,那里营养盐(硝酸盐和磷酸盐)浓度较上混合层明显增大,足以支持浮游植物的生长。其次,春季东印度洋的真光层厚度在100 m左右,PNM深度(75~100 m)恰好位于真光层的底部区域,由于该区域光强较弱,浮游植物吸收的硝酸盐不能被完全还原为铵盐,导致中间代谢产物亚硝酸盐的产生速率增大进而形成释放积聚现象。再者,从PNM与叶绿素a关系来看,PNM总是随SCM深度的变化而变化,PNM深度与SCM水层有着很好的跟进性;更重要的是,PNM量值与同层叶绿素a质量浓度之间呈现显著正相关关系,这说明PNM的量值在一定程度上受浮游植物生长的控制,这些都为浮游植物是形成与维持PNM的观点提供了有力证据。综上所述,在光强较弱的真光层底部区域,浮游植物吸收硝酸盐后进行不完全还原为亚硝酸盐并释放,进而在温密跃层中累积而形成PNM。
3 结 论
春季东印度洋存在明显的PNM现象,其分布特征:PNM呈现斑状分布,赤道附近PNM水层深度较大,随着南北纬度的增加,PNM水深相应抬升。春季东印度洋PNM出现在温密跃层及营养盐跃层内,温密跃层的存在限制了亚硝酸盐的物理扩散。研究海域PNM与SCM关系密切:在深度上,PNM具有对SCM的“追随”效应;在量值上,PNM量值与同深度叶绿素a质量浓度呈显著的正相关关系。温密跃层/营养盐跃层深度、SCM深度及量值变化和光照条件是春季东印度洋PNM的主要影响因素。
[1]GRUBER N. The marine nitrogen cycle: overview and challenges-nitrogen in the marine environment (2nd ed)-Chapter 1[J].Nitrogen in the Marine Environment, 2008,(31):1-50.
[2]LOMAS M W, LIPSCHULTZ F. Forming the primary nitrite maximum: Nitrifiers or phytoplankton[J].Limnology and Oceanography, 2006, 51(5): 2453-2467.
[3]OLSON R J. N-15 tracer studies of the primary nitrite maximum[J].Journal of Marine Research, 1981, 39(2): 203-226.
[4]DORE J E, KARL D M. Nitrification in the euphotic zone as a source for nitrite, nitrate, and nitrous oxide at Station ALOHA[J].Limnology and Oceanography, 1996, 41(8): 1619-1628.
[5]GILSON H C. The nitrogen cycle∥The John Murray Expedition, 1933-1934[M].London: British Museum (Natural History), 1937: 21-81.
[6]BRANDHORST W. Nitrification and denitrification in the eastern tropical North Pacific[J].Journal du Conseil, 1959, 25(1): 3-20.
[7]WOOSTER W S, CHOW T J, BARRETT I. Nitrite distribution in Peru Current waters[J].Journal of Marine Research, 1965, 23(3): 210-221.
[8]VACCARO R F, RYTHER J H. Marine phytoplankton and the distribution of nitrite in the sea[J].Journal du Conseil, 1960, 25(3): 260-271.
[9]COLLOS Y, SLAWYK G. Ammonium and nitrate in the tropical and equatorial Atlantic: relations with the primary nitrite maximum[J].Marine Biology Letters, 1983, 4(5): 295-308.
[10]MACKEY K R M, BRISTOW L, PARKS D R, et al. The influence of light on nitrogen cycling and the primary nitrite maximum in a seasonally stratified sea[J].Progress in Oceanography, 2011, 91(4): 545-560.
[11]SANTORO A E, SAKAMOTO C M, SMITH J M, et al. Measurements of nitrite production in and around the primary nitrite maximum in the central California Current[J].Biogeosciences, 2013, 10(11): 7395-7410.
[12]RAKESTRAW N W. The occurrence and significance of nitrite in the sea[J].Biological Bulletin, 1936: 133-167.
[13]KIEFER D A, OLSON R J, HOLM-HANSEN O, et al. Another look at the nitrite and chlorophyll maxima in the central North Pacific[J].Deep Sea Research and Oceanographic Abstracts, 1976, 23(12): 1199-1208.
[14]FRENCH D P, FURNAS M J, SMAYDA T J. Diel changes in nitrite concentration in the chlorophyll maximum in the Gulf of Mexico[J].Deep Sea Research Part A. Oceanographic Research Papers, 1983, 30(7): 707-722.
[15]ZAFIRIOU O C, BALL L A, HANLEY Q. Trace nitrate in oxic waters[J].Deep Sea Research Part A: Oceanographic Research Papers, 1992, 39(7): 1329-1347.
[16]LIPSCHULTZ F. Nitrogen-specific uptake rates of marine phytoplankton isolated from natural populations of particles by flow cytometry[J].Marine Ecology Progress Series, 1995, 123(1): 245-258.
[17]Al-QUTOB M, HASE C, TILZER M M, et al. Phytoplankton drives nitrite dynamics in the Gulf of Aqaba, Red Sea[J].Marine Ecology Progress Series, 2002, 239: 233-239.
[18]FRANCIS C A, ROBERTS K J, BEMAN J M, et al. Ubiquity and diversity of ammonia-oxidizing archaea in water columns and sediments of the ocean[J].Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(41): 14683-14688.
[19]KONNEKE M, BERNHARD A E, JOSE R, et al. Isolation of an autotrophic ammonia-oxidizing marine archaeon[J].Nature, 2005, 437(7058): 543-546.
[20]MURRAY A E, BLAKIS A, MASSANA R, et al. A timeseries assessment of planktonic archaeal variability in the Santa Barbara Channel[J].Aquatic Microbial Ecology, 1999, 20: 129-145.
[21]WADA E, HATTON A. Nitrite metabolism in the euphotic layer of the euphotic layer of the central north pacific ocean[J].Limnology and Oceanography, 1971, 16(5): 766-772.
[22]OLSON R J. Differential photoinhibition of marine nitrifying bacteria: a possible mechanism for the formation of the primary nitrite maximum[J].Journal of Marine Research, 1981, 39(2): 227-238.
[23]HORRIGAN S G, CARLUCCI A F, WILLIAMS P M. Light inhibition of nitrification in sea-surface films[J].Journal of Marine Research, 1981,39(3): 557-565.
[24]COLLOS Y. Nitrate uptake, nitrite release and uptake, and new production estimates[J].Marine Ecology Progress Series, 1998, 171: 293-301.
[25]WOODWARD E M S, REES A P. Nutrient distributions in an anticyclonic eddy in the northeast Atlantic Ocean, with reference to nanomolar ammonium concentrations[J].Deep Sea Research Part II: Topical Studies in Oceanography, 2001, 48(4): 775-793.
[26]GUERRERO M A, JONES R D. Photoinhibition of marine nitrifying bacteria I. Wavelength-dependent response[J].Marine Ecology Progress Series, 1996, 141(1): 183-192.
[27]NEWELL S E, BABBIN A R, JAYAKUMAR A, et al. Ammonia oxidation rates and nitrification in the Arabian Sea[J].Global Biogeochemical Cycles, 2011, 25(4): 271-284.
[28]Specification for Oceanographic Survey: Part 4 Survey of chemical parameters in sea waterGB/T 12763.4-2007[S].Beijing: China Standards Press , 2007. 海洋调查规范:第4部分海洋化学要素调查GB/T 12763.4-2007[S].北京:中国标准出版社,2007.
[29]KUYPERS M M M, SLIEKERS A O, LAVIK G, et al. Anaerobic ammonium oxidation by anammox bacteria in the Black Sea[J].Nature, 2003, 422(6932): 608-611.
[30]DUSENBERRY J A, OLSON R J, CHISHOLM S W. Frequency distributions of phytoplankton single-cell fluorescence and vertical mixing in the surface ocean[J].Limnology and Oceanography, 1999, 44(2): 431-435.
[31]PLANAS D, AGUSTI S, DUARTE C M, et al. Nitrate uptake and diffusive nitrate supply in the Central Atlantic[J].Limnology and Oceanography, 1999, 44(1): 116-126.
[32]CULLEN J J, EPPLEY R W. Chlorophyll maximum layers of the Southern-California Bight and possible mechanisms of their formation and maintenance[J].Oceanologica Acta, 1981, 4(1): 23-32.
[33]GRUBER N, SARMIENTO J L. Global patterns of marine nitrogen fixation and denitrification[J].Global Biogeochemical Cycles, 1997, 11(2): 235-266.
[34]CODISPOTI L A, PACKARD T T. Denitrification rates in the eastern tropical South-Pacific[J].Journal of Marine Research, 1980, 38(3): 453-477.
[35]DEVOL A H, UHLENHOPP A G, NAQVI S W A, et al. Denitrification rates and excess nitrogen gas concentrations in the Arabian Sea oxygen deficient zone[J].Deep Sea Research Part I: Oceanographic Research Papers, 2006, 53(9): 1533-1547.
Spatial Distribution of Primary Nitrite Maximum and Its Influencing Factors in the East Indian Ocean in Spring
ZHANG Wen-quan, WANG Bao-dong, WEI Qin-sheng, SUN Xia, XIN Ming, WANG Zi-cheng
(TheFirstInstituteofOceanography,SOA, Qingdao 266061, China)
Based on the multi-disciplinary investigation in the East Indian Ocean in spring of 2013, the characteristics of nitrite spatial distribution in the upper water column and the formation mechanism of Primary Nitrite Maximum (PNM) were studied. The results showed that the pattern of PNM appeared in a manner of patch distribution in the water depth of 75~100 m in spring. The PNM layer was deeper in the area around the equator and its depth rose accompaning with the increase of latitude towards the south or the north. Furthermore, the PNM usually located in the upper boundary of the pycnocline and nutricline presenting a significantly positive correlation with the depth of Subsurface Chlorophyll Maximum(SCM). On the other hand, the depth of PNM was deeper with the increased depth of SCM in vertical distribution and the magnitude of PNM was significantly and positively correlated with the chlorophyll a concentration in the same layer. The analysis in combination with environmental factors of PNM suggested that the PNM in the East Indian Ocean was mainly released from the phytoplankton in spring.
East Indian Ocean; nitrite; spatial distribution; Primary Nitrite Maximum(PNM); influence factor
February 3, 2016
2016-02-03资助项目:全球变化与海气相互作用专项——东印度洋南部水体综合调查春季航次(GASI-03-01-02-01)
张文全(1987-), 男, 山东郓城人, 硕士研究生, 主要从事生源要素海洋生物地球化学方面研究.
王保栋(1964-),男,山东高密人,研究员,博士,主要从事海洋生物地球化学方面研究. E-mail:wangbd@fio.org.cn
(高峻编辑)
P734.4
A
1671-6647(2016)03-0403-08
10.3969/j.issn.1671-6647.2016.03.010
