四溴双酚A(TBBPA)对叉鞭金藻的毒性效应研究*
2016-08-12于延珍孙承君蒋凤华
于延珍,张 丽,2,曹 为,郑 立,3,孙承君,3,蒋凤华*
(1. 国家海洋局 第一海洋研究所海洋生态研究中心,山东 青岛 266061;2. 山东省科学院海洋仪器仪表研究所,山东 青岛 266001;3. 青岛海洋科学与技术国家实验室 海洋生态与环境科学功能实验室,山东 青岛 266237)
四溴双酚A(TBBPA)对叉鞭金藻的毒性效应研究*
于延珍1,张丽1,2,曹为1,郑立1,3,孙承君1,3,蒋凤华1*
(1. 国家海洋局 第一海洋研究所海洋生态研究中心,山东 青岛 266061;2. 山东省科学院海洋仪器仪表研究所,山东 青岛 266001;3. 青岛海洋科学与技术国家实验室 海洋生态与环境科学功能实验室,山东 青岛 266237)
以叉鞭金藻(Dicrateriainornata)为研究对象,分析了不同质量浓度四溴双酚A(TBBPA)污染下微藻光合色素含量、可溶性蛋白含量、超氧化物歧化酶(SOD)活性和丙二醛(MDA)含量,以及细胞形态和细胞内部结构的变化。研究结果显示:在TBBPA较低质量浓度(0.5和2.0 mg/L)污染条件下,叉鞭金藻的叶绿素a(Chl-a)、叶绿素c(Chl-c)和类胡萝卜素(Car)含量显著高于对照组,其含量第24小时达最大值;较高质量浓度(4.0和8.0 mg/L)污染条件下,3种色素含量则显著低于对照组,其含量在第24小时达最小值。实验期间各实验组叉鞭金藻的可溶性蛋白含量、SOD活性和MDA含量主要被诱导;4.0 mg/L的TBBPA作用叉鞭金藻96 h后,藻细胞表面形态和内部亚显微结构均发生变化,与光合色素含量降低、MDA含量增加相一致。
叉鞭金藻;四溴双酚A;光合色素;可溶性蛋白;SOD;MDA
四溴双酚A(Tetrabromobisphenol A,TBBPA)是目前市场上全球产量最大的含溴阻燃剂之一,通常被用作环氧树脂、不饱和聚氧脂、纺织品和泡沫等材料的阻燃剂。据报道,我国每年制造含有TBBPA的产品高达7 500 t[1]。溴化阻燃剂可以通过渗出或者挥发等方式进入到环境中,能够吸附到沉积物和土壤的表面,很容易通过地表径流和大气湿沉降等方式进入河口和海洋,成为土壤和水环境污染关注的焦点[2]。空气、沉积物、海洋生物体内以及水中等均已发现TBBPA的存在[3-6]。TBBPA所具有的亲脂性、难降解性和高富集性等特点,进入海洋后会通过生物富集和放大作用影响海洋生物体的正常生理活动。近年来有关TBBPA的毒理学研究报道主要集中在对水生动物的毒性研究方面,结果表明TBBPA具有甲状腺干扰效应[7-9],可以抑制斑马鱼胚胎的发育并降低幼年斑马鱼的存活率[10]。
微藻作为初级生产者参与海洋食物链和食物网的构建,其种类多样性和生物量影响着海洋生态系统结构的稳定性及功能[11]。微藻具有污染毒物敏感、繁殖快和对毒性物质敏感等特点,将其用于污染物毒性研究可在较短时间内得到污染物对其种群及世代的影响,因而常被选为毒性测试生物[12]。本文以常见饵料藻叉鞭金藻(Dicrateriainornata)为实验生物进行TBBPA污染胁迫实验,分析光合色素含量、可溶性蛋白含量、超氧化物歧化酶(Superoxide Dismutase,SOD)活性及丙二醛(Malondialdehyde,MDA)含量在96 h之内的变化情况,结合细胞形态和细胞器的变化,探讨TBBPA对叉鞭金藻的毒性效应,从而为TBBPA的海洋生态毒性评价和污染效应研究等提供基础资料。
1 材料与方法
1.1实验微藻的培养
试验用叉鞭金藻(Dicrateriainornata)由国家海洋局第一海洋研究所提供。海水取自青岛石老人附近近岸海域,经0.45 μm滤膜过滤后煮沸消毒,冷却后配制f/2培养液用于微藻培养实验。以白色日光灯作为光源,光暗比为12 h∶12 h,光强约为4 500 lx,培养温度为(20±0.2) ℃。先用1∶5的HCl浸泡处理培养实验的三角瓶,然后超纯水洗净,最后蒸汽(121 ℃,15 min)灭菌。培养期间每天定时人工摇动三角瓶3次,并随机调换位置以尽可能使光照均匀。
1.2TBBPA胁迫实验
根据前期实验结果,TBBPA对叉鞭金藻的96 h NOEC(96 h无可观测效应浓度)是1.0 mg/L,96 h-EC50(96 h半最大效应浓度)是5.71 mg/L[13],在本实验中设置的TBBPA质量浓度分别为对照,0.5,2.0,4.0和8.0 mg/L。以二甲基亚砜(DMSO)为助溶剂配制TBBPA母液,以f/2培养液稀释至实验浓度。对照组为含有0.2%(V/V)DMSO的培养液(该浓度下DMSO对于叉鞭金藻的生长无显著效应)。
在第0,12,24,48,72和96小时时取样,第0小时取6个平行,其余时间每个质量浓度取3个平行,因而将处于指数生长期的叉鞭金藻分别接种于81个250 mL三角瓶中。初始细胞密度为1×105~2×105个/mL,加入f/2培养液定容至150 mL。样品处理时,其中1 mL藻液加入鲁格试剂固定,显微镜计数法测定藻细胞密度;10 mL藻液离心(6 000 r/min,10 min)收集藻细胞,-80 ℃保存,用于测定光合色素含量;其余样品离心(6 000 r/min,10 min)收集藻细胞,-80 ℃保存,用于测定可溶性蛋白含量、SOD活性和MDA含量。
将处于指数生长期的叉鞭金藻同时接种于4个1 L三角瓶中,定容至800 mL,在同样条件下培养96 h后,离心(3 000 r/min,5 min)收集藻细胞,进行细胞形态和亚显微结构观测。
1.3光合色素含量的测定
测定光合色素的藻细胞加入5 mL 90%丙酮溶液,振荡混匀,置于黑暗低温处(4 ℃)24 h,然后离心(6 000 r/min,10 min),以90%丙酮溶液作为参比,测定上清液在440,630,644,662,664和750 nm波长处的吸光值,计算叶绿素a(Chl-a)、叶绿素c(Chl-c)和类胡萝卜素(Car)的浓度[14],并换算为单位细胞密度下的浓度。
1.4粗酶液的制备及酶活性的测定
将藻细胞悬浮于预冷的2 mL磷酸盐缓冲液中,冰浴下超声波破碎5 min (工作3 s,间歇5 s),离心(4 ℃,6 000 r/min,10 min),上清液即为粗酶液,-80 ℃保存。
以牛血清蛋白为标准,采用考马斯亮蓝G-250法测量可溶性蛋白含量。SOD活性和MDA含量分别采用SOD试剂盒(A001-1)和MDA试剂盒(A003-1) (南京建成生物工程研究所)进行测量,其操作过程严格按照说明进行,最后将结果换算为单位细胞密度下的活性或含量。
1.5细胞形态和亚显微结构观察
藻细胞用2%戊二醛(pH=7.2磷酸缓冲液配制)前固定,1% 锇酸(pH=7.2磷酸缓冲液配制)后固定,磷酸缓冲液清洗后,一部分细胞用梯度酒精脱水、临界点干燥后,通过导电胶带粘于样品台上,喷金后置于扫描电镜下观察细胞形态;另一部分藻细胞用梯度丙酮脱水,环氧丙烷置换,环氧树脂包埋,切片后,用透射电镜观察细胞亚显微结构,所有的前处理及电镜观察工作在中国科学院生物能源与过程研究所电镜室完成。
1.6数据分析
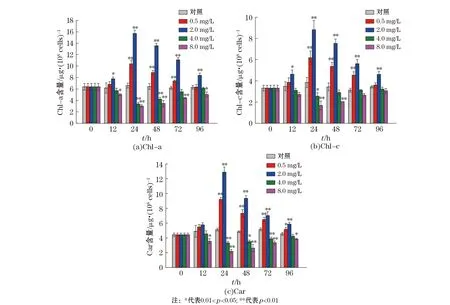
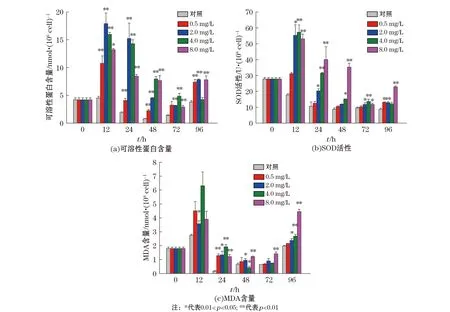
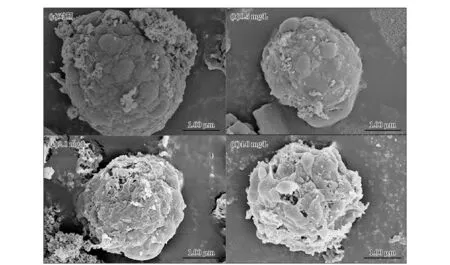
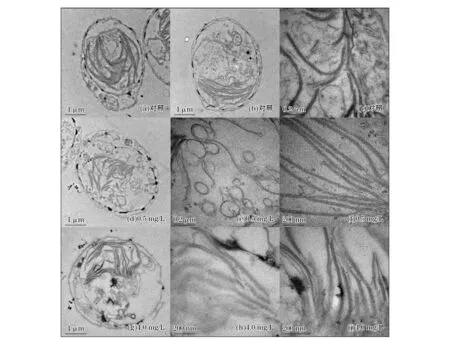
本研究实验结果以平均值±标准偏差(Mean±SD)表示,用Origin 8.5软件绘图。采用SPSS 18.0软件,以单因素方差分析(One-way ANOVA)方法对对照组和实验组的数据进行差异性显著分析,0.01 2.1不同质量浓度的TBBPA对叉鞭金藻光合色素含量的影响 由图1可见,0.5和2.0 mg/L质量浓度组中3种色素含量随时间延长呈先升高后降低的趋势,而4.0和8.0 mg/L质量浓度组中3种色素含量随时间延长先降低后升高,均在第24小时时达最大值或最小值。与对照组相比较,0.5 mg/L质量浓度组Chl-a和Chl-c在24~72 h被显著诱导(p<0.01),2.0 mg/L质量浓度组Chl-a和Chl-c在实验期间均被显著诱导(p<0.01或p<0.05),2个质量浓度组Car在24~96 h被显著诱导(p<0.01或p<0.05);4.0 mg/L质量浓度组中Chl-a和Car含量在24~72 h被显著抑制(p<0.01或p<0.05),Chl-c含量则只在第24小时被显著抑制(p<0.05);8.0 mg/L质量浓度组中Chl-a和Car含量在实验期间则一直显著低于对照组,Chl-c含量在第24小时和第48小时被显著抑制(p<0.01或p<0.05)。 图1 不同质量浓度TBBPA作用下,不同时间段叉鞭金藻Chl-a,Chl-c,Car含量随时间的变化Fig.1 Contents of Chl-a,Chl-c,Car in Dicrateria inornata under different concentrations of TBBPA 2.2不同质量浓度TBBPA对叉鞭金藻可溶性蛋白含量、SOD活性和MDA含量的影响 由图2可见,各实验组叉鞭金藻的可溶性蛋白含量随时间呈现升高-降低-升高的趋势,第12小时达最大值,第48小时或第72小时达最小值。除了0.5 mg/L质量浓度组在第12小时和4 mg/L质量浓度组在第96小时,蛋白含量与对照组无显著差异,其余时间实验组蛋白含量均被显著诱导(p<0.05或p<0.01)。 图2 在不同质量浓度TBBPA作用下,不同时间段的叉鞭金藻可溶性蛋白含量、SOD活性和MDA含量变化Fig.2 Soluble protein contents, SOD activities and MDA contents in Dicrateria inornata under the different concentrations of TBBPA 由图2b可见,各实验组SOD活性随时间延长呈先升高后降低的趋势,在第12小时达最大值。0.5 mg/L质量浓度组SOD活性在第96小时显著高于对照组(p<0.05);除了2.0 mg/L质量浓度组在第48小时和4.0 mg/L质量浓度组在第96小时时SOD活性与对照组无显著差异,其余时间在较高质量浓度(>2.0 mg/L)TBBPA作用下,叉鞭金藻SOD活性均显著高于对照组(p<0.05或者p<0.01)。 TBBPA作用下叉鞭金藻MDA含量随时间变化趋势与可溶性蛋白含量相同,同样呈升高-降低-升高的变化趋势,第12小时达最大值,第48小时达最小值。0.5 mg/L质量浓度组MDA含量在第24小时显著高于对照组(p<0.01);除了第72小时,2.0 mg/L质量浓度组MDA含量其余时间显著高于对照组(p<0.05);4.0 mg/L时质量浓度组MDA含量在第24小时和第96小时显著高于对照组(p<0.01),而第48小时MDA含量显著低于对照组(p<0.05);8.0 mg/L质量浓度组MDA含量在24~96 h期间一直显著高于对照组(p<0.01)。各实验组MDA含量达最小值后,随时间增加而增加,呈现时间-效应关系。96 h内叉鞭金藻MDA含量随TBBPA浓度增加而线性增加(n=15,r=0.96,p<0.000 1),表现为剂量-效应关系。 对TBBPA胁迫后叉鞭金藻的3个参数进行相关性分析。结果表明,在第12小时和第72小时,可溶性蛋白含量和SOD活性呈线性正相关性(r=0.95和0.88,n=15,p<0.05),而SOD和MDA在第96小时时呈正相关(r=0.979,n=15,p<0.051)。 2.3不同质量浓度TBBPA对叉鞭金藻细胞形态和亚显微结构的影响 由图3可见,对照组的细胞普遍较规整,而实验组叉鞭金藻细胞表面出现分泌物,随TBBPA质量浓度增加表层分泌物增多,且细胞表面呈现出一些小的空洞,表面变形,显得松散,可能是TBBPA污染引起了细胞内部结构的改变,从而影响到细胞形态的变化。 图3 处理96 h后不同质量浓度TBBPA对叉鞭金藻细胞形态的影响Fig.3 The effect of different concentrations of TBBPA on the cellular morphology of Dicrateria inornata after 96 h 图4为对照组以及0.5和4.0 mg/L TBBPA处理96 h后叉鞭金藻的透射电镜照片。由图4可见,对照组叉鞭金藻细胞呈球形,各细胞器较清晰均匀分布在基质中,叶绿体较大,类囊体片层清晰、排列整齐;经TBBPA处理后,细胞基质变浑浊,叶绿体皱缩,类囊体排列散乱,基粒片层稀疏,分布不均,突起紧贴细胞外膜,与扫描电镜下所见的突起囊泡相对应。 图4 处理96 h后不同质量浓度TBBPA对叉鞭金藻亚显微结构的影响Fig.4 The effect of different concentrations of TBBPA on the ultrastructure of Dicrateria inornata after 96 h 光合色素在光合作用中参与吸收、传递光能,其含量变化能反映植物生长发育正常情况。本实验结果显示,当TBBPA的质量浓度低于2.0 mg/L时,叉鞭金藻的3种光合色素含量显著高于对照组;质量浓度高于2.0 mg/L时,叉鞭金藻的光合色素含量则显著低于对照组。相关研究表明小球藻在除草剂(100 μg/L阿特拉津或10 mg/L草铵膦)的作用下,Chl-a和总叶绿素的含量显著低于对照组[15]。这可能是细胞在不利的环境下,能够增加光合作用相关的基因表达合成光合色素,吸收光能、将CO2转化为碳水化合物,为细胞新陈代谢提供物质基础;而当环境胁迫超过细胞的耐受限度,抑制光合作用相关的基因表达,表现为光合色素含量下降[15]。本文透射电镜观察显示,较高质量浓度TBBPA作用96 h后,细胞内部叶绿体皱缩,与叶绿素含量降低相一致。 可溶性蛋白是反映细胞生理状态的重要指标,其含量增加是胁迫环境下细胞渗透调节的重要手段,有助于维持藻细胞的新陈代谢,提高微藻的耐受性[16]。小球藻在吲哚乙酸、聚丙烯酸的刺激下,以及三角褐指藻在2-甲基乙酰乙酸乙酯(EMA)作用下蛋白含量均显著增加[17-18]。本文研究结果显示叉鞭金藻可溶性蛋白含量随着TBBPA质量浓度增加而增加,与文献结果相一致[16-18]。 SOD是生物体内重要的抗氧化酶,是清除自由基的首要物质,防止氧自由基对细胞造成的损害并修复受损细胞[19]。Yang等[18]研究表明,7 mmol/L 2-甲基乙酰乙酸乙酯作用3 d后三角褐指藻的SOD活性显著增加;铜绿微囊藻在低浓度(0.005%)小檗碱的作用下SOD活性显著增加,而在高浓度(0.010%,0.020%和0.030%)时SOD活性显著降低,且在第24小时到达最大值,随后含量开始下降[20]。本研究结果显示,在TBBPA作用下叉鞭金藻的SOD活性在第12小时达最大值后降低,实验期间主要表现为被诱导,表明微藻细胞能够调节自身的抗氧化防御系统来抵御外界环境胁迫,是环境适应性增强的表现。 MDA是由膜脂质过氧化后形成的产物,通过分析其含量变化可以衡量机体膜脂质过氧化程度,从而间接测定膜系统受氧化损伤程度[21]。Sabatini等[22]将栅列藻和小球藻暴露在含铜离子(62~414 μmol/L)的培养液中一周,结果显示,两种藻的MDA含量随铜离子浓度增加而增加。本研究结果显示,不同质量浓度TBBPA作用下,叉鞭金藻的MDA含量达最小值后,随时间增加而增加,并且第96小时时MDA含量随TBBPA质量浓度升高而线性增加,可能是藻细胞刚受到污染胁迫时抗氧化系统不足以清除所产生的活性氧,表现为MDA含量增加;在抗氧化系统达最大清除活性氧时,MDA含量最低;然后随TBBPA胁迫时间延长,脂质过氧化速率大于活性氧清除速率,过氧化产物逐渐积累,MDA含量表现为升高的趋势,这与扫描电镜观察到的高质量浓度TBBPA作用下细胞外部有分泌物,细胞表面变形并且出现一些小的空洞相一致。 TBBPA胁迫下叉鞭金藻的可溶性蛋白含量和SOD活性之间存在正相关性,表明微藻细胞可以通过调节可溶性蛋白和SOD酶共同作用来对抗外界不利因素的变化;随着污染时间延长或者质量浓度增加,细胞过氧化产物MDA逐渐累积,细胞形态和亚显微结构也受到损伤,抑制细胞分裂增殖,进而影响到藻的生长。 综上所述,在TBBPA污染下,叉鞭金藻的生理生化指标以及细胞形态和亚显微结构等均受到影响,表明污染物胁迫下对细胞的完整性及内部结构产生影响。本研究结果表明在微藻生长尚未受到明显影响时,光合色素含量、可溶性蛋白、SOD活性和MDA含量等指标在较短时间内均表现出明显变化。目前海水中的TBBPA质量浓度较低,因而尚不会对微藻产生显著的毒性效应。但是,低质量浓度TBBPA对海洋微藻的长期慢性毒性效应有待于进一步深入研究。 [1]SHI Z X, WANG Y F, NIUP Y, et al. Concurrent extraction, clean-up, and analysis of polybrominated diphenylethers, hexabromocyclododecane isomers, and tetrabromobisphenol A in human milk and serum[J].Journal of Separation Science, 2013, 36(20): 3402-3410. [2]ERIKSSON J, RAHM S, GREEN N, et al. Photochemical transformations of tetrabromobisphenol A and related phenols in water[J].Chemosphere, 2004, 54(1): 117-126. [3]TEIL M J, MOREAU-GUIGON E, BLANCHARD M, et al. Endocrine disrupting compounds in gaseous and particulate outdoor air phases according to environmental factors[J].Chemosphere, 2016, 146: 94-104. [4]XIONG J K,AN T C,ZHANG C S,et al.Pollution profiles and risk assessment of PBDEs and phenolic brominated flame retardants in water environments within a typical electronic waste dismantling region[J].Environmental Geochemistry and Health,2015,37(3):457-473. [5]TANG B, ZENG Y H, LUO X J, et al. Bioaccumulative characteristics of tetrabromobisphenol A and hexabromocyclododecanes in multi-tissues of prey and predator fish from an e-waste site, South China[J].Environmental Science and Pollution Research, 2015, 22(16): 12011-12017. [6]LUIGI V, GIUSEPPE M, CLAUDIO R. Emerging and priority contaminants with endocrine active potentials in sediments and fish from the River Po[J].Environmental Scienceand Pollution Research International, 2015, 22(18): 14050-14066. [7]YANG J, CHAN K M. Evaluation of the toxic effects of brominated compounds (BDE-47, 99, 209, TBBPA) and bisphenol A (BPA) using a zebrafish liver cell line, ZFL[J].Aquatic Toxicology, 2015, 159(3): 138-147. [8]HU F X, PAN L Q, CAI Y F, et al. Deep sequencing of the scallopChlamysfarreritranscriptome response to tetrabromobisphenol A (TBBPA) stress[J].Marine Genomics, 2015, 19: 31-38. [9]HE Q, WANG X H, SUN P, et al. Acute and chronic toxicity of tetrabromobisphenol A to three aquatic species under different pH conditions[J].Aquatic Toxicology, 2015, 164: 145-154. [10]KUIPER R V, VANDEN BRANDHOF E J, LEONARDS P E G, et al. Toxicity of tetrabromobisphenol A (TBBPA) in zebrafish (Daniorerio) in a partial life-cycle test[J].Archives of Toxicology, 2007, 81(1): 1-9. [11]ZHOU M J, YAN T. Progress in marine eco-toxicology study in China[J].Research of Environmental Sciences, 1997, 10(3):1-6. 周名江,颜天.中国海洋生态毒理学的研究进展[J].环境科学研究,1997, 10(3):1-6. [12]MÉNDEZ C, URIBE E. Control ofBranchionussp. andAmoebasp. in cultures ofArthrospirasp.[J].Latin American Journal of Aquatic Research, 2012,40(3): 553-561. [13]WANG X Y, JIANG F H, CAO W, et al. Acute toxic effect of hexabromohexabromoclododecane and tetrabromobisphenol A on four marine microalgae[J].Marine Environmental Science, 2013, 32(6): 831-835.王晓艳, 蒋凤华, 曹为, 等. 六溴环十二烷和四溴双酚A对4种海洋微藻急性毒性[J].海洋环境科学,2013, 32(6): 831-835. [14]JEFFREY S W, HUMPHREY G F. New spectrophotometric equations for determining chlorophyll a, b, c1 and c2 in higher plants and natural phytoplankton[J].Plant Physiology and Biochemistry, 1975,8(2):53-59. [15]QIAN H F, CHEN W, LI J J, et al. The effect of exogenous nitric oxide on alleviating herbicide damage inChlorellavulgaris[J].Aquatic Toxicology, 2009, 92(4): 250-257. [16]SHAHNAZ G, SHEKOOFEH E, KOUROSH D, et al. Interactive effects of silicon and aluminum on the malondialdehyde (MDA), proline, protein and phenolic compounds inBoragooflcinalisL.[J].Journal of Medicinal Plants Research, 2011, 5(24):5818-5827. [17]PIOTROWSKA-NICZYPORUK A, BAJGUZ A. The effect of natural and synthetic auxins on the growth, metabolite content and antioxidant response of green algaChlorellavulgaris(Trebouxiophyceae)[J].Plant Growth Regulation, 2014, 73:57 66. [18]YANG C Y, LIU S J, ZHOU S W, et al. Allelochemical ethyl 2-methyl acetoacetate (EMA) induces oxidative damage and antioxidant responses inPhaeodactylumtricornutum[J].Pesticide Biochemistry and Physiology, 2011, 100: 93-103. [19]MENG F P, LI Z N, ZHAO S S, et al. Effects of BDE-47 on the antioxidase activities of four species of marine microalgae[J].Ecology and Environmental Sciences, 2009, 18(5): 1659-1664. 孟范平, 李卓娜, 赵顺顺, 等. BDE-47对4种海洋微藻抗氧化酶活性的影响[J].生态环境学报,2009, 18(5): 1659-1664. [20]ZHANG S L, ZHANG B, DAI W, et al. Oxidative damage and antioxidant responses inMicrocystisaeruginosaexposed to the allelochemical berberine isolated from golden thread[J].Journal of Plant Physiology, 2011, 168(7): 639-643. [21]HALLIWELL B, GUTTERIDGE J M.Oxygen toxicity, oxygen radicals, transition metals and disease[J].The Biochemical Journal, 1984, 219(1): 1-14. [22]SAB ATINI S E, JU REZ B, EPPIS M R, et al. Oxidative stress and antioxidant defenses in two green microalgae exposed to copper [J].Ecotoxicology and Environmental Safety, 2009, 72(4): 1200-1206. Toxic Effects of Tetrabromobisphenol A (TBBPA) onDicrateriainornata YU Yan-zhen1, ZHANG Li1,2, CAO Wei1, ZHENG Li1,3, SUN Cheng-jun1,3, JIANG Feng-hua1 (1.MarineEcologyCenter,theFirstInstituteofOceanography,SOA,Qingdao 266061, China;2.InstituteofOceanographicInstrumentation,ShandongAcademyofSciences,Qingdao 266001, China;3.LaboratoryofMarineEcologyandEnvironmentalScience,QingdaoNationalLaboratoryforMarineScienceandTechnology, Qingdao 266237, China) To study the toxic effect of Tetrabromobisphenol A (TBBPA) on marine microalgae,Dicrateriainornatawas exposed to five different concentrations (0, 0.5, 2.0, 4.0 and 8.0 mg/L) of TBBPA. The contents of photosynthetic pigments, soluble protein, and Malondialdehyde (MDA), and activities of Superoxide Dismutase (SOD) were monitored within 96 hours. In addition, the cellular morphology and substructure were observed after exposure 96 h. The results showed that three pigments (chlorophyllaandc, and carotene) in lower-concentration groups (0.5 and 2.0 mg/L) were obriously higher than those of the control, and their contents reached highest values at 24 h. While they were remarkably lower than those of the control in higher-concentration groups (4.0 and 8.0 mg/L), and their contents showed lowest values at 24 h. Significant induction was observed in most cases in all the test groups for soluble protein content, SOD activity, and MDA content. MDA content increased with increasing of TBBPA concentration at 96 h. The changes of cellular morphology and substructure were observed after exposure of high concentration TBBPA (4.0 mg/L), which was consistent with the decrease of photosynthetic pigments contents and the increase of MDA contents. Dicrateriainornata; TBBPA; photosynthetic pigment; soluble protein; SOD; MDA January 6,2016 2016-01-06 海洋公益性行业科研专项——新型持久性有机污染物监测与风险评估体系研究示范(201105013);中央级公益性科研院所基本科研业务费专项资金——以植物为载体的石油降解固定化菌剂的研制及其应用(2015T05);泰山学者海外创新人才项目 于延珍(1990-),男,山东招远人,硕士研究生,主要从事海洋生物学方面研究.E-mail:yuyanzhen19901113@163.com 蒋凤华(1977-),女,山东夏津人,副研究员,博士,主要从事海洋生态污染效应方面研究.E-mail:jiangfh@fio.org.cn (王佳实编辑) X171.5 A 1671-6647(2016)03-0421-09 10.3969/j.issn.1671-6647.2016.03.0122 结果与分析
3 讨 论
