低压低氧环境对肺气肿大鼠肺组织结构的影响
2016-08-12崔金霞关巍黄琴冯恩志冯喜英时莹庆拉周
崔金霞 关巍 黄琴 冯恩志 冯喜英 时莹庆 拉周
低压低氧环境对肺气肿大鼠肺组织结构的影响
崔金霞1关巍1黄琴2冯恩志3冯喜英1时莹庆1拉周1
810001 西宁,青海大学附属医院呼吸内科1
【摘要】目的探讨低压低氧对肺气肿大鼠肺组织结构的影响。方法选择40只Wistar雄性大鼠随机分为中海拔( 海拔2 260 m)空白对照组、盐水组、肺气肿组及高海拔(低压氧舱模拟海拔5 000 m)盐水组、肺气肿组,每组8只。盐水组及肺气肿组分别腹腔内注射0.8 ml盐水及香烟烟雾提取物(CSE),每周一次,连续四周。第32天活杀小鼠取缔组织肺组织病理切片苏木素-伊红染色(HE)后,测定不同海拔高度大鼠的平均内衬间隔(MLI)、肺泡破坏指数(DI)、单个肺泡面积(APA)及单位面积肺泡数(DPA)。结果4周后中、高海拔肺气肿组大鼠肺组织呈现肺气肿病理改变。高海拔肺气肿组MLI[(226.61±27.51)μm]、DI[(73.98±6.97)%]、APA[(10 606.83±923.05) μm2]明显高于中海拔肺气肿组,DPA[(88.84±5.67)/mm2]明显低于中海拔肺气肿组(均P<0.05);高海拔盐水组MLI[(193.13±24.66) μm]、DI[(57.64±6.72)%]、APA[(5 399.42±1 058.47) μm2]明显高于中海拔盐水组,DPA[(182.11±39.79)/mm2]明显低于中海拔盐水组(均P<0.05)。结论低压低氧环境可加重肺气肿大鼠肺组织结构的破坏。
【关键词】肺气肿;低压低氧;香烟烟雾提取物;肺组织结构
慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)是呼吸系统的常见病、多发病。高原环境低压、低氧,呼吸系统是开放的系统,很容易受到高原环境的影响。有研究显示,COPD发病率与海拔高度呈负相关,但病死率随海拔升高而增加[1-3],但也有与此相反的研究结果[5-6]。肺气肿是COPD主要的病理类型,本实验通过在不同海拔建立肺气肿大鼠模型观察高原低压低氧对肺气肿大鼠肺组织结构的影响。
材料与方法
一、试剂及仪器
万宝路香烟(焦油量8 mg,烟碱量0.8 mg);磷酸盐缓冲盐水;0.9%生理盐水若干瓶;苏木素液;醇溶性伊红;4%多聚甲醛;二甲苯;无水酒精;95%酒精 85%酒精;75%酒精;0.5%盐酸;中性树胶;Tissue-Tek, PS-53 肺组织切片机 (Sakura Company, Tokyo, Japan);OLYMPUS BX53 光学显微镜(Olympus CO, Ltd, Tokyo, Japan)。
二、实验方法
1. 实验动物分组: 健康清洁雄性Wistar大鼠40只(兰州大学动物实验室购买,合格证号SCXK(甘)2011-0001),体质量(143±6.6)g,鼠龄6周,购买当日运回青海西宁。应用随机数字表法随机分为5组,每组8只,分别为:中海拔(2 260 m)空白对照组、盐水组、肺气肿组和高海拔盐水组、肺气肿组。高海拔盐水组和肺气肿组大鼠饲养于低压氧舱内,模拟到海拔5 000 m(压力:52 889~53 001 Pa,氧分压:42 mmHg,新风量:110~189 m3/h,温度:16.9~24 ℃,湿度:37.3%~51% ),连续24 h(打扫、清洁、喂食及注射药物均在低氧环境下进行)。各试验组大鼠按昼夜节律采光12 h,通风良好,保持室温条件,定期消毒,自由摄食、饮水。
2. 肺气肿模型建立: 香烟提取物(cigarette smoke extraction, CSE)的制备按照文献[3-4]的方法进行改进,将60 ml一次性注射器链接三通管后,在三通管一侧链接胶管,用以链接香烟过滤嘴,另一侧链接针头后,插入橡胶瓶塞进入瓶中。点燃香烟后,每次吸60 ml,每次抽吸时间持续5 s,共抽吸12次,共720 ml烟雾,将香烟烟雾缓慢注入500 ml干净的蒸馏水玻璃瓶中,连续抽吸直至香烟燃至过滤嘴前方1 cm处停止抽吸。摇晃含有香烟烟雾及缓冲液的玻璃瓶约10 min,使香烟烟雾完全溶解于缓冲液中,完成CSE溶液的配置。CSE溶液每次使用前新鲜配置。中、高海拔盐水组和肺气肿组分别腹腔内注射0.8 ml 0.9%生理盐水及0.8 ml CSE,每周1次,连续4周。于第32天腹腔麻醉下开胸,通过自制灌注固定装置冲洗肺脏至肺叶变白、双肺膨胀、边缘变钝,胸膜展开后摘取肺脏,迅速放入4%甲醛溶液的避光盒中。
3. 肺组织病理切片形态定量分析: 平均内衬间隔(mean linear intercept, MLI):肺组织经过常规石蜡包埋、切片,切片厚度均为3.5 μm,每只大鼠右肺取3张切片,行苏木素-伊红(hematoxylin-eosin, HE)染色。后,在Mshot Digital Imaging System V1.0软件系统下,光学显微镜(10×10)同一倍数下观察切片。每个切片随机读取3个视野,避开大血管及大支气管,每个视野中心划十字交叉线,计算总十字线长度(L)及与十字线交叉的肺泡隔数(NS),利用公式MLI=L/NS,表示肺泡内径的平均值。
肺泡破坏指数(destructive index, DI):在同上系统软件低倍镜下,每张切片观察20个非重复视野,若视野中除了肺泡以外的任意一结构直径大于0.59 mm,此视野不计数。在每个切片中心划十字交叉线,计数十字线四个区域的肺泡数,分别用正常(N)及破坏(D)记录,再求和。划十字交叉线的目的主要是防止少数或多数现象。如果肺泡囊或腔只有一个开口或没有开口时,记为N。当一个肺泡囊或腔有2个或2个以上的开口时,记为D;当肺泡腔内出现2个或以上的中断的肺泡壁组织时,记为D;当肺泡壁被覆了很明显的非正常组织(立方上皮)而增厚时,记为D;当呈明显肺气肿损害时记为D。以公式DI=D/(D+N)。病理读片均采用双盲法。
单个肺泡面积(area of pulmonary alveoli, APA)、单位面积肺泡数(density of pulmonary alveoli, DPA):采用江苏省捷达科技8.0软件系统,每只大鼠取1张片子,每张片子读取8个非重复视野,均采用图像分析系统直接得出。
三、统计学方法
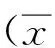
结 果
一、 肉眼及光学显微镜大鼠肺组织的病理变化
肉眼及光学显微镜大鼠肺组织的病理变化,见表1、图1。
二、各组间大鼠MLI、DI、APA、DAP的比较
5组之间的MLI、DI、APA、DAP比较均有统计学意义(P<0.05)。中海拔肺气肿组MLI、DI、APA高于中海拔空白对照组及中海拔盐水组,DAP低于中海拔空白对照组及中海拔盐水组(均P<0.05);高海拔盐水组MLI、DI、APA高于中海拔空白对照组及中海拔盐水组,DAP低于中海拔空白对照组及中海拔盐水组(均P<0.05);高海拔肺气肿组MLI、DI、APA高于中海拔空白对照组、中海拔肺气肿组及高海拔K组,DAP低于中海拔空白对照组、中海拔肺气肿组及高海拔盐水组(均P<0.05), 见表2。
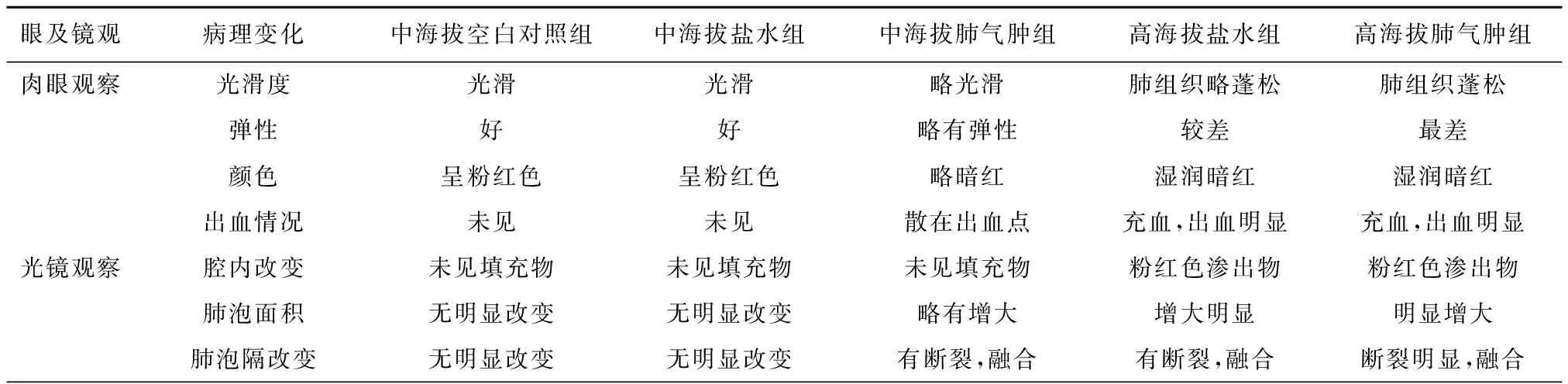
表1 肉眼及光学显微镜下大鼠肺组织病理变化
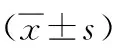
表2 各组大鼠肺组织的MLI、DI、DAP、APA的比较
注:与中海拔空白对照组比较,aP<0.05;与中海拔盐水组比较,bP<0.05;与中海拔肺气肿组比较,cP<0.05; 与高海拔盐水组比较,dP<0.05;MLI: 平均内衬间隔;DI:肺泡破坏指数;DAP: 单位面积肺泡数;APA: 单个肺泡面积
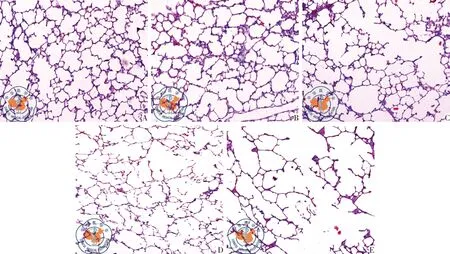
图1光学显微镜大鼠肺组织的病理变化。注:A:正常空白对照组HE×40;B:中海拔生理盐水组HE×40;C:中海拔肺气肿组HE×40;D:高海拔盐水组HE×40;E:高海拔肺气肿组 HE×40
讨 论
低压、低氧是高原环境最主要的两个特点,人体处于高原环境下,多系统功能和结构可能发生改变,而疾病受到高原环境的影响,也可能具有与平原不同的特点。高原环境下COPD肺组织的结构变化如何,目前很少有研究涉及。
以往的研究发现,无论是急性还是慢性低氧状态下肺组织结构均有可能发生改变。张春爱等[7]研究发现,大鼠3 d到达海拔4 500 m地区,光镜下肺泡隔增宽,肺间质疏松,毛细血管扩张充血明显,某些区域内可见肺泡腔内有粉红色渗出物。李福祥等[7-8]在低压氧舱模拟海拔6 000 m 1 d时,发现大鼠肺组织也具有同样的改变。但大鼠在海拔4 500 m停留30 d后,间质性肺水肿明显减轻,肺泡腔清晰,肺泡隔结构基本正常,部分区域可见肺间质增生及轻度肺气肿改变。本研究结果显示,与中海拔盐水组比较,高海拔盐水组大鼠肺组织肺泡腔扩大、肺泡壁变薄、DAP减少、DI增加,说明长期慢性低压低氧环境下,肺组织破坏增加,有肺气肿改变趋势。
目前认为吸烟是发生COPD的最危险因素之一。本研究利用腹腔注射香烟提取物成功建立了肺气肿模型。并且观察到海拔5 000 m的大鼠肺气肿模型组与海拔2 260 m相比,大鼠肺泡腔扩大、肺泡壁变薄、肺泡破裂明显,并且MLI、DI及APA明显大于低海拔组,DAP明显小于海拔2 260 m肺气肿模型组,说明高海拔肺气肿大鼠肺泡破坏增加,正常的肺泡数量减少。
本研究还显示,在同一海拔条件下,肺气肿大鼠与单纯低压、低氧的大鼠相比,肺组织的破坏更重,说明在香烟及低压、低氧双重因素的作用下,肺气肿的肺组织损害加重。
COPD的发病机制尚不十分清楚,目前认为主要与细胞凋亡、蛋白酶失衡、氧化/抗氧化失衡学说及全身炎性效应有关。有研究显示持续的低压、低氧环境下,大鼠肺组织细胞Caspase-3表达降低,返回平原后,表达增加。进驻高原人群血中TNF-α和IL-6水平也明显高于平原人群[9-10]。有研究显示低氧时增加NF-κB的活化程度,巨噬细胞内信号转导通路活性增加,可导致TNF-α和IL-6分泌增加[11-12]。NF-κB的p50和p65亚单位可结合于HIF-1α的κB结合点,低氧时这些亚单位过表达可导致HIF-1α mRNA表达增加,而HIF-1α又可以反过来调节NF-κB[13-14]。还有研究显示慢性持续低氧大鼠肺组织超氧化物歧化酶、丙二醛、NADPH氧化酶2、4的浓度明显增加[15-16]。由此可见,低压、低氧影响肺组织细胞的凋亡、细胞因子的变化及氧化应激反应,从而加重肺气肿大鼠肺组织的损伤,其确切机制尚有待深入研究。
综上所述,低压、低氧加重了肺气肿大鼠肺组织的损伤,高原肺气肿患者在疾病和高原环境双重损伤下病情更重,因此,有必要对高原肺气肿患者的防治制定有效措施,从而提高高原患者的生存质量。
参考文献
1Menezes AMB, Perez-PR, Jardim JR, et al. Chronic obstructive pulmonary disease in five Latin American cities (the PLATINO study): a prevalence study[J]. Lancet, 2005, 366(9500): 1875-1881.
2Laniado LR, Rendón A, Bauerle O. Chronic obstructive pulmonary disease case finding in Mexico in an at-risk population[J]. Int J Tuberc Lung Dis, 2011, 15(6): 818-823.
3Cote TR, Stroup DF, Dwyer DM, et al. Chronic obstructive pulmonary disease mortality: a role for altitude[J]. Chest, 1993, 103(4): 1194-1197.
4Chen Y, Hanaoka M, Droma Y, et al. Endothelin-1 receptor antagonists prevent the development of pulmonary emphysema in rats[J]. European Respiratory Journal, 2010, 35(4): 904-912.
5Caballero A, Torres-Duque CA, Jaramillo C, et al. Prevalence of COPD in five Colombian cities situated at low, medium, and high altitude (PREPOCOL study)[J]. Chest, 2008, 133(2): 343-349.
6Coultas DB, Samet JM, Wiggins CL. Altitude and mortality from chronic obstructive lung disease in New Mexico[J]. Arch Environ Health, 1984, 39(5): 355-359.
7张春爱, 李文华. 高原低氧对大鼠心肺组织超微结构的影响[J]. 中国组织工程研究与临床康复, 2011, 15(24): 4473-4476.
8李福祥, 夏前明, 李鸿雁, 等. 低氧习服对模拟高原低氧大鼠肺组织结构的影响[J]. 中国呼吸与危重监护杂志, 2008, 3(7): 199-201.
9陈强, 高芬. 高原肺动脉高压大鼠重返平原后Caspase-3的表达[J]. 当代医学, 2011, 17(17): 32-33.
10朱海宏, 吴洪福, 耿排力. 高原低氧下IL-1β、IL-6含量变化及其意义初探[J]. 青海医学院学报, 2004, 25(2): 94-95.
11De Gonzalo-Calvo D, Neitzert K, Fernández M, et al. Differential inflammatory responses in aging and disease: TNF-alpha and IL-6 as possible biomarkers[J]. Free Radic Biol Med, 2010, 49(5): 733-737.
12SK S S, Veeramohan, P H, et al. Nifedipine inhibits hypoxia induced transvascular leakage through down regulation of NF-kappaB[J]. Respir Physiol Neurobiol, 2012, 183 (1): 26-34.
13Ghosh S, Hayden MS. New regulators of NF-kappaB in inflammation [J]. Nat Rev Immunol, 2008, 8 (11): 837-848.
14Walmsley SR, Print C, Farahi N, et al. Hypoxia-induced neutrophil survival is mediated by HIF-1alpha-dependent NF-kappaB activity[J]. J Exp Med, 2010, 201(1): 105-115.
15Yuhai GU, Zhen Z. Significance of the changes occurring in the levels of interleukins, SOD and MDA in rat pulmonary tissue following exposure to different altitudes and exposure times[J]. Exp Ther Med, 2015, 10 (3): 915-920.
16吴西玲, 杜立中, 徐雪峰. eNOS和NADPH氧化酶在慢性缺氧条件下小鼠肺组织中表达关系的研究[J].中国当代儿科杂志, 2015, 17(9): 1001-1006.
(本文编辑:黄红稷)
崔金霞,关巍,黄琴,等. 低压低氧环境对肺气肿大鼠肺组织结构的影响[J/CD]. 中华肺部疾病杂志: 电子版, 2016, 9(3): 282-285.
DOI:10.3877/cma.j.issn.1674-6902.2016.03.011
基金项目:青海省应用基础研究计划资助项目(2011-Z-710)
通讯作者:关巍,Email:weiguan110@163.com
中图法分类号:R563.3
文献标识码:A
Corresponding author:Guan Wei, Email: weiguan110@163.com
(收稿日期:2016-03-21)
Influence of hypobaric hypoxia on the lung tissue structure in rats with emphysema
CuiJinxia1,GuanWei1,HuangQin2,FengEnzhi3,FengXiying1,ShiYingqing1,LaZhou1.1Desect1mentofRespiratoryMedicine,theAffiliatedHospitalofQinghaiUniversity,Xining, 810001,China;2Desect1mentofRespiratoryMedicine,SantaiPeople′sHospital,MianyangCity,SichuanProvince,Mianyang, 621100,China;3Desect1mentofRespiratoryMedicine,theForthhospitalofChinesePeople′sLiberationArmy,Xining, 810007,China
【Abstract】ObjectiveTo study the influence of different altitude on rat′s pulmonary emphysema formation, it was measured that relative indices, including mean linear intercept (MLI), destructive index (DI), area of pulmonary alveoli (APA) and density of pulmonary alveoli (DPA). MethodsA total of 40 male wistar rats were randomly divided into five groups: blank control group, saline group and, emphysema group in moderate altitude(2 260 m); saline group and, emphysema group at high altitude(hypobaric chamber, 5 000 m), with 8 eats in each group. Emphysema and saline groups were respectively injected cigarette smoke extraction (CSE) and saline intraperitoneally once a week for four weeks. After HE stanning, MLI and DI were measured in lung tissues to assess the degree of emphysema. It was measured that APA and DPA by stereological methods. ResultsThe MLI, DI and APA were significantly higer, the DAP was significantly lower in the emphysema group rats than compared with control group rats (all P<0.05 ). The velues of MLI[(226.61±27.51) μm], DI[(73.98±6.97)%], APA[(10 606.83±923.05) μm2] were significantly higher, DPA[(88.84±5.67)/mm2] was lower in emphysema group rats at high altitude than those of emphysema group rats at moderate altitude (all P<0.05). The values of MLI[(193.13±24.66) μm], DI[(57.64±6.72)%], APA[(5 399.42±1 058.47) μm2] were significantly higher, DPA[(182.11±39.79)/mm2] was lower in saline group rats at high altitude than those of saline group rats at moderate altitude(all P<0.05). ConclusionThe hypobaric hypoxia of high altitude environment aggravates the damage of the lung architecture in rats with emphysema.
【Key words】Pulmonary emphysema;Hypobaric hypoxia;Cigarette smoke extract;Lung architecture
621100 四川,四川绵阳市三台县人民医院呼吸内科2
810007 西宁,中国人民解放军第四医院呼吸内科3
