慢性阻塞性肺疾病患者肺气肿空间分布对肺功能及临床严重程度的影响
2018-05-18沈其晓韩丽莹黄晶晶全显跃
喻 晴,沈其晓,韩丽莹,黄晶晶,全显跃*
(1.南方医科大学珠江医院影像诊断科,2.呼吸科,广东 广州 510282)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)为复杂的异质性疾病。既往研究[1-3]发现,患者肺功能与肺气肿的临床症状、预后存在关联。肺气肿及其空间分布均可导致气流受限,因此,准确评估肺气肿空间分布模式有助于预测COPD进展和预后以及个性化治疗[4-5]。MSCT一次屏气可获得毫米级高分辨图像。肺气肿在MSCT图像上表现为低密度区,因此通过测量低密度区容积百分比(low-attenuation area percent, LAA%)可量化肺气肿程度。本研究探讨COPD患者肺气肿空间分布对肺功能及临床严重程度的影响。
1 资料与方法
1.1 一般资料 收集2016年7月—2017年4月在我院经肺功能检查确诊为COPD的患者84例,男73例,女11例,年龄45~87岁,平均(66.9±9.1)岁。纳入标准:具备不完全可逆的气流受限特征,即吸入支气管舒张剂沙丁胺醇后,肺功能指标第1秒用力呼气量(forced expiratory volume in one second, FEV1)/用力肺活量(forced vital capacity, FVC)<0.7;年龄>40岁。排除标准:合并肺间质纤维化、感染、胸廓畸形、大量胸腔积液、支气管扩张、哮喘、严重肝肾疾病及肺部切除史。本研究经我院伦理委员会批准,患者均签署知情同意书。
1.2 肺功能检查 采用德国Jaeger公司Master lab肺功能仪,主要检查指标包括FEV1/FVC、FEV1的实测值与预计值的百分比(FEV1%pred);其他检查指标包括响应频率(resonance frequency, Fres)及单次一氧化碳弥散量(single-breath diffusing capacity, DLcoSB),以实测值占预计值的百分比( DLcoSB%pred)表示结果。根据2016年GOLD指南[6]将患者分为4种情况:①20例,FEV1%pred≥50%,上一年急性加重次数≤1次,COPD评估测试(COPD assessment test, CAT)<10分,改良英国医学研究学会呼吸困难指数(modified British medical research council, mMRC)分级0~1级;②29例,FEV1%pred≥50%,上一年急性加重次数≤1次,CAT≥10分,mMRC分级>1级;③18例,FEV1%pred<50%,上一年急性加重次数>1次或因急性加重住院≥1次,CAT<10分,mMRC分级0~1级;④17例,FEV1%pred<50%,上一年急性加重次数>1次或因急性加重住院≥1次,CAT≥10分,mMRC分级>1级。临床严重程度分级:定义①/②为轻/中度COPD,③/④为重度/极重度COPD。
1.3 仪器与方法 采用Philips Brilliance 256层iCT行胸部平扫。扫描前训练患者呼吸,使其能够在吸气末屏气。嘱患者仰卧,双臂上举,扫描范围从胸廓入口到膈肌水平。扫描参数:管电压100 kV,自动管电流,FOV 35 cm×35 cm,探测准直器128×0.625 mm,螺距0.915,机架旋转时间0.5 s/rot,扫描床速度146.4 mm/s。采用高级混合迭代算法(iDose4)level 3进行图像重建,重建层厚1 mm,层间距1 mm。
1.4 图像分析 将数据传输至Philips IntelliSpace Portal工作站,应用COPD分析软件,选择肺气肿分析功能,设定阈值为-950 HU,软件自动计算总肺、左右肺及各肺叶LAA%(图1)。
1.5 肺气肿异质性分类方法 参照文献[7],定义异质性指数(heterogeneity index, HI)为肺气肿上下叶空间分布差异指数,HI=(%LAA上叶-%LAA下叶)/(%LAA上叶+%LAA下叶),范围为-1~+1;定义%LAA上叶为右肺上叶(right upper lobe, RUL)、中叶(right middle lobe, RML)及左肺上叶(left upper lobe, LUL)%LAA,即LAA%(RUL+RML+LUL);%LAA下叶为右肺下叶(right lower lobe, RLL)和左肺下叶(left lower lobe, LLL)%LAA,即LAA%(RLL+LLL)。
根据文献[7]方法对患者进行分组,将总肺LAA%≤1%者归入无肺气肿组;总肺LAA%>1%者归入肺气肿组,其中HI>0者纳入上叶肺气肿为主亚组,HI≤0者纳入下叶肺气肿为主亚组。

图1 COPD分析软件自动测量各肺叶LAA%界面图,阈值为-950 HU

表1 各肺叶LAA%与肺功能指标相关性分析[r值(P值)]
表2 2组肺功能指标(±s)
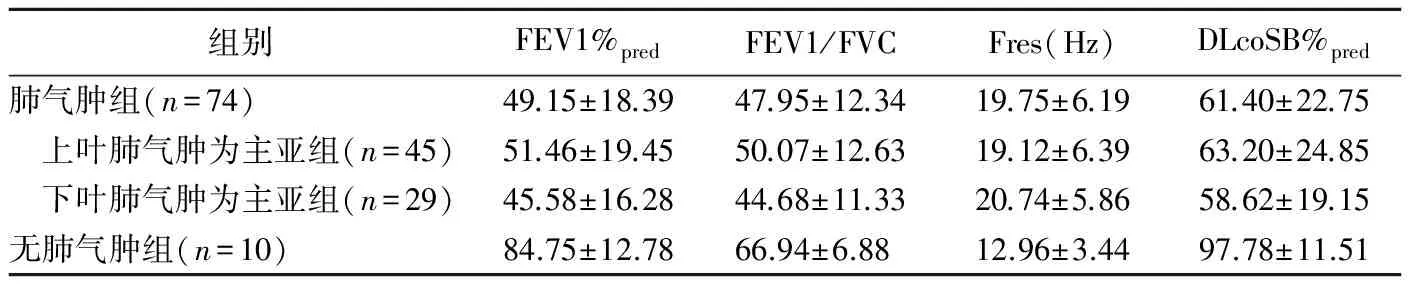
表2 2组肺功能指标(±s)
组别FEV1%predFEV1/FVCFres(Hz)DLcoSB%pred肺气肿组(n=74)49.15±18.3947.95±12.3419.75±6.1961.40±22.75 上叶肺气肿为主亚组(n=45)51.46±19.4550.07±12.6319.12±6.3963.20±24.85 下叶肺气肿为主亚组(n=29)45.58±16.2844.68±11.3320.74±5.8658.62±19.15无肺气肿组(n=10)84.75±12.7866.94±6.8812.96±3.4497.78±11.51
1.6 统计学分析 采用SPSS 20.0统计分析软件,以Spearman相关分析观察各肺叶LAA%与肺功能指标的相关性,r<0.3为存在弱相关,0.3~0.6为中等相关,>0.6~0.8为相关性较高,r>0.8为相关性很高。采用χ2检验比较2亚组临床严重程度,以独立样本t检验分析2组肺功能指标差异。P<0.05为差异有统计学意义。
2 结果
各肺叶LAA%与肺功能指标相关性分析见表1。各肺叶LAA%均与DLcoSB%pred呈负相关;除RML外,其余肺叶LAA%均与FEV1%pred、FEV1/FVC呈负相关,与Fres呈正相关。
84例COPD中,49例为轻/中度,35例为重度/极重度。无肺气肿组10例(10/84,11.90%),均为轻/中度COPD;肺气肿组74例(74/84,88.10%),其中上叶肺气肿为主亚组45例(45/84,53.57%),轻/中度COPD占62.22%(28/45),重度/极重度COPD占37.78%(17/45);下叶肺气肿为主亚组29例(29/84,34.52%),轻/中度COPD占37.93%(11/29),重度/极重度COPD占62.07%(18/29);2亚组间临床严重程度差异有统计学意义(χ2=4.17,P=0.041)。
2组肺功能指标比较见表2。与无肺气肿组相比,肺气肿组Fres较高(t=-3.39,P=0.001),FEV1%pred、FEV1/FVC及DLcoSB%pred均较低(t分别为5.92、7.28、8.09,P均<0.001);下叶肺气肿为主亚组FEV1%pred(t=2.01,P=0.042)及FEV1/FVC(t=2.15,P=0.035)均较上叶肺气肿为主亚组降低,2亚组间Fres、DLcoSB%pred差异无统计学意义(P均>0.05)。
3 讨论
COPD以不完全气流阻塞为特征,GOLD指南将其分为慢 性支气管炎型和肺气肿型[8]。MSCT可观察COPD的不同表型,其对于肺气肿改变、支气管异常的评估及将COPD进一步分成不同表型的研究是近年的热点[9-11]。肺脏由5个肺叶组成,各肺叶均有独立的支气管血管系统来支持机械通气及灌注等功能体系,但各肺叶的独立性可能导致肺功能和肺气肿分布关系和模式不同。由于结构与功能密切相关[1,3,12],故肺气肿的空间分布可影响肺功能评估。目前对肺气肿空间分布的研究[1,5,13]结果尚未统一,有研究[4,7]认为肺气肿以下肺叶为主或空间分布较均匀者肺功能较差,还有研究[14-15]认为以上肺叶为主的肺气肿与肺功能下降有关,提示肺气肿的空间分布可影响肺功能,故分析肺气肿的空间分布模式有助于精确诊断及制定个性化治疗方案。
本研究中各肺叶LAA%均与DLcoSB%pred呈负相关;除RML外,余肺叶LAA%均与FEV1%pred、FEV1/FVC呈负相关,与Fres呈正相关,提示肺气肿越重,肺功能越差,气道阻力越大,这与COPD的病理生理改变相符。本研究中,右肺LAA%与肺功能指标的r值绝对值均较左肺高,可能与右主支气管自身形态粗而短、走行较陡直的解剖特点有关[16];%LAA下叶与FEV1%pred(r=-0.69)、FEV1/FVC(r=-0.65)呈较高度负相关,与Engel等[17]的研究结果相符,提示气流受限更易受肺下叶影响,这是由于人在坐位或站位时,肺上下叶的重力不同,肺下叶气道在呼气时关闭相对较早;%LAA上叶与DLcoSB%pred(r=-0.65)呈较高度负相关,与Nakano等[18]研究吻合,其认为严重肺气肿患者,由于肺下叶气流受限,快速呼出的气体里可能含大量肺下叶气体,故推测严重肺气肿患者肺的弥散能力可能受肺上叶的影响更大。Bastos等[5]研究表明,缺氧可能导致下叶为主的肺气肿。推测通气/灌注值差异也可能与肺气肿有关,略占主导地位的下叶血氧过低,通气/灌注值下降,肺气肿更重;气流受限受下叶影响可能更明显,而弥散能力可能更易受上叶影响。
Bastos等[5]发现小面积的肺气肿主要集中在上叶。Tanabe等[4]发现以下叶为主的肺气肿患者肺功能更差。本研究中无肺气肿组均为轻/中度COPD患者,上叶肺气肿为主亚组中轻/中度COPD患者占62.22%,下叶肺气肿为主亚组中重度/极重度COPD患者占62.07%,且下叶肺气肿为主亚组FEV1%pred、FEV1/FVC较上叶肺气肿为主亚组均更低(P均<0.05),提示下叶肺气肿为主患者肺功能更差,临床严重程度更重,急性加重次数更多。Demeo等[19]还发现特定基因(如MMP-9、EPHXl、GSTPl)与上叶为主肺气肿相关,提示肺气肿分布的多样性还涉及形态学和遗传学等多学科。
本研究的不足:样本量较少,结果可能存在偏倚;对于肺气肿分布较均匀的患者是否有更好的分组方法仍有待探索。
综上所述,肺气肿空间分布的不同可影响肺功能及临床严重程度,下叶肺气肿为主患者肺功能相对较差,临床严重程度更重。
[参考文献]
[1] Saitoh T, Koba H, Shijubo N, et al. Lobar distribution of emphysema in computed tomographic densitometric analysis. Invest Radiol, 2000,35(4):235-243.
[2] Haraguchi M, Shimura S, Hida W, et al. Pulmonary function and regional distribution of emphysema as determined by high-resolution computed tomography. Respiration, 1998,65(2):125-129.
[3] De Torres JP, Bastarrika G, Zagaceta J, et al. Emphysema presence, severity, and distribution has little impact on the clinical presentation of a cohort of patients with mild to moderate COPD. Chest, 2011,139(1):36-42.
[4] Tanabe N, Muro S, Tanaka S, et al. Emphysema distribution and annual changes in pulmonary function in male patients with chronic obstructive pulmonary disease. Respir Res, 2012,13:31.
[5] Bastos HN, Neves I, Redondo M, et al. Influence of emphysema distribution on pulmonary function parameters in COPD patients. J Bras Pneumol, 2015,41(6):489-495.
[6] Vogelmeier CF, Criner GJ, Martinez FJ, et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive lung disease 2017 report. GOLD Executive Summary. Am J Respir Crit Care Med, 2017,195(5):557-582.
[7] Ju J, Li R, Gu S, et al. Impact of emphysema heterogeneity on pulmonary function. PLoS One, 2014,9(11):e113320.
[8] Tan WC, Mahayiddin AA, Charoenratanakul S, et al. Global initiative for chronic obstructive lung disease strategy for the diagnosis, management and prevention of chronic obstructive pulmonary disease: An Asia-Pacific perspective. Respirology, 2005,10(1):9-17.
[9] Nambu A, Zach J, Schroeder J, et al. Quantitative computed tomography measurements to evaluate airway disease in chronic obstructive pulmonary disease: Relationship to physiological measurements, clinical index and visual assessment of airway disease. Eur J Radiol, 2016,85(11):2144-2151.
[10] Fernandes L, Fernandes Y, Mesquita AM. Quantitative computed tomography imaging in chronic obstructive pulmonary disease. Lung India, 2016,33(6):646-652.
[11] 管宇,范丽,夏艺,等.慢性阻塞性肺疾病患者小气道重塑及肺叶水平肺气肿的CT定量分析及其与肺功能的相关性研究.中国医学影像技术,2015(2):181-185.
[12] Boschetto P, Miniati M, Miotto D, et al. Predominant emphysema phenotype in chronic obstructive pulmonary. Eur Respir J, 2003,21(3):450-454.
[13] 王琳,王广丽,张成琪.MSCT在评估慢性阻塞性肺疾病患者肺功能受损的应用.实用放射学杂志,2014(4):613-616.
[14] Mair G, Miller JJ, Mcallister D, et al. Computed tomographic emphysema distribution: Relationship to clinical features in a cohort of smokers. Eur Respir J, 2009,33(3):536-542.
[15] Mohamed Hoesein FA, Van Rikxoort E, Van Ginneken B, et al. Computed tomography-quantified emphysema distribution is associated with lung function decline. Eur Respir J, 2012,40(4):844-850.
[16] 牛朋影,哈若水,蔡中,等.MSCT通过肺叶比例异常预测COPD早期病变.宁夏医学杂志,2012,34(4):313-315.
[17] Engel LA, Grassino A, Anthonisen NR. Demonstration of airway closure in man. J Appl Physiol, 1975,38(6):1117-1125.
[18] Nakano Y, Sakai H, Muro S, et al. Comparison of low attenuation areas on computed tomographic scans between inner and outer segments of the lung in patients with chronic obstructive pulmonary disease: Incidence and contribution to lung function. Thorax, 1999,54(5):384-389.
[19] Demeo DL, Hersh CP, Hoffman EA, et al. Genetic determinants of emphysema distribution in the national emphysema treatment trial. Am J Respir Crit Care Med, 2007,176(1):42-48.
