超声空化法制备脱细胞血管支架生物学相容性的实验研究
2016-08-12张蔓菁鲁开化
刘 宾, 李 菲, 张蔓菁, 鲁开化
作者单位:710003 陕西 西安,西安市中心医院 烧伤整形外科(刘 宾);西安医学院护理学院(李 菲);昆明医学院第二附属医院 整形外科(张蔓菁);第四军医大学西京医院 整形外科(鲁开化);
超声空化法制备脱细胞血管支架生物学相容性的实验研究
刘 宾, 李 菲, 张蔓菁, 鲁开化
作者单位:710003 陕西 西安,西安市中心医院 烧伤整形外科(刘 宾);西安医学院护理学院(李 菲);昆明医学院第二附属医院 整形外科(张蔓菁);第四军医大学西京医院 整形外科(鲁开化);
目的 检测经强度为300 W超声处理后的脱细胞血管支架的生物相容性。方法 无菌条件下,采取新鲜兔股动脉反复冻溶+超高压处理后,利用核酸酶进行消化,脱去残留细胞碎片形成脱细胞血管支架。将强度为300 W的超声作用于脱细胞血管支架,并对处理后支架材料的生物学相容性进行检测和观察。结果 经强度为300 W超声处理后的支架材料,其疏松化程度在明显提高的同时未发现明显的细胞毒性,且种子细胞可以长入材料内部。结论 超声空化法处理后的脱细胞血管支架材料具有较好的组织相容性,可以为组织工程血管支架的研究提供新的思路和方法。
组织工程血管; 脱细胞血管支架; 超声; 生物相容性
对血管支架的研究一直是血管组织工程研究领域的难点和重点。脱细胞血管基质在血管组织工程中得到越来越多的重视和应用[1-2]。目前,组织工程学种子细胞种植于材料的通行做法是:静态培养复合[3]、生物发生器内复合[4]、旋转搅动[5]以及离心培养[6]等。这些细胞种植方法需要高密度的种子细胞,但仍无足够的证据表明细胞能够长入支架材料内部[7]。因此,如何在保留脱细胞血管支架机械强度的前提下,提高脱细胞血管基质材料的疏松性和孔隙率,仍是目前组织工程脱细胞血管支架研究中的一个热点。在前期的试验中我们发现[8],通过超声波在液体内的空化效应,并使用300 W强度的超声波,可以在不显著改变材料本身生物化学成分及生物力学特性的前提下,达到使脱细胞血管支架致密的胶原纤维疏松化的目的。2014-2015年,西安市中心医院烧伤整形外科对超声处理后支架材料的生物学相容性进行了研究。
1 材料与方法
1.1 材料、试剂来源
选择2.0~2.5 kg的大耳白兔10只(由第四军医大学动物中心提供)。核糖核酸酶(R- Nase A)、脱氧核糖核酸酶(D-Nase I,美国SIGMA公司)、超声生物处理器(VIRSONIC 100,美国)。
1.2 方法
1.2.1 脱细胞血管支架的制备 在麻醉、无菌条件下取出兔股动脉(20根),具体制备方法同文献[9]。
1.2.2 超声处理脱细胞血管支架 超声探头经高压灭菌处理后,将脱细胞兔血管修剪为5 mm×25 mm的片状,分别置入0℃的PBS溶液中。将超声探头垂直浸入PBS液中约2 cm。使用处理间隔为1 s,对每个材料总计超声处理时间为60 s,每个材料所接受的累积超声强度为300 W。
1.2.3 兔血管内皮细胞的分离培养及鉴定 取兔股静脉>50 cm,6 h内进行分离、培养;5号带柄一次性静脉输液针吸取37℃ 预热双抗PBS,插入静脉冲洗,洗除残血,注入口处用线绳结扎,以防液体返流;分别注入0.125%、0.25% 胰酶和0.1% 胶原酶消化液,使管腔充盈,37℃ ,于12、15、17 min,松开一端,收集消化液; 注入含10%胎牛血清M199培养液再次冲洗管腔;将消化液和冲洗液离心800 r/min,5 min,弃上清;加M199培养液,吹打均匀制成细胞悬液,以每瓶浓度2×105传入25 cm2培养瓶,37℃、5%CO2培养箱内培养,每24 h半定量换液,当细胞生长至完全融合,按1∶2的比例传代并接种细胞,建立二倍体细胞系。取5、6代细胞进行试验。内皮细胞鉴定:⑴细胞形态学观察培养过程直接在倒置相差显微镜下观察细胞的生长情况并记录典型表现。⑵免疫组化检测vWF的表达。
1.2.4 细胞黏附及接触细胞毒性测定 将约3 mm2的无菌医用粘合膜贴于一次性细胞培养皿中央,无菌条件下取5 mm×5 mm大小超声处理后的脱细胞血管基质并黏附于细胞培养皿中。作为阳性对照组,将1滴氰基丙烯酸酯滴加至另一培养皿中央的医用粘合膜上;阴性对照组培养皿中央仅粘贴医用粘合膜。将准备的成内皮细胞悬液依次接种于上述培养皿中,CO2培养箱中(37℃,5%CO2)孵育48 h后,在倒置荧光显微镜下观察细胞与培养皿中央材料毗邻部位的形态。
1.2.5 材料提取物细胞毒性测定 ⑴取超声处理过的脱细胞血管支架100 mg,用无菌剪刀尽可能地剪碎,组织碎片放入可密封消毒试管中,称质量,加入DMEM培养液200 ml(2 ml/mg组织)。密封试管后于37℃孵育96 h,离心(1400 r/min,20 min)、取上清液、0.2 μm滤器过滤后测定体积。⑵MTT法检测细胞增殖活性。选取培养的3~5代的兔血管内皮细胞,常规传代以细胞密度约5×106/孔,分别接种于6块96孔培养板中,每孔加入细胞悬液200 μl,移入37℃、5%CO2孵箱培养 24 h;生长至铺满80%孔底后,取3块96孔培养板,实验组加入含材料提取液的培养液100 μl;试验浓度设5个复孔,并设阴性对照孔(DMEM培养液100 μl)和空白孔(无细胞),3块板继续培养不同时间(12、24、36 h)后进行MTT实验。先吸去孔内培养液,每孔加入MTT溶液 20 μl(5 mg/ml用PBS稀释pH=17.4),37℃、5%CO2恒温孵箱培养4 h,终止培养,弃上清液。每孔加二甲基亚砜(杭州四季青生物有限公司)150 μl,在酶标仪内振荡10 min,于 492 nm波长处测定各孔吸光度(A值)。每组实验重复5次,取平均A值。以时间为横坐标,吸光值为纵坐标绘制细胞生长曲线。
1.2.6 脱细胞血管基质对于内皮细胞亲和力的研究 将脱细胞血管基质和超声处理后的脱细胞血管基质,分别修剪为5 mm×25 mm的片状并黏附于细胞培养皿中,将准备的内皮细胞悬液依次接种于上述培养皿中,CO2培养箱中(37℃,5%CO2)分别孵育24、48、72、96、120 h以及1、2、3、4、5周后,分别取支架材料,石蜡包埋,切片,光镜观察内皮细胞在支架材料表面的黏附情况。
1.3 统计学处理
所有实验数据采用SPSS 12.0统计软件的单因素分析法。两样本均数比较,采用组间或配对比较t检验,P<0.05为差异有统计学意义。
2 结果
2.1 兔血管内皮细胞培养、鉴定及形态学观察 镜下可见单层细胞呈短梭状或鹅卵石样镶嵌排列(图1);免疫化学(SP)染色可见细胞胞浆中呈现棕黄色颗粒,提示细胞内存在vWF(图2);因此,从形态学及免疫组化学方面均证实培养细胞为内皮细胞。
2.2 材料的生物相容性测定结果
超声处理后材料的细胞毒性:⑴接触性细胞毒性。超声处理前后的脱细胞血管材料,均无细胞毒性,在材料的周围未发现内皮细胞的接触或生长抑制,测试样本周围的内皮细胞形态正常(图3)。经过超声处理的脱细胞血管材料内可见多量内皮细胞长入(图4)。⑵提取物细胞毒性。材料提取物的细胞毒性见表1。测定结果证明,原浓度材料提取液组对于细胞的抑制作用,与M199组无明显差异。选取原浓度材料提取液绘制作用后的EC生长曲线。

表1 材料提取液作用后EC吸光度变化
注:*P>0.05,同一时段原浓度液与M199组间比较;◇P>0.05,原浓度液不同作用时间组间比较
2.3 脱细胞血管基质对于内皮细胞亲和力的研究
2.3.1 脱细胞血管支架材料的细胞黏附性 组织学观察证实,将兔血管内皮细胞与单纯的脱细胞血管支架材料共培养48 h后便可在支架材料内膜面形成一单层的内皮细胞层(图5),但是在继续培养28 d后未发现有明显的细胞长入材料迹象(图6)。
2.3.2 超声处理后的脱细胞血管支架材料的细胞黏附性 组织学观察同样证实,血管内皮细胞与超声处理后的脱细胞血管支架材料共培养48 h后,便可在支架材料内膜面形成一单层的内皮细胞层(图7);继续培养7 d,可在支架材料内膜浅层发现内皮细胞长入(图8);培养至14 d时,支架材料内膜下层亦出现了内皮细胞(图9);培养至28 d时,更多的内皮细胞出现在支架材料内膜下层(图10)。
3 讨论
脱细胞血管支架因其具有低免疫源性、机械性能良好等优良特性,因此,在组织工程血管研究领域有着比较广泛的应用。然而其却存在材料致密性高,孔隙率小,一般条件下种子细胞很难长入支架内部的缺点。因此,如何在保证支架材料机械强度的同时,使材料疏松化、多孔化一直是困扰着脱细胞血管支架材料研究领域的一个难题。
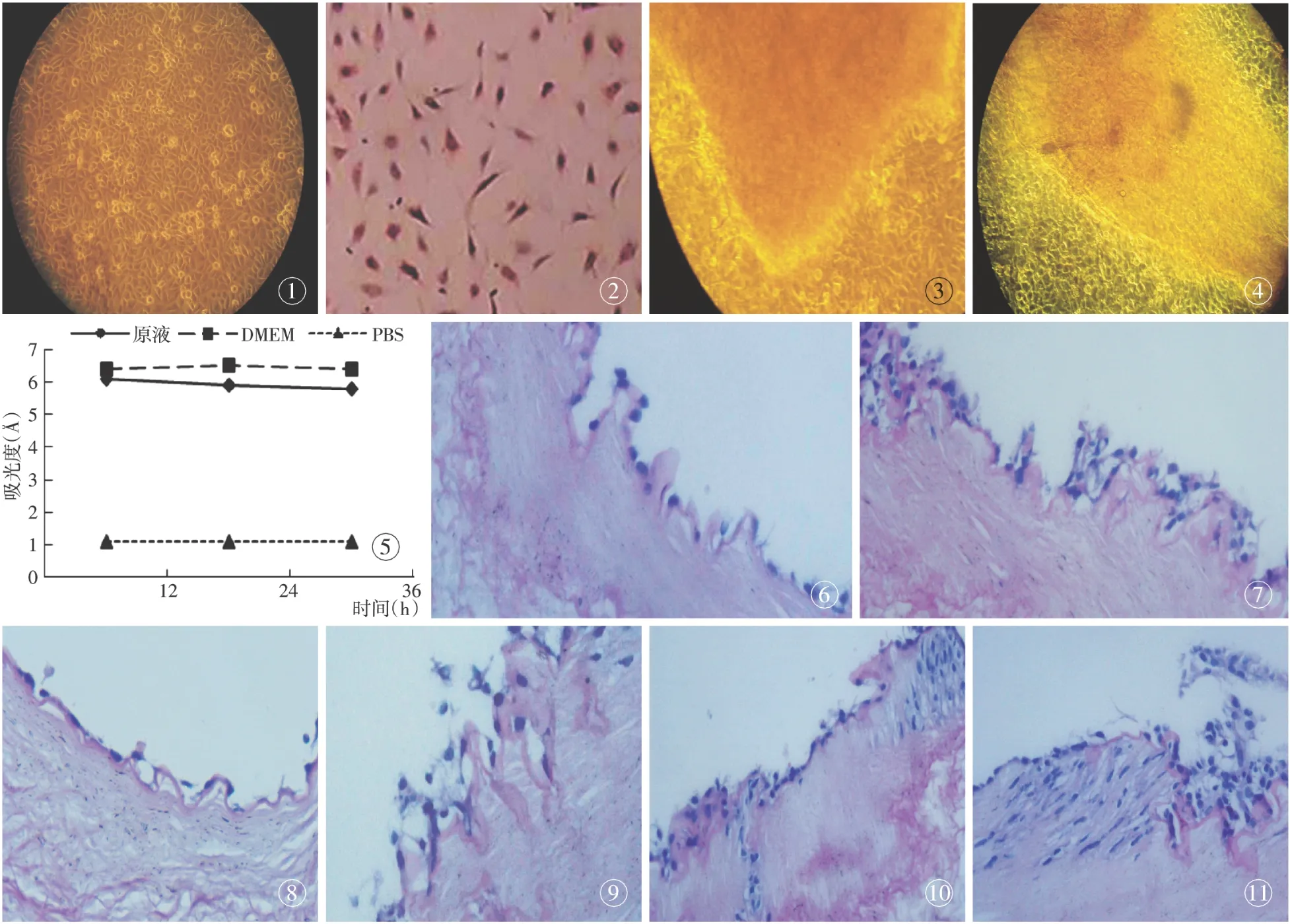
图1 血管内皮细胞(×40) 图2 血管内皮细胞vWF表达阳性(SP ×100) 图3 脱细胞支架与内皮细胞共培养(×40 ) 图4 超声处理脱细胞支架与内皮细胞共培养(×40) 图5 原浓度材料提取液作用后EC的生长曲线 图6 培养48 h单层内皮细胞(HE×100) 图7 培养28 d无内皮细胞长入(HE ×100) 图8 培养48 h单层内皮细胞 图9 培养7 d内膜浅层内皮细胞长入 图10 14 d内膜下层出现内皮细胞 图11 28 d更多内皮细胞出现在内膜下层
Fig 1 Vascular endothelial cells(VEC) (×40). Fig 2 vWF positive expression of VEC (SP ×100). Fig 3 Co-culture of EC and decellularized vascular scaffold (×40). Fig 4 Co-culture of EC and decellularized vascular scaffold treated with sonication (×40). Fig 5 Culture of monolayer EC at 48 hours. Fig 6 Culture of monolayer EC at 48 hours. Fig 7 No EC ingrowth at 28 days after culture. Fig 8 Monolayer EC ingrowth at 48 days after culture. Fig 9 Growth of EC into the superficial intima at 7 days after culture. Fig 10 EC in the subintima at 7 days after culture. Fig 11 More EC in the subintima at 28 days after culture.
超声生物材料处理的原动力是超声波引发的机械、流体力学、温度效应、光电效应、声空化等效应的综合作用,其中声空化往往占据主导地位。但是,不同的声处理目的对超声场的要求不同。因此,对超声场有关声学参数的优化是该领域应用技术的关键。 近年来,声空化作用引起的特殊物理和化学环境为科学家制备和加工各种组织工程生物材料提供了新的途径[8,10-12],声空化方法正成为制备具有特殊性能材料的一种新技术。
良好的生物力学特性和组织相容性是作为组织工程血管支架材料的重要因素。在我们前面的试验中提示:超声处理参数为强度300 W,间隔1 s,时长1 min,脱细胞血管材料的疏松程度和材料的生物力学强度处于一个较均衡的水平,与未经超声处理材料相比,超声处理可以使兔股动脉脱细胞血管基质的胶原结构明显疏松,孔隙率增大,同时材料机械强度无明显降低[8]。而在本实验中,我们通过接触性细胞毒性试验以及提取物细胞毒性试验,结果表明,经过超声处理后脱细胞血管基质材料具有良好的体外细胞相容性。而超声处理的脱细胞血管基质与内皮细胞的亲和力进行的研究表明,超声处理前后的脱细胞血管基质与内皮细胞共培养48 h后,都可在材料的表面观察到单层的内皮细胞覆盖。然而在继续培养2周后,未经超声处理的材料表面仍然只有单层的内皮细胞覆盖,其浅层及深层未见长入的内皮细胞。而与此不同的是,经过超声处理的材料在与内皮细胞经过2周的共培养后,我们发现,其浅层及中层出现了内皮细胞的黏附和长入。二者在细胞黏附并长入材料内部的区别主要在于其胶原结构的不同。由此我们可以推断:经过超声处理的脱细胞血管支架其胶原结构较未处理前明显疏松,而这种疏松的结构为种子细胞的长入提供了必要的先决条件。另外,我们还发现,通过4周或者更长时间的体外培养,超声处理后的血管材料中心区域仍然很难发现有内皮细胞的长入,这些现象可能是由于材料深部胶原结构相对于外层仍然较致密,营养成分无法在材料中心充分满足细胞生长需要等原因造成。
4 结论
本研究通过对强度为300 W超声处理后的脱细胞血管支架材料的生物学相容性进行检测和观察,发现处理后的支架材料,其疏松化程度在明显提高的同时,仍具有良好的生物学相容性。通过我们的研究表明,利用超声声空化效应可以达到为脱细胞基质类生物材料致密结构改性的目的。这一结论为今后解决脱细胞基质材料结构致密的问题提供了一定的思路。
[2] Cho SW, Park HJ, Ryu JH, et al. Vascular patches tissue-engineered with autologous bone marrow-derived cells and decellularized tissue matrices[J]. Biomaterials, 2005,26(14):1915-1924.
[3] Oberpinning F, Meng J, Yoo JJ, et al. De novo reconstitution of a functional mammalian bladder by tissue engineering[J]. Nat Biotechnol, 1999,17(2):149-158.
[4] Sodian R, Lemke T, Loebe M, et al. New pulsatile bioreactor for fabrication of tissue engineered patches[J]. J Biomed Mater Res, 2001,58(12):401-405.
[5] Vunjak-Novakovic G, Obradovic B, Martin I, et al. Dynamic cell seeding of polymer scaffolds for cartilage tissue engineering[J]. Biotechnol Prog, 1998,14(12):193-202.
[6] Godbey WT, Stacey Hindy BS, Sherman ME, et al. Novel use of centrifugal force for cell seeding into porous scaffolds[J]. Biomaterials, 2004,25(14):2799-2805.
[8] 刘 宾, 李 菲, 张蔓菁, 等. 超声空化法对脱细胞血管支架组织结构及生物力学特性影响的实验研究[J]. 中国美容整形外科杂志, 2015,26(12):755-759.
[9] 刘 宾, 张蔓菁, 夏 炜, 等. 反复冻融与超高压处理制备脱细胞组织工程血管支架的实验研究[J]. 中国美容整形外科杂志, 2009,12(20):761-764.
[10] Dorj B, Won JE, Purevdorj O, et al. A novel therapeutic design of microporous-structured biopolymer scaffolds for drug loading and delivery[J]. Acta Biomater, 2014,10(3):1238-1250.
[11] Mercuri JJ, Gill SS, Simionescu DT. Novel tissue-derived biomimetic scaffold for regenerating the human nucleus pulposus[J]. J Biomed Mater Res A, 2011,96(2):422-435.
[12] Lee JB, Jeong SI, Bae MS, et al. Highly porous electrospun nanofibers enhanced by ultrasonication for improved cellular infiltration[J]. Tissue Eng Part A, 2011,17(21-22):2695-2702.
[13] Zhang C, Huang P, Zhang Y, et al. Anti-tumor efficacy of ultrasonic cavitation is potentiated by concurrent delivery of antiangioge nic drug in colon cancer[J]. Cancer Lett, 2014,347(1):105-113.
Experimental research of biocompatibility of the decellularized vascular scaffolds treated by ultrasound cavitation
LIUBin,LIFei,ZHANGMan-jing,LUKai-hua.
(DepartmentofBurnsandPlasticSurgery,Xi′anCentralHospital,Xi′an710003,China)
LUKai-hua,Email:lukaihua@fmmu.edu.cn
Objective To detect the biocompatibility of decellularized vascular scaffolds after 300 watts sonication. Methods Under sterile conditions, fresh blood from the femoral artery was isolated from rabbits and then nuclease digestion was performed after treatment with repeated freezing-thawing cycles and supertension. The decellularized vascular scaffolds were formed after removal of rudimental cell debris. Ultrasonic waves at an intensity of 300 watts were used to treat the scaffolds and then the biocompatibility of the treated scaffolds was detected and observed. Results With the 300 watts intensity ultrasonic treatment, a looser structure of the scaffolds was found without apparent cytotoxcity and seed cells could grow easily inside materials. Conclusion The decellularized vascular scaffolds treated by the ultrasound cavitation method may provide a new method to obtain the decellularized vascular scaffolds with better biocompatibility.
Tissue engineering blood vessels; Decellularized vascular scaffolds; Ultrasonic; Biocompatibility
刘 宾(1977-),男,陕西西安人,副主任医师,副教授,博士,硕士研究生导师.
鲁开化,710032,第四军医大学西京医院 整形外科,电子信箱:lukaihua@fmmu.edu.cn
10.3969/j.issn.1673-7040.2016.08.018
R318.11
A
1673-7040(2016)08-0499-04
2016-05-27)
