激活VEGF-C/VEGFR-3信号通路调控淋巴管生成对慢性结肠炎的影响
2016-08-11王晓蕾
赵 静 王晓蕾
激活VEGF-C/VEGFR-3信号通路调控淋巴管生成对慢性结肠炎的影响
赵静王晓蕾
200065上海,同济大学附属同济医院消化内科
炎症性肠病(IBD)是一组病因及发病机制尚未明确的慢性非特异性肠道炎性疾病,主要包括克罗恩病(CD)和溃疡性结肠炎(UC)。近年来研究表明,IBD的发病及病情迁延与淋巴管生成有关。早在20世纪初期就有大量报道指出CD患者的病变肠道中可见淋巴管阻塞、组织水肿等表现,表明慢性淋巴管炎的存在。但目前关于淋巴管与IBD的病情进展与维持的关系研究并不多。肿瘤、皮肤慢性炎性反应实验研究显示,淋巴管特异性血管内皮生长因子受体3(VEGFR-3)可经血管内皮生长因子-C(VEGF-C)激活,促进淋巴管内皮细胞增殖、迁移和淋巴管新生,在肿瘤淋巴结转移、促进炎症引流方面有一定作用。因此,本研究将以葡聚糖硫酸钠(DSS)诱导的小鼠慢性结肠炎模型为研究对象,通过高表达VEGF-C激活VEGFR-3信号通路,检测小鼠疾病活动指数(DAI)、结肠组织病理学评分、淋巴管密度(LVD)及管径大小的变化,探讨淋巴管生成对慢性结肠炎的影响。
1材料与方法
1.1实验动物
8~10周龄健康雌性C57BL/6小鼠25只,购于上海西普尔-必凯实验动物有限公司,饲养于上海市同济医院SPF级动物实验室,温度维持在20℃~24℃,相对湿度维持在40%~70%,12 h光照再12 h黑暗。
1.2慢性结肠炎模型制备及实验设计
以无菌纯水配制的2% DSS溶液饲喂小鼠5 d后更换为无菌纯水饲喂5 d,此作为一个循环,重复饲喂3个循环建立慢性结肠炎模型。正常组(5只)小鼠不进行处理;DSS模型组(10只)小鼠依上述方法诱导慢性结肠炎模型;高表达VEGF-C腺病毒(Ad-VEGF-C-EGFP)刺激组(10只)小鼠建立慢性结肠炎模型,且于每个循环结束时尾静脉注射Ad-VEGF-C-EGFP(5×108~5×109pfu/mL) 100 μL。3个循环结束后第7 天处死小鼠,留取全结肠标本。所有小鼠均自由取食灭菌饲料,DSS溶液隔天更换。
1.3Ad-VEGF-C-EGFP构建及主要试剂
1.4DAI监测
在建模过程中,隔日观察并记录小鼠的体质量、粪便性状、肠道出血情况这3个指标,计算小鼠DAI得分,间接评价结肠炎性反应的严重程度。DAI评分标准如下:体质量减轻程度(无减轻为0分,1%~5%为1分,5%~10%为2分,10%~20%为3分,>20%为4分),粪便性状(正常为0分,松散粪便为2分,腹泻为4分),肠道出血情况(无出血为0分,粪便隐血为2分,肉眼血便为4分);DAI得分即为上述指标总和[1]。
1.5组织病理学评分
取远端结肠组织(0.5 cm)于4%甲醛溶液中固定,常规处理切片后经苏木精-伊红(HE)染色,观察结肠组织炎性反应的严重程度。组织病理学评分标准如下:隐窝结构(正常为0分,严重的隐窝变形为3分),炎性细胞浸润程度(正常为0分,稠密的炎性细胞浸润为3分),肌层增厚情况(隐窝基底位于黏膜肌层上为0分,肌层显著增厚为3分),杯状细胞损失(无为0分,有为1分),隐窝脓肿(无为0分,有为1分);组织病理学得分即为上述指标总和。
1.6结肠LYVE-1免疫组织化学染色及结果评估
标本取自远端结肠组织,切片(4 μm)常规脱蜡,置柠檬酸钠溶液中微波炉加热进行抗原修复,切片经3%牛血清蛋白室温封闭后,依次孵育兔抗鼠LYVE-1多克隆抗体(1∶200)及酶标山羊抗兔二抗。经DAB显色后,常规脱水、透明、封片。LYVE-1表达阳性的管腔即为淋巴管[2-3]。光学显微镜(×100)下观察LYVE-1阳性管腔。每张片子选取5处淋巴管高密度区,计数该区域LYVE-1阳性管腔数,取平均值即为LVD,同时测量淋巴管的管径大小(取长径),比较各组间LVD及管腔扩张。
1.7统计学方法
采用统计学软件SPSS20.0进行统计学分析,实验数据以均数±标准差表示,组间比较采用独立样本t检验。数据图片由GraphPad Prism 5.0处理生成。P<0.05表示差异有统计学意义。
回到家,我赶紧把这个好消息告诉爸爸妈妈。妈妈表扬了我,并答应送我一个礼物。我有些得意忘形,把头转向爸爸,期待他的表扬。没想到,他只是轻描淡写地看了一眼,脸上的神情很冷淡,“考得不怎么样,简答题还不够完整。”
2结果
2.1体外VEGF-C表达
以Ad-VEGF-C-EGFP及Ad-EGFP转染人胚肾293细胞,RT-qPCR检测体外VEGF-C表达。结果显示,与Ad-EGFP感染细胞、未感染细胞相比较,Ad-VEGF-C-EGFP感染293细胞中VEGF-C蛋白的表达明显升高,差异有统计学意义(P<0.001)。
2.2小鼠DAI的变化
统计分析显示,与正常组(0.03±0.02)相比较,VEGF-C组小鼠(1.94±0.15)、DSS组(2.52±0.21)的DAI明显升高,差异均有统计学意义(P<0.01);VEGF-C组小鼠DAI相较于DSS组明显下降,尤其在实验第9天、第15天、第27天的差异有统计学意义(P<0.05)。
2.3结肠组织病理学评分
光镜下每张HE染色片子随机选取3个视野,依据上述评分标准进行评分,取平均值作为该结肠组织的病理学得分。光镜下可见DSS组、VEGF-C组结肠均出现隐窝结构变形紊乱、炎性细胞浸润、杯状细胞缺失、黏膜下水肿改变(见图1)。统计分析显示,与正常组(0.67±0.58)相比较,DSS组(7.67±0.58)、VEGF-C组(4±0.71)的组织损伤较明显,差异均有统计学意义(P<0.01)。与VEGF-C组相比较,DSS组的组织病理学得分更高(P<0.01)。

图1结肠HE染色及组织病理学得分ADSS组(×100)BVEGF-C组(×200)C各组结肠组织病理学得分
2.4结肠淋巴管数量及分布情况
光镜下免疫组织化学切片显示,与正常组相比较,DSS组与VEGF-C组的LVD有所增加,且VEGF-C组结肠淋巴管的管腔扩张更明显(见图2)。统计分析显示,与正常组(16.73±2.52)相比较,DSS组(19.67±1.67)、VEGF-C组(20.43±3.47)小鼠结肠LVD变化的差异无统计学意义(P>0.05)。淋巴管管径分析显示,与正常组(102.65±21.00)相比,DSS组(166.06±10.16)、VEGF-C组(196.97±7.08)淋巴管的管径明显扩张,差异均有统计学意义(P<0.05),VEGF-C组小鼠淋巴管扩张相较于DSS组更显著(P<0.05)。
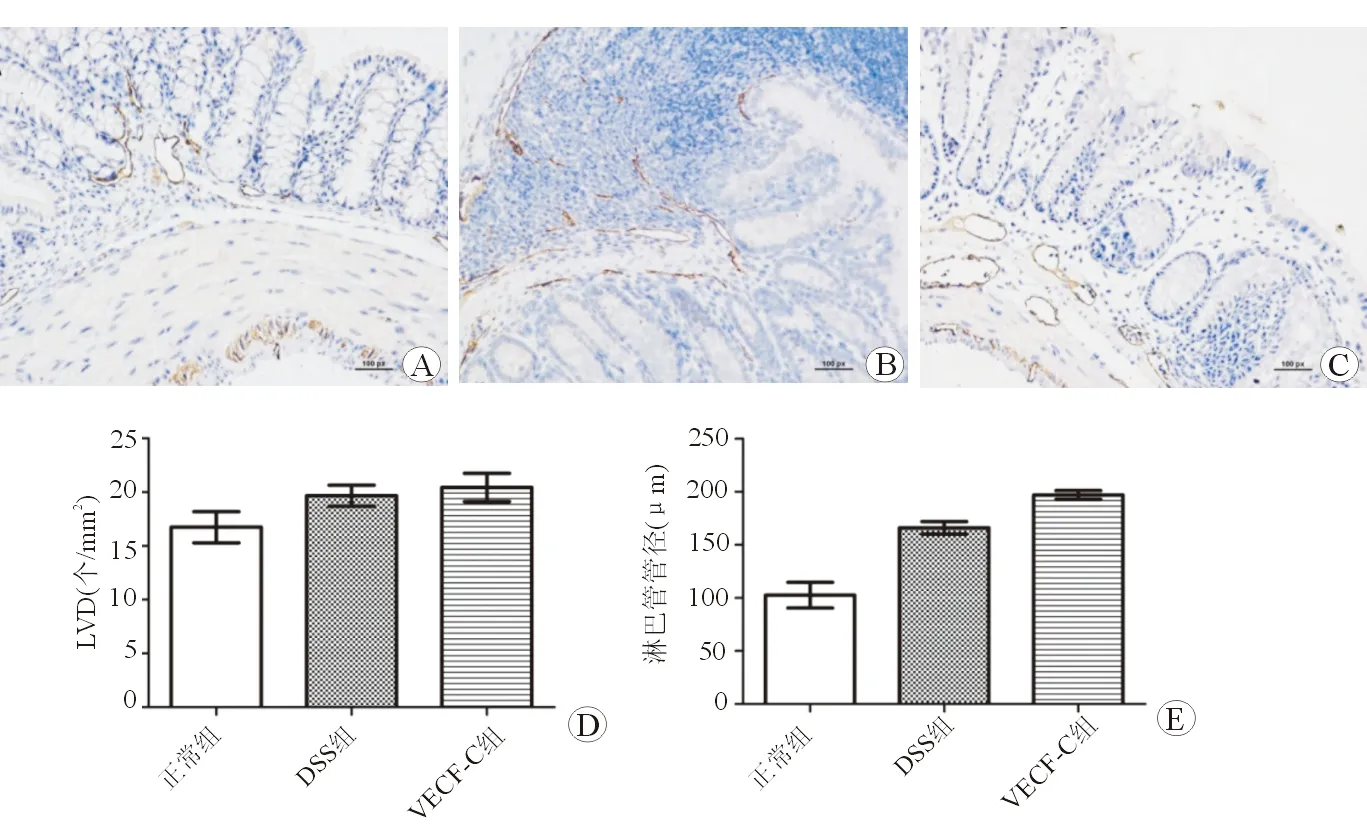
图2结肠LYVE-1免疫组织化学染色及淋巴管情况A正常组(×200)BDSS组(×200)CVEGF-C组(×200)D各组结肠LVD检测E各组结肠淋巴管管径测量
3讨论
生理状态下,淋巴管系统具有维持组织间质液体平衡、调节免疫反应、引流白细胞和清除细菌等重要功能。淋巴管积极参与了慢性炎性反应。尽管淋巴管在IBD发病及疾病维持中的作用尚无定论,但是IBD患者的结肠组织一直存在淋巴管阻塞、功能失调等现象[4-5]。有研究指出,IBD中的淋巴管生成是炎性反应早期机体的一种代偿反应,可减轻组织水肿、缓解炎性反应。随着炎性反应的进展,组织水肿加重,淋巴管炎出现,淋巴管引流白细胞和液体的功能障碍,导致局部炎性反应加重并持续[3,6-7]。目前已有研究表明,IBD患者、小鼠慢性结肠炎模型中炎性结肠组织淋巴管数量明显增加[1,6-7]。
VEGFR-3(又称Flt4)是较早被识别的淋巴管特异性生长因子受体[8],可特异性结合VEGF-C、VEGF-D配体后被激活,促进淋巴管内皮细胞增殖、迁移和淋巴管新生。Tammela等[9]研究显示,通过高表达VEGF-C激活VEGFR-3通路,可使小鼠集合淋巴管向淋巴结引流功能恢复。在小鼠慢性关节炎中,经高表达VEGF-C病毒处理后的小鼠,其关节积液量明显减少、炎性反应好转,同时关节组织中淋巴管生成增多、管径扩张、局部淋巴管引流功能增加[10]。特异性抗体阻断VEGFR-3通路可见组织中淋巴管生成减少,淋巴管引流功能下降,组织炎性反应加重[2,11-12]。由此可见,VEGF-C/VEGFR-3信号通路可通过调控淋巴管生成、增强淋巴管引流功能来控制慢性炎性反应。
本研究通过高表达VEGF-C腺病毒对小鼠慢性结肠炎进行干预,激活VEGF-C/VEGFR-3通路。统计分析显示,经VEGF-C刺激后小鼠DAI明显下降,尤其在饲喂DSS诱导炎性反应加重后较DSS组下降显著,提示可缓解炎性反应。结肠组织病理学评分显示VEGF-C组较DSS组显著下降,但仍未达到正常水平,表明刺激VEGF-C/VEGFR-3通路可一定程度上缓解慢性结肠炎。LYVE-1免疫组织化学染色分析显示,3组小鼠的结肠组织间淋巴管密度未见明显差异,但VEGF-C组与DSS组淋巴管管径较正常组扩张明显,且VEGF-C组管径扩张更为显著。目前大量研究显示,促进淋巴管生成、增强淋巴管引流功能在控制慢性炎性反应方面具有巨大潜力,而IBD患者的结肠组织已表现为淋巴管数量增加、淋巴管阻塞、淋巴管炎,但结肠炎性反应未见缓解,提示单纯增加淋巴管数量对控制炎性反应的效果不佳,恢复、提升组织淋巴管引流功能才是促进炎症缓解的重点。本研究中VEGF-C组小鼠DAI及组织病理学评分提示炎症缓解,而结肠淋巴管数量未见明显增加,仅管腔扩张显著,由此可见,促进淋巴管扩张可增强淋巴管对炎症引流,缓解慢性结肠炎症。
综上所述,刺激VEGF-C/VEGFR-3通路主要通过刺激淋巴管进一步扩张、增加对炎症的引流来缓解慢性结肠炎症。VEGF-C在控制IBD病情进展方面具有重要的治疗意义。
参考文献
1 D′Alessio S, Correale C, Tacconi C, et al. VEGF-C-dependent stimulation of lymphatic function ameliorates experimental inflammatory bowel disease[J]. J Clin Invest, 2014, 124: 3863-3878.
2 Jurisic G, Sundberg JP, Detmar M. Blockade of VEGF receptor-3 aggravates inflammatory bowel disease and lymphatic vessel enlargement[J]. Inflamm Bowel Dis, 2013, 19: 1983-1989.
3 Jurisic G, Sundberg JP, Bleich A, et al. Quantitative lymphatic vessel trait analysis suggests Vcam1 as candidate modifier gene of inflammatory bowel disease[J]. Genes Immun, 2010, 11: 219-231.
4 Heatley RV, Bolton PM, Hughes LE, et al. Mesenteric lymphatic obstruction in Crohn′s disease[J]. Digestion, 1980, 20: 307-313.
5 Van Kruiningen HJ, Hayes AW, Colombel JF. Granulomas obstruct lymphatics in all layers of the intestine in Crohn′s disease[J]. APMIS, 2014, 122: 1125-1129.
6 Pedica F, Ligorio C, Tonelli P, et al. Lymphangiogenesis in Crohn′s disease: an immunohistochemical study using monoclonal antibody D2-40[J]. Virchows Arch, 2008, 452: 57-63.
7 Rahier JF, De Beauce S, Dubuquoy L, et al. Increased lymphatic vessel density and lymphangiogenesis in inflammatory bowel disease[J]. Aliment Pharmacol Ther, 2011, 34: 533-543.
8 Kaipainen A, Korhonen J, Mustonen T, et al. Expression of the fmslike tyrosine kinase 4 gene becomes restricted to lymphatic endothelium during development[J]. Proc Natl Acad Sci U S A, 1995, 92: 3566-3570.
9 Tammela T, Saaristo A, Holopainen T, et al. Therapeutic differentiation and maturation of lymphatic vessels after lymph node dissection and transplantation[J]. Nat Med, 2007, 13: 1458-1466.
10 Zhou Q, Guo R, Wood R, et al. Vascular endothelial growth factor C attenuates joint damage in chronic inflammatory arthritis by accelerating local lymphatic drainage in mice[J]. Arthritis Rheum, 2011, 63: 2318-2328.
11 Guo R, Zhou Q, Proulx ST, et al. Inhibition of lymphangiogenesis and lymphatic drainage via VEGFR-3 blockade increases the severity of inflammation in chronic inflammatory arthritis[J]. Arthritis Rheum, 2009, 60: 2666-2676.
12 Huggenberger R, Ullmann S, Proulx ST, et al. Stimulation of lymphangiogenesis via VEGFR-3 inhibits chronic skin inflammation[J]. J Exp Med, 2010, 207: 2255-2269.
(本文编辑:周骏)
基金项目:国家自然基金青年基金(81200260)
通信作者:王晓蕾,Email: wangxiaolei@tongji.edu.cn
DOI:10.3969/j.issn.1673-534X.2016.03.015
(收稿日期:2016-01-30)
