脂肪变肝细胞中炎性调节蛋白A20的表达机制
2016-08-11许青青艾罗燕吴昌维苏大芝王晓晗陈志威江小柯范竹萍
许青青 艾罗燕 吴昌维 苏大芝 王晓晗 陈志威 江小柯 林 卿 范竹萍
脂肪变肝细胞中炎性调节蛋白A20的表达机制
许青青艾罗燕吴昌维苏大芝王晓晗陈志威江小柯林卿范竹萍
200001上海交通大学医学院附属仁济医院健康保健中心,上海市消化疾病研究所(许青青,艾罗燕,苏大芝,王晓晗,陈志威,江小柯,范竹萍);475000开封,河南大学附属淮河医院感染科(吴昌维);201203桑迪亚医药技术(上海)有限责任公司(林卿)
非酒精性脂肪性肝病(NAFLD)已被认为是一种慢性低度炎性反应状态[1],炎性反应在其复杂的发病机制中至关重要,是疾病向终末期肝病进展的关键。锌指蛋白A20是由核因子-κB(NF-κB)激活诱导的炎性反应负性调节蛋白,它通过可逆的去泛素化以及泛素化功能下调活化的NF-κB信号通路,从而抑制炎性反应[2]。近年来研究发现,A20对肝脏再生及功能恢复具有积极作用,可抑制肝损伤、肝移植、缺血再灌注等诱发的炎性反应[3-4],但是否对NAFLD有调控作用未见报道。前期研究已采用油酸和软脂酸比为2∶1的混合脂肪酸(FFA)作用HepG2细胞建立脂肪变模型,发现随着FFA浓度升高,A20的表达有时间限定性并呈现出一定的规律,推测A20可能是通过抑制NF-κB信号通路激活来抑制炎性反应的发生,从而改善NAFLD[5],本研究在此基础上进一步探讨A20表达时信号通路的激活情况。
1 材料与方法
1.1材料
肝癌细胞株HepG2由桑迪亚医药技术(上海)有限责任公司惠赠。主要试剂:DMEM高糖培养基、胎牛血清、0.25%胰酶(Gibco公司),二甲基亚砜(DMSO)、油酸钠、软脂酸钠(Sigma公司),三酰甘油(TG)试剂盒(南京建成生物工程研究所),RIPA(中)裂解液(碧云天生物技术研究所),兔抗人A20抗体、GAPDH抗体、HRP-偶联的羊抗兔IgG(Cell Signaling Technology公司),ECL化学发光试剂盒(Perkinelmer公司),人细胞因子检测试剂盒(BD公司)。其余试剂均为国产或进口分析纯。
1.2方法
1.2.1细胞培养及对照组取(3×105~5×105)/mL HepG2细胞,以含10%胎牛血清的DMEM培养液培养,置于37 ℃、含5%CO2的培养箱中孵育,隔天换液,并按1∶5传代培养。对照组用DMEM培养液培养细胞,无混合脂肪酸(FFA)母液。
1.2.2FFA配制分别取304.4 mg油酸和128.2 mg软脂酸,溶于10 mL甲醇,配成150 mmol/L FFA母液。根据实验需要,将母液按比例稀释成相应工作液,DMSO浓度为0.5%。
1.2.3细胞内TG含量测定将HepG2细胞按2×105/mL接种于6孔板中,常规培养24 h后更换培养液,用0.5 mmol/L FFA分别作用于HepG2细胞0、0.25、0.5、1、2、4、6、12、24 h;将6孔培养板中培养液吸出,冰PBS洗涤细胞2次,加入RIPA裂解液30 μL(含蛋白酶抑制剂),后置于冰上裂解30 min,刮出并转移至Eppendorf管;4 ℃,12 000 rpm离心15 min,小心吸取上清,转移至Eppendorf管;按照TG试剂盒说明书进行操作,测定细胞内的TG含量。
1.2.4细胞内蛋白表达检测将HepG2细胞2×105/mL接种于6孔板,次日加入0.5 mmol/L FFA作用6、12、24 h后,加入细胞裂解液,收取蛋白样品行SDS-PAGE电泳,湿法电转移法转移到NC膜,5%脱脂牛奶封闭2 h,分别加入A20(1∶1 000稀释)和GAPDH(1∶10 000稀释),4 ℃摇床孵育过夜,二抗(1∶20 000稀释)室温孵育1 h。ECL发光剂显色后,置暗盒曝光于X胶片上,常规显影、定影后,扫描条带,用Quality One分析软件半定量结果,目的蛋白表达量=目的蛋白条带灰度值/GAPDH条带灰度值。
1.2.5细胞上清中白细胞介素-8含量测定收集相应的细胞上清100 μL,2 mL标准品稀释液加到标准品中溶解,室温静置15 min;制定标准曲线,取6个bead各2 μL/样品,PE director各12 mL/样品,两者振荡混匀;96孔“V”型板中,加入24 μL上述混合物;加入样品或各个浓度标准品12 μL/孔,上下吹匀;25 ℃,150 rpm,避光孵育3 h;加入150 μL/孔wash buffer,200 g,离心5 min;甩掉液体,200 μL/孔wash buffer;转移至流式管中,最后流式细胞仪上机操作(按说明书设立程序进行)。
1.3统计学分析
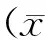
2结果
2.1细胞内脂质沉积
0.5 mmol/L FFA在0~24 h不同时间点作用于HepG2细胞后,测得细胞内TG含量0时为(0.07±0.00)mmol/L,随着作用时间的延长,从4 h开始增加,12 h到达峰值(0.13±0.00)mmol/L(P<0.05)(见图1)。

注:与对照组相比较,#P<0.05
图1细胞内TG含量
2.2细胞内蛋白表达水平
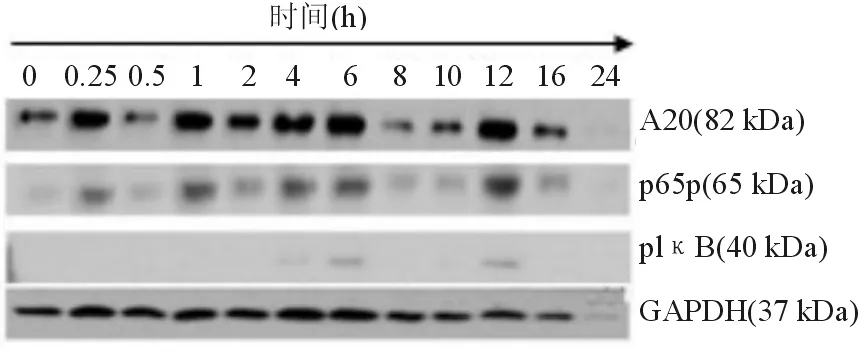
0.5 mmol/L FFA在0~24 h不同时间点作用于HepG2细胞时,发现各个时间点A20的表达不同,呈波浪状起伏,与对照组相比,A20、pIκB在0.25、1、4、6、12 h时表达升高,活化的p65(p65p)在4、6、12 h时表达显著升高,表明FFA介导NF-κB信号通路活化,A20被诱导呈瞬时表达(见图2、图3)。
注:1Da=0.9921 u
图2HepG2细胞在不同时间点的蛋白A20、p65p、pIκB表达

图 3 HepG2细胞在不同时间点的蛋白A20、p65p、pIκB半定量结果
2.3细胞上清中白细胞介素-8含量
0.5 mmol/L FFA在0~24 h不同时间点作用于HepG2细胞时,与对照组(9.57±1.95)相比,在4、6、12、24 h时细胞上清中的白细胞介素-8(IL-8)水平显著升高[(69.83±3.65)、(95.20±3.95)、(51.34±3.45)、(35.57±3.15) ng/mL](P<0.05),分泌时相呈先升高后降低趋势,6 h时为峰值(见图4)。

注:与对照组相比,#P<0.05
图4HepG2细胞在不同时间点的细胞上清中IL-8含量
3讨论
NAFLD是一种慢性低度炎性反应状态已成为国际共识,炎性反应是其进展的重要原因[6],这种炎性反应不仅可以加重胰岛素抵抗,影响营养物质代谢,还使得原本静息的肝星状细胞活化,促进了肝纤维化、肝硬化的发生,因此抑制炎性反应对阻断疾病进展具有重要意义。NF-κB通路是此慢性炎性反应发生的主要信号通路[7],NF-κB是一个异源二聚体蛋白(p50/p65),在大部分细胞中处于失活状态,被其抑制蛋白(IκB)禁锢在细胞质中,只有在刺激信号的作用下,IκB在IκB激酶复合体(IKK)的作用下快速发生磷酸化修饰形成pIκB,而后被26S蛋白酶体降解,从而释放 NF-κB蛋白,p65p发生核转移,启动一系列的炎性反应基因转录。锌指蛋白A20是由NF-κB通路激活诱导的炎性反应负性调节蛋白,具有双重泛素编辑酶活性,通过抑制转录因子NF-κB 的活化,阻断炎性反应持续发生及炎性因子表达,从而广泛参与炎性反应及免疫的调节[8-9]。那么,A20对NAFLD是否有调控作用成为本研究最关心的问题。
本研究通过原先建立的NAFLD细胞模型,在此基础上进一步利用0.5 mmol/L FFA在不同时间点作用于HepG2细胞,细胞内TG含量随时间延长而增加,细胞上清中IL-8水平在4 h时显著升高,峰值出现在6 h,其后逐渐降低,呈现脉冲相表达,提示FFA能诱发脂肪沉积和炎性反应。这与以往研究报道一致,如Li等[10]发现FFA通过作用于Toll样受体(TLR)内源性配体,激活IKK/NF-κB、JNK/AP-1信号通路,诱导NAFLD形成;同样Joshi-Barve等[11]用软脂酸刺激肝细胞(HepG2、鼠原代肝细胞、人原代肝细胞)后,NF-κB、JNK/AP-1信号通路激活,IL-8水平升高。此外,本研究观察到NF-κB信号通路的激活:pIκB和p65p在4、6、12 h时表达显著升高,IL-8水平亦升高,随之A20表达升高,并呈波浪样的改变。这符合A20表达有明显的时效性特点,只要外界刺激能激活NF-κB,活化的NF-κB转移至细胞核内与A20启动子区的两个识别序列的κB元件结合,就能迅速启动A20基因的转录,而表达升高是机体的一种重要的内源性抗炎保护效应机制,可能对于调控肝内慢性低度炎性反应具有重要意义。有研究发现,肝内高表达A20后,大量参与脂代谢通路的基因和线粒体内膜多种调节代谢的基因表达上调,如脂肪酸、氨基酸、胆固醇及类固醇的合成基因表达升高,使脂代谢增强,加快能量输出,还影响外周脂肪流动、肝内脂肪酸摄取,肝细胞内TG快速蓄积等代谢过程,说明A20对肝脏的保护作用不仅仅局限于抑制损伤、移植及缺血再灌注所诱发的炎性反应,还具有调节脂质代谢、产生能量的作用[12]。可见A20在肝脏中的多方面作用正被逐渐发掘和广泛接受[13]。A20与炎性反应、代谢的关系及机制研究也备受关注,其在NAFLD疾病发展中的作用值得深入探讨。
本研究在HepG2细胞脂肪变模型中观察到FFA能诱导NF-κB信号通路激活,IL-8水平升高,A20负反馈表达升高,提示可上调A20的表达以加强机体固有免疫来发挥抗炎作用,为NALFD的防治提供可能的有效作用靶点。然而本实验中A20与NAFLD之间的关系探讨仅局限于细胞水平,更多深入的分子机制以及动物水平的表达规律有待进一步研究。
志谢感谢桑迪亚医药技术(上海)有限责任公司生物部各位老师在操作规范和实验技术上给予的指导
参考文献
1 Medina-Santillán R, López-Velázquez JA, Chávez-Tapia N, et al. Hepatic manifestations of metabolic syndrome[J]. Diabetes Metab Res Rev, 2013, Mar 7. [Epub ahead of print]
2 Harhaj EW, Dixit VM. Regulation of NF-κB by deubiquitinases[J]. Immunol Rev, 2012, 246: 107-124.
3 Studer P, da Silva CG, Revuelta Cervantes JM, et al. Significant lethality following liver resection in A20 heterozygous knockout mice uncovers a key role for A20 in liver regeneration[J]. Cell Death Differ, 2015, 22: 2068-2077.
4 da Silva CG, Studer P, Skroch M, et al. A20 promotes liver regeneration by decreasing SOCS3 expression to enhance IL-6/STAT3 proliferative signals[J]. Hepatology, 2013, 57: 2014-2025.
5 许青青, 吴昌维, 艾罗燕, 等. 游离脂肪酸诱导肝细胞脂肪变模型中锌指蛋白A20的表达及其作用机制[J]. 胃肠病学, 2013, 18: 95-99.
6 Tilg H, Moschen AR. Evolution of inflammation in nonalcoholic fatty liver disease: the multiple parallel hits hypothesis[J]. Hepatology, 2010, 52: 1836-1846.
7 Marra F. Nuclear factor-kappaB inhibition and non-alcoholic steatohepatitis: inflammation as a target for therapy[J]. Gut, 2008, 57: 570-572.
8 Bhoj VG, Chen ZJ. Ubiquitylation in innate and adaptive immunity[J]. Nature, 2009, 458: 430-437.
9 Sriskantharajah S, Ley SC. Cell biology. Turning off inflammation signaling[J]. Science, 2010, 327: 1093-1094.
10 Li LL, Chen L, Hu L, et al. Nuclear factor high-mobility group box1 mediating the activation of Toll-like receptor 4 signaling in hepatocytes in the early stage of nonalcoholic fatty liver disease in mice[J]. Hepatology, 2011, 54: 1620-1630.
11 Joshi-Barve S, Barve SS, Amancherla K, et al. Palmitic acid induces production of proinflammatory cytokine interleukin-8 from hepatocytes[J]. Hepatology, 2007, 46: 823-830.
12 Damrauer SM, Studer P, da Silva CG, et al. A20 modulates lipid metabolism and energy production to promote liver regeneration[J]. PLoS One, 2011, 6: e17715.
13 da Silva CG, Cervantes JR, Studer P, et al. A20--an omnipotent protein in the liver: prometheus myth resolved [J]. Adv Exp Med Biol, 2014, 809: 117-139.
(本文编辑:林磊)
通信作者:范竹萍,Email: zhuping_fan@163.com
DOI:10.3969/j.issn.1673-534X.2016.03.017
(收稿日期:2015-12-20)
