改良型乳腺癌淋巴结转移模型的制备及超声表现
2016-08-11刘玉玺LIUYuxi孙业全SUNYequan王苗苗WANGMiaomiao明ZHANGMing浩HEHao峰LIUFeng
刘玉玺LIU Yuxi孙业全SUN Yequan王苗苗WANG Miaomiao 张 明ZHANG Ming 贺 浩HE Hao 刘 峰LIU Feng
作者单位1.潍坊医学院医学影像学系 山东潍坊2610532.潍坊医学院心理学系 山东潍坊 261053
改良型乳腺癌淋巴结转移模型的制备及超声表现
刘玉玺1LIU Yuxi孙业全1SUN Yequan王苗苗2WANG Miaomiao 张 明1ZHANG Ming 贺 浩1HE Hao 刘 峰1LIU Feng
作者单位
1.潍坊医学院医学影像学系 山东潍坊261053
2.潍坊医学院心理学系 山东潍坊 261053
Department of Medical Imaging, Weifang Medical University, Weifang 261053, China
Address Correspondence to: LIU Feng E-mail: liufengwfmc@163.com
R445.1
2016-03-01
中国医学影像学杂志
2016年 第24卷 第6期:410-413
Chinese Journal of Medical Imaging 2016 Volume 24 (6): 410-413
目的 现行方法建立的乳腺癌动物模型多用于观察其生物学表现,不适于探索新的淋巴结转移治疗方案。本研究通过改良制作方法建立新型的乳腺癌淋巴结转移模型,为探索新的治疗方法提供实验动物模型。材料与方法 采用组织块包埋法将VX2传代瘤株种植于30只雌性兔左侧第3只乳头的乳垫内,每周采用触诊法和常规超声查看肿瘤及淋巴结生长情况。待触及肿大的淋巴结后切除乳腺癌组织。第4周随机摘取15枚淋巴结,采用病理学观察淋巴结形态及组织学改变。将游标卡尺与超声测量结果进行对照,比较其差异。结果 2周后,26只实验兔可触及乳腺内质韧的类圆形结节;超声呈低回声,边界欠清,内部及周边血流丰富。约3周后,23只实验兔的左侧腋窝处可触及肿大的淋巴结,病理证实为转移性淋巴结,淋巴结转移率为88.5%,造模成功率为76.7%。超声与病理两种方法测量淋巴结最大直径差异无统计学意义(P>0.05)。结论 改良法建立乳腺癌淋巴结转移模型周期短、成功率高、方法简单,能够为研究新疗法提供动物模型;常规超声能够实时监测肿瘤的生长状况,操作方便、快捷。
乳腺肿瘤;淋巴转移;超声检查, 乳房;病理学,外科;疾病模型,动物;兔
【Abstract】Purpose The present method of establishing the lymph node metastasis in breast cancer model is used to observe the growing features, but it is poor for exploring new therapeutic regimen. This study aims to establish a new model of lymph node metastasis of breast cancer in order to explore new therapeutic regimen.
Materials and Methods The VX2 tumor strain was planted in 30 female rabbits' outer quadrant of the left third nipple. The growth of tumor and the axillary lymph nodes were examined by palpation and ultrasonic weekly. Resected the breast cancer after palpitation the lymph nodes. Picked up 15 lymph nodes randomly at the fourth week and the tumor size, shape and histological changes were observed. Results Two weeks later, hard, tough and round nodules were detected in 26 rabbits' breast; presented as hypoechoic nodules with unclear border, internal and periphery rich blood supply. Three weeks later, enlarged left axillary lymph nodes could be detected in 23 rabbits. Therefore, the metastasis rate was 88.5% and the success rate was 76.7%. The maximum diameter was measured both by ultrasound and vernier caliper, but there was no significant difference (P>0.05). Conclusion The advantages of establishing the new model were time saving, easy operation, high success rate, as well as monitoring anytime by ultrasound. It provides a new lymph node metastasis of breast cancer model for exploring new treatment methods.
【Key words】Breast neoplasms; Lymphatic metastasis; Ultrasonography, mammary;Pathology, surgical; Disease models, animal; Rabbits
女性癌症患者中乳腺癌发病率最高,30~59岁女性为乳腺癌高发人群,乳腺癌也是45岁以下女性最常见的癌症死因[1],其中肿瘤淋巴转移是导致治疗失败造成患者死亡的主要原因。目前针对术后淋巴结复发转移的治疗方法主要有化疗、放射治疗、永久性粒子植入[2]及实验阶段的淋巴靶向药物治疗[3],尽管治疗方法很多,但乳腺癌病死率依然很高,所以仍需探索新的治疗方法、开发新的药物来提高乳腺癌患者的生存率和改善预后。目前建立专门用于乳腺癌晚期治疗研究的大型实验动物模型报道较少,VX2组织块包埋法建立的兔乳腺癌淋巴结转移模型具有成瘤周期短、成功率高等优点。本实验主要探讨改良型乳腺癌淋巴结转移模型建立方法的可行性。
1 材料与方法
1.1 实验材料 8月龄普通级雌性新西兰大白兔30只,体重2.5~3.0 kg,购自山东省农科院(许可证号SCXK 20090013)。西门子乳腺容积成像系统,型号ACUSON S2000,探头为9L4,频率5~8 MHz。
1.2 兔VX2细胞株的制备 8月龄健康雌性经产新西兰大白兔30只,体重2.5~3.0 kg;雄性兔1只,体重2.2 kg,建荷瘤兔用于取材。用固定器将待接种的新西兰大白兔固定,盐酸利多卡因0.5 ml以0.1 ml/s缓慢局部注射至左下肢内侧(已备皮)肌肉丰富区。用无菌一次性手术刀在注射部位切开约1.0 cm开口,钝性分离皮下筋膜及肌肉,肌肉分离深度约0.5 cm。将液氮中冻存的VX2肿瘤组织37℃解冻复苏后,裁剪成大小约1.2 mm×1.2 mm×1.2 mm的组织块接种到切口中[4],逐层缝合。
1.3 乳腺癌淋巴结转移模型的建立 3周后,无菌条件下将瘤组织取出(直径约1.5 cm),取周边生长旺盛的鱼肉样组织,放入玻璃皿中,内盛滴加有庆大霉素的生理盐水(50 ml生理盐水含庆大霉素2万U),反复清洗并剔除瘤组织表面的血液和结缔组织。在另一培养皿中用眼科剪将组织块裁剪成1.0 mm3大小的瘤组织块备用。将实验兔仰卧位固定于兔台上,胸部剃毛,按外科无菌程序消毒术区皮肤,铺无菌洞巾。在其左侧胸壁第3乳头处局部注射利多卡因,轻柔片刻,用手术刀在距乳头1 cm的外上象限处作弧形切口,长度约1 cm,钝性分离筋膜暴露乳垫,用眼科镊子向乳腺实质中央斜插约0.5 cm深,并撑开少许,做成一直径约2.0 mm的窦道,拔出镊子压迫止血,取备用的1块肿瘤组织植入窦道底部。用直径约3 mm的明胶海绵填塞窦道入口处并轻压至彻底止血后逐层缝合腹壁。手术当天切口处撒青霉素,术后3 d肌肉注射青霉素20万U/(kg·d)预防感染。
1.4 病理学检查 每周采用直接触诊和超声检查肿瘤的生长情况,并记录肿瘤最大直径,用超声观察肿瘤内部血流特点。待直接触诊能触及质硬的淋巴结后行外科切除种植的乳腺癌组织,保留乳头。第4周超声检查完毕后随机取出15枚淋巴结做常规病理,用10%甲醛溶液固定,常规脱水、包埋和HE染色。
1.5 统计学方法 采用SPSS 20.0软件,淋巴结最大直径比较采用配对资料t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 模型成功率 30只兔造模,2周后26只成功长出乳腺移植瘤,造模成功率为86.7%;3周后23只发生淋巴结转移,转移率为88.5%(23/26),造模成功率为76.7%(23/30)。种植于乳腺的瘤组织1周即可用触诊法触及,质韧,活动度差,呈类圆形。3、4周即可触及质地较硬的转移淋巴结。
2.2 常规超声 3周后超声可见乳头下类圆形的低回声实性暗区,边界尚清(图1A),大小见表1;彩色多普勒血流显像(CDFI)示肿瘤周边和内部可见丰富的血流(图1B),血流速度较低。4周后可见肿大的转移性淋巴结内明显的低回声暗区,边界清楚(图1C),大小见表1;CDFI示淋巴结周边和(或)内部血流信号丰富(图1D)。阻力指数为0.35±0.05。
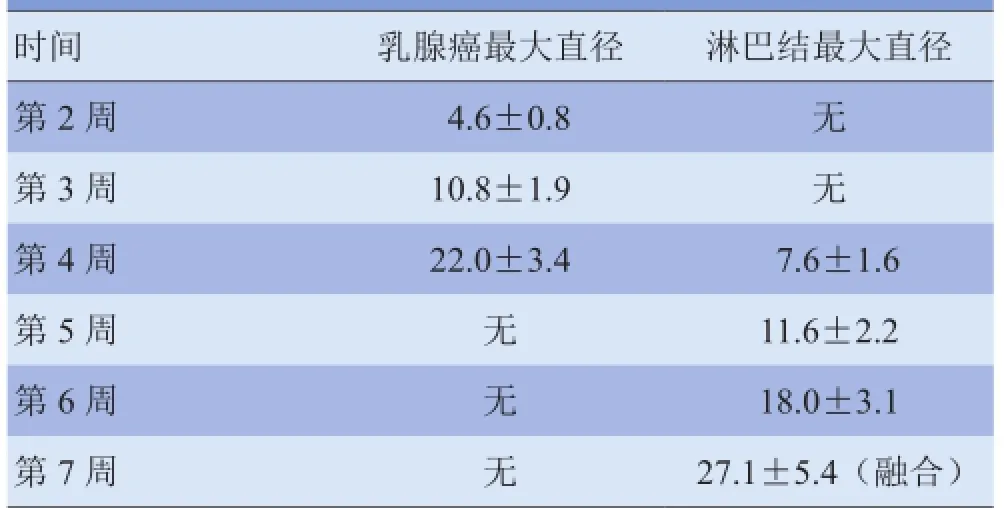
表1 超声法测得乳腺癌与淋巴结的最大直径(mm)
2.3 病理学检查结果 转移性淋巴结肉眼可见表面凸凹不平,表面大量的微血管生成(图2A),形态不规则,淋巴结门消失,大小(8.1±1.1)mm;纵行切开其内可见肿瘤转移灶,呈鱼肉样,边界不清;高倍镜下可见肿瘤细胞体积大,核异型性明显,呈多核,核浆比明显增大(图2B)。采用超声与病理两种方法测量的淋巴结最大直径差异无统计学意义(t=0.617,P>0.05)。
3 讨论
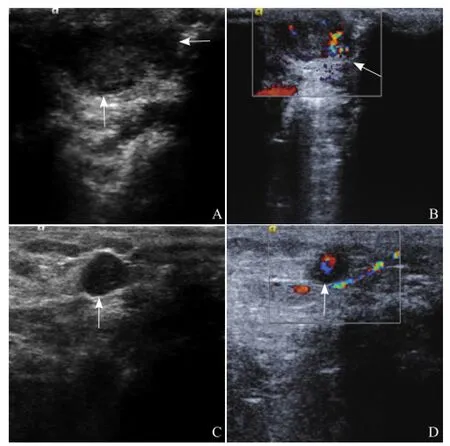
图1 种植的乳腺癌原位肿瘤及转移性淋巴结生长情况。A为乳腺原位移植瘤(箭)的超声图像;C为转移性淋巴结的超声图像(箭);B、D分别为乳腺原位移植瘤和转移性淋巴结的CDFI图,B中箭示瘤周血流信号,D中箭示转移性淋巴结内血流信号
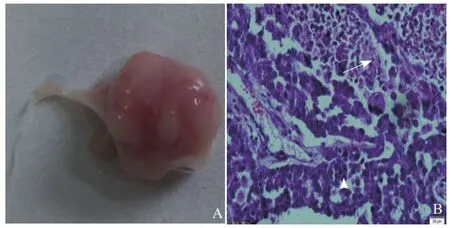
图2 转移性淋巴结的病理检查结果。A为随机摘取的转移性淋巴结,可见淋巴结表面生长有大量毛细血管;B为常规HE染色图片,箭头示癌细胞,箭示正常的淋巴细胞(HE,×400)
乳腺癌模型的建立方法有自发性乳腺癌动物模型、诱发性乳腺癌动物模型和移植性动物模型。随着科技的进步,基因敲除、基因打靶等技术为基因工程型[5]乳腺癌动物模型提供了技术保障,肿瘤基因模型也应运而生。尽管这些方法建立的动物模型均能引起淋巴结转移,但是自发性乳腺癌动物模型建立周期长,且肿瘤发生步调不一致;诱导性动物模型肿瘤形态各异,差异较大,恶性程度低,因此这两种方法在治疗方法和抗肿瘤药物的实验研究方面应用尚不广泛。尽管转基因法成功地建立了MMVT-Wnt-1转基因小鼠乳腺癌动物模型,但其体积小,对于创伤性大的外科手术耐受性差、条件要求高,带瘤生长周期短,不适合用于治疗方法的探索。移植性乳腺癌动物模型是用乳腺癌组织或细胞以至于实验动物培养出来的模型[6],移植方法包括肿瘤组织接种、组织块悬液接种、细胞悬液注射等[7]。细胞悬液注射法过程复杂,影响实验因素多,且转移率不高,高薇[8]将细胞悬液注射到裸鼠皮下,乳腺癌建模成功率为100%,但是无淋巴结转移。凌瑞等[9]应用新西兰大白兔作为实验动物建立乳腺癌模型,具有较高的转移率(91.3%)。本实验研究以上述学者的实验方法为基础并进一步改良,使之成为适合实验研究的乳腺癌腋窝淋巴结转移模型制作方法。
传统的组织块接种法是将瘤组织种植于乳垫内,后续对原位移植瘤未进行处理,此法建立的乳腺癌模型不适用于复发性淋巴结转移治疗方法的研究。改良法建立兔乳腺癌淋巴结模型是先将VX2组织块接种于左侧第3乳垫内,发生淋巴结转移以后再将原位种植的VX2移植瘤进行外科切除,此法的优势为:①种植成活率高,生物学性质稳定,生长迅速。近年来,国内外大量研究将VX2瘤株种植于肝、肾、肌肉、骨、膀胱、子宫、肺等部位,建立相应的原位肿瘤动物模型[10-11]。②瘤块包埋法建模简便易行、创伤小,原位成瘤率高,异位接种少。③建立方法改良后更接近于人类乳腺癌术后的情况。④排除了实验中非实验因素的影响。如果不切除原位肿瘤而在实验过程中发生了其他区域淋巴结转移,则不能判断在治疗淋巴结转移方面是否为失败;凌瑞等[9]研究兔VX2乳腺癌模型4周后出现液化坏死,如果伴发感染后动物死亡则不易确定死亡原因。⑤淋巴结转移率高[10,12],本实验中实验兔均发生腋窝淋巴结转移,与徐磊[13]的研究结果相似,腋窝淋巴结转移率高。采用超声检测肿瘤生长操作简单、省时,只需简单掌握超声操作方法即可。
本实验采用VX2肿瘤组织块包埋法建立兔乳腺癌淋巴结转移模型,符合理想动物肿瘤转移模型应具备的特点:①模拟了人类肿瘤转移途径,即有原发灶的逃逸过程。人类乳腺癌最主要的转移途径为淋巴道转移,该实验的腋窝淋巴结转移率为88.5%,低于凌瑞等[9]报道的91.3%,其可能原因为实验条件、瘤组织活性及实验动物本身的差异所致。②造模方法简单、易于接受,而且肿瘤生长应一致,可重复性建模,成瘤周期短,原位肿瘤成瘤期为2周,淋巴转移发生在3~4周。③肿瘤的病理生理特点与人类的肿瘤一致。④建模过程中动物死亡率低、损伤小,本实验无动物意外死亡。⑤实验过程中对环境污染及人体危害小。
总之,改良法建立动物模型成瘤周期短、方法简单易操作、转移率高,能够用于人类乳腺癌淋巴结转移治疗方面的实验研究。超声法探查和检测移植瘤的生长及特点操作简便、准确、快捷。
[1]Chen W, Zheng R, Baade PD, et al. Cancer statistics in China,2015. CA Cancer J Clin, 2016, 66(2): 115-132.
[2]Lin L, Wang J, Jiang Y, et al. Interstitial 125I seed implantation for cervical lymph node recurrence after multimodal treatmentof thoracic esophageal squamous cell carcinoma. Technol Cancer Res Treat, 2015, 14(2): 201-207.
[3]嵇健. 磁性多壁碳纳米管载负阿霉素对乳腺癌淋巴结转移的治疗作用的实验研究. 广州:南方医科大学, 2014.
[4]魏强, 雷振, 冯国全, 等. 兔门静脉种植VX2癌栓CT灌注参数与血管内皮生长因子的相关性. 中国医学影像学杂志,2014, 22 (9): 650-654.
[5]王甲甲, 李官成. 基因工程双价抗体在肿瘤中的研究进展.国际病理科学与临床杂志, 2008, 28(6): 508-511.
[6] 宋献美, 方芳, 马吉春, 等. 利用小鼠皮下人乳腺癌移植瘤模型观察MUC1-MBP抗乳腺癌作用. 免疫学杂志, 2010,26(5): 428-432.
[7]潘秀华, 冯玉梅. 乳腺癌移植转移模型的建立与应用. 中国肿瘤临床, 2008, 35(4): 234-237, 239.
[8]高薇.乳腺癌淋巴转移动物模型的建立与评价. 银川: 宁夏医科大学, 2014.
[9]凌瑞, 陈江浩, 姚青, 等. 兔转移性乳腺癌模型:肿瘤生长及转移. 中国癌症杂志, 2005, 15(1): 9-11.
[10]Xu LQ, Huang YW, Luo RZ, et al. Establishment of the retroperitoneal lymph node metastasis model of endometrial VX2 carcinoma in rabbits and observation of its metastatic features. World J Surg Oncol, 2015, 13(1): 109.
[11]Aravalli RN, Cressman EN. Relevance of rabbit VX2 tumor model for studies on human hepatocellular carcinoma: a microRNA-based study. J Clin Med, 2015, 4(12): 1989-1997.
[12]杨文, 王建, 丁运萍, 等. 兔VX2肿瘤淋巴转移动物模型建立和病理学观察. 四川动物, 2010, 29(4): 633-635.
[13]徐磊. 乳腺癌腋窝淋巴结转移规律的临床研究. 济南: 山东大学, 2008.
(本文编辑 张春辉)
Improved Model of Establishing the Lymph Node Metastasis of Breast Cancer and Its Ultrasonic Manifestations
刘 峰
2016-01-14
10.3969/j.issn.1005-5185.2016.06.003
