低蛋白质饲料中添加色氨酸对凡纳滨对虾饲料表观消化率、消化酶活和全虾氨基酸组成的影响
2016-08-10孙育平裘金木王国霞胡俊茹陈冰刘少昱曹俊明黄燕华
孙育平裘金木王国霞胡俊茹陈 冰刘少昱曹俊明黄燕华
(1. 广东省农业科学院动物科学研究所, 广州 510640; 2. 广东省动物育种与营养公共实验室, 广州 510640; 3. 广东省畜禽育种与营养研究重点实验室, 广州 510640; 4. 广州飞禧特水产科技有限公司, 广州 510640)
低蛋白质饲料中添加色氨酸对凡纳滨对虾饲料表观消化率、消化酶活和全虾氨基酸组成的影响
孙育平1, 2, 3裘金木1, 2, 3王国霞1, 2, 3胡俊茹1, 2, 3陈 冰1, 2, 3刘少昱4曹俊明1, 2, 3黄燕华1, 2, 3
(1. 广东省农业科学院动物科学研究所, 广州 510640; 2. 广东省动物育种与营养公共实验室, 广州 510640; 3. 广东省畜禽育种与营养研究重点实验室, 广州 510640; 4. 广州飞禧特水产科技有限公司, 广州 510640)
研究旨在探讨低蛋白质饲料中添加色氨酸对凡纳滨对虾饲料表观消化率、消化酶活以及全虾氨基酸组成的影响。试验选取初始体重为(2.00±0.01) g对虾960尾, 随机分成6组, 每组4个重复。各组分别投喂含40.79%粗蛋白质的高蛋白基础饲料(HT0)、含37.01%粗蛋白质的低蛋白基础饲料并添加0 (LT0)、1.20 (LT1)、2.50 (LT2)、5.00 (LT3)和10.00 (LT4)g/kg色氨酸的6种饲料。饲养56d后采样、分析蛋白酶活和全虾氨基酸组成; 在此基础上投喂含0.04%三氧化二钇(Y2O3)的相应饲料进行消化率试验。结果表明:低蛋白质饲料中添加色氨酸可提高对虾蛋白质、氨基酸、干物质、能量的表观消化率, 蛋白酶活和影响全虾氨基酸组成(P<0.05)。LT3、LT4粗蛋白质表观消化率显著高于LT0(P<0.05)。LT3蛋氨酸表观消化率显著高于LT0, LT3酪氨酸表观消化率显著高于HT0(P<0.05)。LT3和LT4干物质表观消化率显著高于LT0(P<0.05)。LT1、LT2、LT3和LT4总能表观消化率均高于LT0, 但仅LT4达显著水平(P<0.05)。LT2肠蛋白酶活最高, 并显著高于HT0和LT1(P<0.05), LT2、LT3、LT4肝胰腺蛋白酶活显著高于LT0(P<0.05), 但与HT0相比无明显差异(P>0.05)。LT4全虾天门冬氨酸、甘氨酸、丙氨酸、蛋氨酸、亮氨酸含量均明显高于LT0(P<0.05)。LT1全虾赖氨酸含量显著高于LT0(P<0.05)。由此可见, 低蛋白质饲料中添加色氨酸可明显提高凡纳滨对虾饲料蛋白质、氨基酸、干物质和能量的表观消化率、蛋白酶活, 并改善全虾氨基酸的组成。
凡纳滨对虾; 低蛋白质饲料; 色氨酸; 表观消化率; 消化酶活; 全虾氨基酸组成
在集约化养殖过程中, 饲料是养殖动物获得高产的重要因素。蛋白质作为动物饲料中最重要的营养物质, 不仅能够提供动物机体合成蛋白质所需的氨基酸, 还能提供生长、发育和代谢所需的能量[1], 是决定动物生长的关键因素。以饲料中的含量计算, 维持鱼、虾(特别是肉食性种类)最适生长的饲料中蛋白质水平要显著高于陆生恒温动物[2]。蛋白质成本占鱼、虾饲料中成本中最高的部分。因此, 饲料中蛋白质含量过高, 不仅会导致饲料成本上升, 还会导致因蛋白质分解代谢而引起的过多含氮类物质的排放, 加重对生态环境的污染, 不利于养殖动物的生长和生态环境的可持续发展[3]。然而, 饲料蛋白质含量过低, 会导致动物生长缓慢, 影响经济效益和养殖者的积极性。动物对蛋白质的需要, 实际是对氨基酸的需要。大多研究表明, 在畜禽动物、鱼、虾等动物饲料中添加适当的必需氨基酸可以缓解饲料蛋白降低对生长、饲料利用等造成的不良影响[4—9]。但也有与此不一的观点,陈乃松等[1]对大口黑鲈(Largemouth bass)、Li等[10]对斑点叉尾鲖(Ictalurus punctatus)的研究结果显示在饲料中添加必需氨基酸不能有效降低饲料蛋白质的含量。因此, 有关必需氨基酸在动物低蛋白质饲料中的应用有待进一步研究。
色氨酸(Tryptophan, Trp)是动物体内的一种限制性必需氨基酸, 不仅参与蛋白质合成, 同时还是5-HT、褪黑激素等的前体物, 是一种具代谢活性的功能性氨基酸。因此, 作为一种营养物质, 色氨酸在机体组织中含量的变化所引起的效应与其他氨基酸不同。研究表明, 色氨酸对营养物质代谢和生理功能发挥具有重要调控作用[11]。近年来, 有关色氨酸调控营养物质代谢、提高饲料利用和促进鱼、虾动物生长的研究已引起国内外学者的广泛关注[12—18]。本课题组前期研究发现, 在低蛋白质饲料中添加色氨酸可明显改善凡纳滨对虾营养物质沉积, 增强对虾免疫抗氧化能力, 提高生长性能[9]。但除本课题组外, 目前国内外对色氨酸在水产动物低蛋白质饲料中的研究尚未见报道。凡纳滨对虾(Litopenaeus vannamei)被公认为是世界上三大优良对虾种之一, 具有适应盐度范围广、抗逆境能力强、肉质鲜美、营养价值较高等优点, 该虾种自1988年引入我国后, 其养殖迅速遍及全国, 已成为我国水产养殖的支柱产业。在集约化养殖条件下,凡纳滨对虾一般使用高蛋白质、高鱼粉饲料。因此, 在前期研究的基础上, 本文进一步研究低蛋白质饲料中添加色氨酸对凡纳滨对虾饲料表观消化率、消化酶活和全虾氨基酸组成的影响, 旨在为凡纳滨对虾的色氨酸营养积累更多数据, 并为色氨酸在凡纳滨对虾低蛋白质饲料中的应用提供参考。
1 材料与方法
1.1 试验材料
晶体色氨酸(L-Tryptophan, L-Trp, 食品级, ≥98%, 日本味之素), 购自广州市毅盈贸易有限公司(广东省, 广州市)。
1.2 试验饲料
饲料组成及营养水平见表 1。对照组(HT0)投喂40.79%粗蛋白质含4.1 g/kg色氨酸(估测值)的高蛋白饲料, 试验组投喂37.01%粗蛋白质含3.9 g/kg色氨酸(估测值)并分别添加0 (LT0)、1.20 (LT1)、2.50 (LT2)、5.00 (LT3)和10.00 (LT4) g/kg色氨酸的低蛋白饲料。原料经粉碎过80目筛, 混合均匀后用SLX-80型双螺杆挤压机制成1.00 mm的颗粒饲料,55℃烘干, 自然冷却后放入塑料自封袋中, 置于-20℃冰箱中保存备用。饲料中色氨酸水平实测值分别为3.90、3.10、5.50、6.40、8.20和11.40 g/kg, 饲料其他氨基酸组成如表 2所示。消化率试验中, 在各处理组饲料中分别添加0.04%三氧化二钇(Y2O3)作为外源性指示剂。

表 1 饲料组成及营养水平(%, 风干基础)Tab. 1 Composition and nutrient levels of the basal diet (%, on air-dry basis)
1.3 饲养与管理
养殖试验在广东省农业科学院动物科学研究所水产研究室室内循环水养殖系统(水体容积300 L)中进行。试验共有6组, 每组4个重复, 每个重复挑选健康活泼的凡纳滨对虾40尾, 并称重, 初始体均重为(2.00±0.01) g。每个处理组各自投喂6组不同的饲料。分别在08:00、14:30和20:00进行饱食投喂, 饲养周期为8周。每天观察凡纳滨对虾的健康状况和吃食情况。试验期间为自然光照, 保持盐度5‰—7‰, 水温为28—30.5℃, 溶氧量≥5 mg/L,pH 7.8—8.2, 氨氮≤0.1 mg/L、亚硝态氮≤0.01 mg/L。待养殖试验采样结束后, 每缸留存20尾虾,改投含Y2O3的消化率饲料, 1周后开始收集粪便。每次投喂1.5h后, 用虹吸法收集新鲜、成形、饱满的粪便, 65℃烘干, 在-20℃冰箱中保存备用。各缸收集约10.0 g (干重)的粪便以供分析。

表 2 试验饲料氨基酸组成分析(%, 风干基础)Tab. 2 Composition of amino acids of the experimental diet (%,on air-dry basis)
1.4 样品采集与分析
饲养试验结束前停食24h, 捞随机挑选5尾虾,分别剥离肝胰腺和肠道, 剪碎、混匀, 按质量体积比1∶9 (v/v)的预冷对虾生理盐水, 玻璃匀浆器中匀浆, 粗酶液在4℃下3500 r/min 离心15min, 取上清液, 分装后于-80℃冰箱中保存备用, 用于组织蛋白酶、淀粉酶和脂肪酶活力的测定。
蛋白酶测定采用福林酚试剂法测定[19], 淀粉酶和脂肪酶均采用试剂盒(南京建成生物工程研究所提供)测定。全虾、饲料、粪便氨基酸均采用高效液相色谱法(HPLC)测定。
粗蛋白质含量采用凯氏定氮法(GB/T 6432-1994)、粗脂肪含量采用索氏抽提法(GB/T 6433-1994)、灰分含量采用550℃灼烧法(GB/T 6438-1992)、水分采用105℃烘箱干燥法(GB/T 6435-1986)进行测定。能量含量采用氧弹量热仪(IKAC2000)测定。饲料及粪便中Y2O3含量在广州测试分析中心用等离子体光谱仪(SPECTRO CIOSCCD)测定。
1.5 计算公式
饲料干物质表观消化率(%)=100×(1-饲料中Y2O3含量/粪便中Y2O3含量);
饲料营养成分表观消化率(%)=100×[1-(饲料中Y2O3含量/粪便中Y2O3含量)×(粪便中营养成分含量/饲料中营养成分含量)]。
1.6 统计分析
试验结果用平均数±标准差(Mean±SD)表示,采用SPSS 17.0软件进行单因子方差分析(one-way ANOVA), 利用Duncan's多重比较进行组间显著差异分析, 差异显著性水平为P<0.05。
2 结果
2.1 色氨酸对凡纳滨对虾饲料干物质、粗蛋白质、粗脂肪和总能表观消化率的影响
由表 3可知, 试验组中干物质表观消化率随着色氨酸水平的提高呈上升趋势, LT3、LT4显著高于LT0(P<0.05), 但与HT0相比无显著性差异(P>0.05),LT0、LT1显著低于HT0(P<0.05)。粗蛋白质表观消化率LT1、LT2、LT3、LT4均高于LT0, LT3、LT4差异显著(P<0.05), 但与HT0相比均无显著性差异(P>0.05)。总能表观消化率LT1、LT2、LT3、LT4均高于LT0, 但仅LT4达到显著性差异(P<0.05)。各试验组粗脂肪表观消化率均低于HT0, 且LT3差异显著(P<0.05)。各试验组间粗脂肪表观消化率均无显著性差异(P>0.05)。
2.2 色氨酸对凡纳滨对虾饲料氨基酸表观消化率的影响
由表 4可知, 试验组中各氨基酸表观消化率随着色氨酸含量的升高均呈上升趋势。蛋氨酸表观消化率LT3显著高于LT0(P<0.05)。酪氨酸表观消化率LT3显著高于HT0(P<0.05)。
2.3 色氨酸对凡纳滨对虾消化酶活的影响
由表 5可知, 低蛋白质饲料中添加色氨酸对肝胰腺和肠蛋白酶活影响显著(P<0.05)。肠蛋白酶活LT2最高, 显著高于HT0和LT1(P<0.05), 但LT1、LT3、LT4与HT0、LT0相比均无显著性差异(P> 0.05)。肝胰腺蛋白酶活LT2、LT3、LT4显著高于LT0(P<0.05), 但与HT0相比无显著性差异(P> 0.05)。肠淀粉酶活LT3显著高于LT0(P<0.05), 但与HT0相比无显著性差异(P>0.05), 其他各试验组与LT0相比均无显著性差异(P>0.05)。各试验组肝胰腺淀粉酶活LT4最高, 与HT0相比无明显差异(P>0.05), 但LT2、LT2显著低于HT0(P<0.05)。各试验组肠道脂肪酶活差异不显著(P>0.05), 但均显著低于HT0(P<0.05)。LT1、LT2、LT3、LT4肝胰腺脂肪酶活与LT0相比均无显著性差异(P>0.05), LT3、LT4显著低于HT0(P<0.05)。

表 3 低蛋白质饲料中添加色氨酸对凡纳滨对虾饲料干物质、粗蛋白、粗脂肪和总能表观消化率的影响 (%, 干物质基础)Tab. 3 Effects of low protein diets supplemented with tryptophan on the ADCs of dry matter, crude protein, crude lipid, ash and gross energy for L. vannamei (%, on dry matter basis)
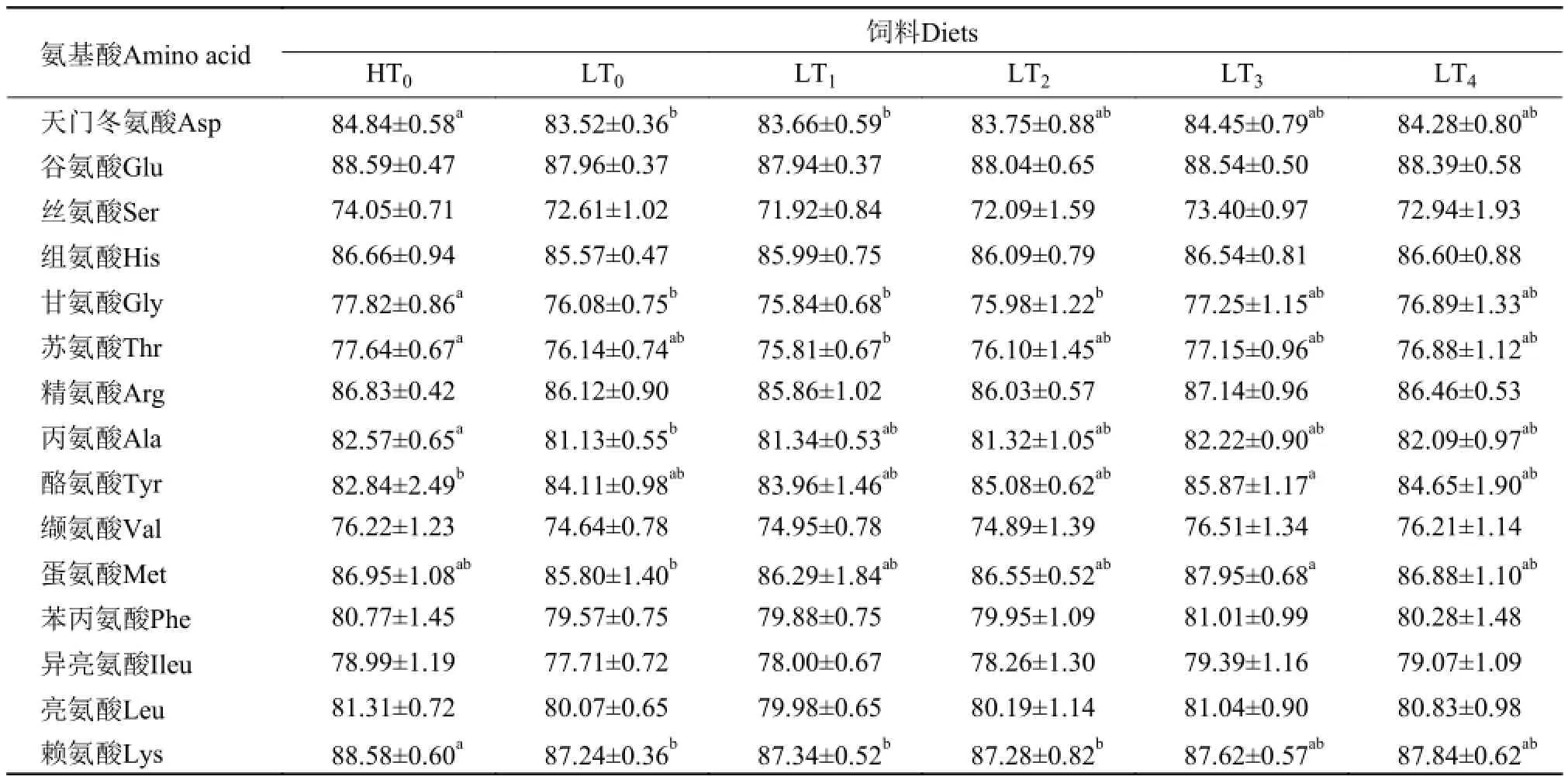
表 4 低蛋白质饲料中添加色氨酸对凡纳滨对虾饲料氨基酸的表观消化率(%, 干物质基础)Tab. 4 Effects of low protein diets supplemented with tryptophan on the ADCs of amino acid for L. vannamei (%, on dry matter basis)

表 5 低蛋白质饲料中添加色氨酸对凡纳滨对虾消化酶活的影响Tab. 5 Effects of low protein diets supplemented with tryptophan on the digestive enzyme activity of L. vannamei
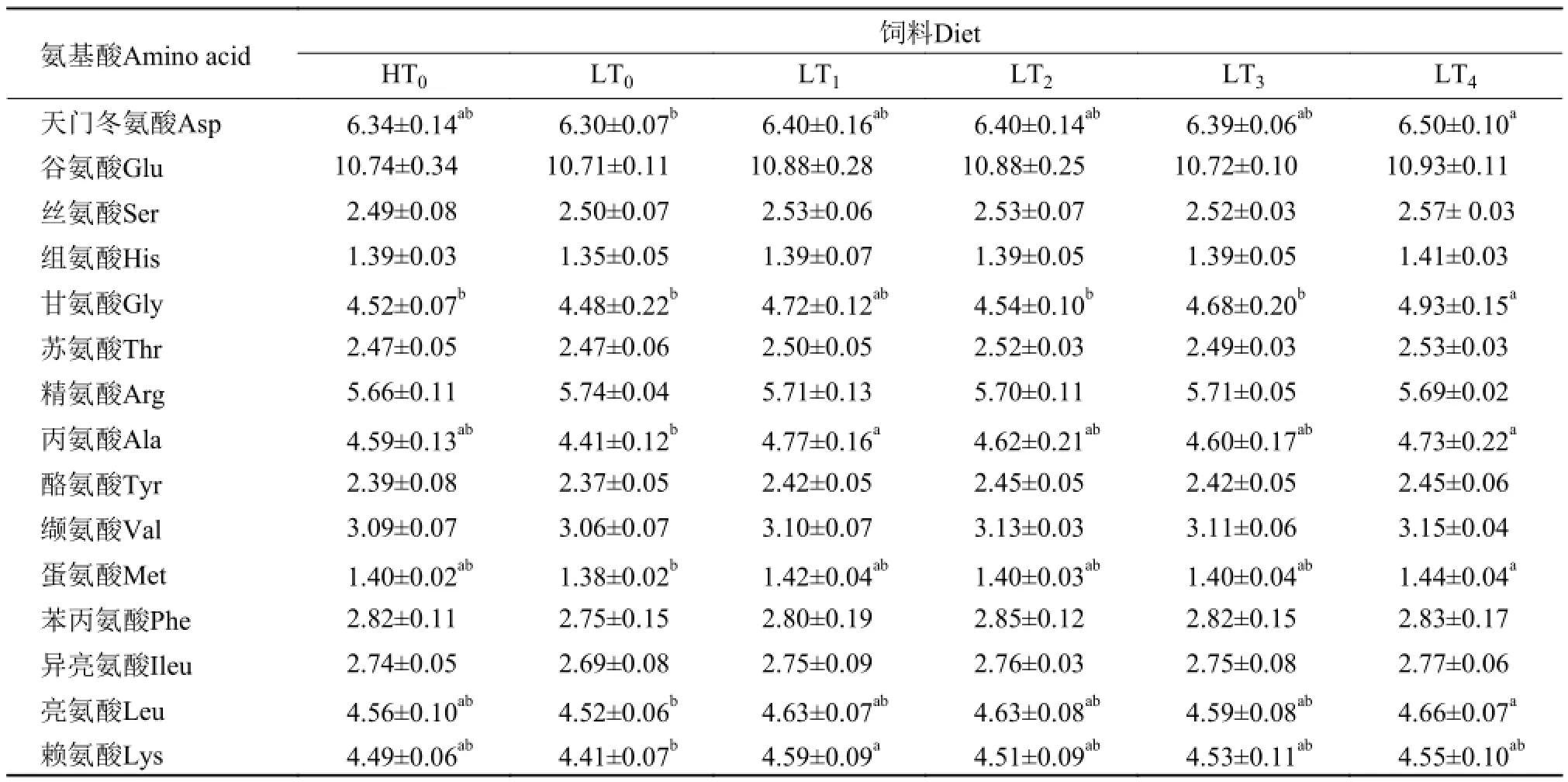
表 6 低蛋白质饲料中添加色氨酸对凡纳滨对虾全虾氨基酸组成的影响(%,干物质基础)Tab. 6 Effects of low protein diets supplemented with tryptophan on amino acids composition of the whole body of L. vannamei (%, on dry matter basis)
2.4 色氨酸对凡纳滨对虾全虾氨基酸组成的影响
由表 6可知, 除精氨酸、赖氨酸外, 全虾氨基酸LT4均高于其他各组, 其中全虾天门冬氨酸、甘氨酸、丙氨酸、蛋氨酸、亮氨酸均显著高于LT0(P<0.05)。LT1全虾赖氨酸显著高于LT0(P<0.05)。
3 讨论
3.1 低蛋白质饲料中添加色氨酸对凡纳滨对虾蛋白质表观消化率的影响
蛋白质是水产动物饲料中最核心的营养素。然而, 水产动物对饲料中蛋白质的利用率较低, 其中, 饲料中仅18%氮用于生长, 75%—80%的氮以粪便和代谢物形式排入水环境[20]。色氨酸不仅参与蛋白质的合成过程, 并且还能够与其他氨基酸相互作用, 具有调节动物机体蛋白质合成的功能。畜禽动物研究表明, 在饲料中添加氨基酸后显著提高蛋白质表观消化率。Pastuszewska等[21]在仔猪日粮中可消化色氨酸从0.77提高到1.39和1.85 g/kg以后显著促进氮消化吸收。夏彦斌[22]在仔猪饲料中添加不同水平色氨酸, 蛋白质表观消化率随着色氨酸含量增加均有一定上升趋势。刘锁珠[5]在肉仔鸡中研究发现, 色氨酸可使粗蛋白质表观消化率提高。殷清清[23]在3—5龄獭兔(Growing rex rabbit)中发现,色氨酸极显著影响氮表观消化率。与畜禽动物研究相似, 本试验结果表明低蛋白质饲料中添加色氨酸可显著提高凡纳滨对虾饲料粗蛋白质表观消化率, 与以往研究结果一致。研究认为, 氨基酸在调节动物代谢和生理过程中具有多种独特的功能, 从而影响试验动物的健康和饲料转化率。因此, 在低蛋白质饲料中添加色氨酸, 不仅具有改善饲料的营养平衡性, 并且具有刺激虾的嗅觉和味觉功能, 起到很好诱食的作用, 从而增加摄食量[9], 提高了凡纳滨对虾低蛋白质的饲料蛋白质的利用效率[1, 6—18]。
3.2 低蛋白质饲料中添加色氨酸对凡纳滨对虾氨基酸表观消化率的影响
动物对蛋白质的需求实质上也就是对氨基酸的需求。因此, 饲料氨基酸的表观消化率在一定程度上反应了饲料粗蛋白质的表观消化率。有学者认为, 动物长期摄食低蛋白质饲料对机体生长、免疫可产生抑制作用主要与低蛋白质饲料中氨基酸的不平衡有关[6]。在饲料中添加色氨酸能够促进其他氨基酸消化吸收, 从而使机体对氨基酸尤其是必需氨基酸的需求得到满足[23]。本试验结果显示在低蛋白质饲料中添加色氨酸后可显著提高部分氨基酸的表观消化率。动物摄取蛋白质即是为了获得氨基酸, 尤其是平衡的必需氨基酸[24]。由此, 本试验结果间接说明, 在低蛋白质饲料中单纯添加色氨酸可能改善了凡纳滨对虾饲料氨基酸的不平衡,缓解了可能因氨基酸不平衡而造成的拮抗作用等对氨基酸的吸收利用的影响。然而, 本试验中饲料氨基酸表观消化率和粗蛋白质表观消化率趋势并不完全相同, 这与Mu等[25]和Luo等[26]研究结果相似,其机理有待进一步研究。
3.3 低蛋白质饲料中添加色氨酸对凡纳滨对虾消化酶活的影响
水产动物对饲料的消化吸收主要依靠化学消化, 即以消化器官中的酶为主, 机体的消化能力与消化酶联系紧密, 机体生长性能和免疫均与消化酶活力相关, 而消化酶与饲料中营养水平表现出一定适应性, 在一定范围内饲料中蛋白水平会与机体蛋白酶活成正相关[27]。因此低蛋白质饲料可能会对机体蛋白酶活产生一定影响。大量研究表明, 在饲料中添加氨基酸可提高机体蛋白酶活。唐凌等[15]在建鲤饲料中添加不同水平的色氨酸以后, 色氨酸水平为0.38%时显著提高机体肠道蛋白酶和肝脏蛋白酶活性。陈义方[28]在不同规格的凡纳滨对虾饲料中分别添加不同水平的蛋氨酸, 结果发现蛋氨酸水平显著影响不同规格凡纳滨对虾肝胰腺的蛋白酶活, 并对0.6—10 g凡纳滨对虾淀粉酶活产生显著影响。本试验结果发现在低蛋白质饲料中添加色氨酸可显著提高对虾肠道蛋白酶、肝胰腺蛋白酶活性, 且消化酶活与粗蛋白和氨基酸消化率存在一定正向关系, 与以往研究结果类似, 表明色氨酸能在一定程度上通过影响蛋白酶活, 从而影响对饲料中蛋白质和氨基酸的消化利用。
3.4 低蛋白质饲料中添加色氨酸对凡纳滨对虾全虾氨基酸组成的影响
饲料蛋白质是决定水产动物生长最关键的营养物质, 而饲料蛋白质消化后的氨基酸除用于生长外, 其余部分可表现为三种形式: 一是机体消化后,并未被吸收; 二是作为能量被分解; 三是消化吸收后用于机体组织的修复和更新, 这部分氨基酸主要用于更换旧的组织, 并未用于机体氨基酸沉积。而机体氨基酸沉积率实际为应用于机体沉积用的氨基酸, 机体氨基酸可在一定程度上反应机体对氨基酸吸收利用情况。氨基酸具有改善水产动物体机体氨基酸组成的研究已有报道。赵红霞等[29]在军曹鱼(Rachycentron canadum L.)中添加不同水平精氨酸, 精氨酸水平2.30%相对于精氨酸水平2.53%,鱼体精氨酸、蛋氨酸、苯丙氨酸、缬氨酸和色氨酸显著提高。Shah Alam等[30]在牙鲆(Paralichthys olivaceus)中研究发现饲料中不同氨基酸模式对鱼体蛋白结合态氨基酸组成有一定影响。本试验结果也发现色氨酸可以显著提高全虾氨基酸沉积, 与蛋白酶活、氨基酸、蛋白质表观消化率呈一定相关性, 表明色氨酸在调控氨基酸消化吸收以后, 影响了机体氨基酸代谢, 进而促进了机体蛋白质的合成和生长, 在一定程度上满足机体摄食低蛋白质饲料情况下对蛋白质和氨基酸需求。
4 结论
低蛋白质饲料中添加色氨酸可明显提高凡纳滨对虾的饲料蛋白质、氨基酸、干物质和能量的表观消化率, 增强消化酶活, 改善全虾氨基酸组成。
[1]Chen N S, Liang Q L, Xiao W W, et al. Effects of supplementing EAA to lower protein diets on growth body composition and immunological index of Largemouth bass (Micropterus salmoides) [J]. Acta Hydrobiologica Sinica,2014, 38(2): 262—271 [陈乃松, 梁勤朗, 肖温温, 等. 在低蛋白质饲料中补充必需氨基酸对大口黑鲈生长、体组成和免疫指标的影响. 水生生物学报, 2014, 38(2):262—271]
[2]NRC. Nutrient Requirements of Fish and Shrimp [M]. Washington, D C: National Academies Press. 2011, 61
[3]Yang S D, Liou C H, Liu F G. Effects of dietary protein level on growth performance, carcass composition and ammonia excretion in juvenile silver perch (Bidyanus bidyanus) [J]. Aquaculture, 2002, 213(1—4): 363—372
[4]Su Y J, Li D F, Xing J J, et al. Effects of low protein dietary with tryptophan supplementation on growth performance, serum free amino acids and urea nitrogen contents of weaned piglets [J]. Chinese Journal of Animal Science, 2005, 41(1): 26—28 [苏有健, 李德发, 邢建军,等. 在低蛋白日粮中添加色氨酸对仔猪生产性能及血清游离氨基酸和尿素氮的影响. 中国畜牧杂志, 2005,41(1): 26—28]
[5]Liu S Z. Effects of different dietary protein and digestible tryptophan levels on performance and nutrient metabolism of broilers [D]. Thesis for Master of Science. Northewest A & F University, Yangling. 2007 [刘锁珠.低蛋白饲粮中添加色氨酸对肉仔鸡生产及营养代谢的影响. 硕士学位论文, 西北农林科技大学, 杨凌. 2007]
[6]Cheng W X, Zhang L, Xu G H, et al. Effects of arginine on the regulation of the growth, the blood amino acid composition and the fat deposition in nile tilapia (Oreochromis niloticus) [J]. Acta Hydrobiologica Sinica, 2015,39(3): 490—497 [程炜轩, 张丽, 许国焕, 等. N-氨甲酰谷氨酸对罗非鱼幼鱼生长、血液氨基酸组成及脂肪沉积的影响. 水生生物学报, 2015, 39(3): 490—497]
[7]Yamamoto T, Sugita T, Furuita H. Essential amino acid supplementation to fish meal-based diets with low protein to energy ratios improves the protein utilization in juvenile rainbow trout Oncorhynchus mykiss [J]. Aquaculture, 2005, 246(1—4): 379—391
[8]Huai M Y, Liu Y J, Tian L X, et al. Effect of dietary protein reduction with synthetic amino acids supplementation on growth performance,digestibility, and body composition of juvenile Pacific white shrimp, Litopenaeus vannamei [J]. Aquaculture International, 2010,18(3): 255—269
[9]Qiu J M, Sun Y P, Cao J M, et al. Effects of tryptophan supplemented in the low protein diet on growth performance,immunity and antioxidant functions in serum of Litopenaeus vannamei [J]. Chinese Journal of Animal Nutrition, 2015, 27(7): 2272—2281 [裘金木, 孙育平, 曹俊明, 等. 低蛋白质饲料中添加色氨酸对凡纳滨对虾生长性能、体组成、血清免疫和抗氧化指标的影响. 动物营养学报, 2015, 27(7): 2272—2281]
[10]Li M H, Robinson E H. Effects of supplemental lysine and methionine in low protein diets on weight gain and body composition of young channel catfish Ictalurus punctatus [J]. Aquaculture, 1998, 163(3—4): 297—307
[11]Floc'H N L, Otten W, Merlot E. Tryptophan metabolism,from nutrition to potential therapeutic applications [J]. Amino Acids, 2011, 41(5): 1195—1205
[12]Abidi S F, Khan M A. Dietary tryptophan requirement of fingerling rohu, Labeo rohita (Hamilton), based on growth and body composition [J]. Journal of the World Aquaculture Society, 2010, 41(5): 700—709
[13]Farhat, Khan M A. Growth, Feed conversion, and nutrient retention efficiency of African Catfish, Clarias gariepinus, (Burchell) fingerling fed diets with varying levels of protein [J]. Journal of Applied Aquaculture,2011, 23(4): 304—316
[14]Ahmed I. Dietary amino acid L-tryptophan requirement of fingerling Indian catfish, Heteropneustes fossilis (Bloch), estimated by growth and haemato-biochemical parameters [J]. Fish Physiology & Biochemistry, 2012,38(4): 1195—1209
[15]Tang L, Sun C Y, Kuang S Y, et al. Comparison of effects of crystalline tryptophan and coated tryptophan on growth performance, protein metabolism and abilities of digestion and absorption of Juvenile Jian Carp (Cyprinus carpio var. Jian) [J]. Chinese Journal of Animal Nutrition,2014, 26(2): 411—419 [唐凌, 孙崇岩, 邝声耀, 等. 晶体色氨酸和包膜色氨酸对幼建鲤生长性能、蛋白质代谢及消化吸收能力影响的比较. 动物营养学报, 2014,26(2): 411—419]
[16]Zehra S, Khan M A. Dietary tryptophan requirement of fingerling Catla catla (Hamilton) based on growth, protein gain, RNA/DNA ratio, haematological parameters and carcass composition [J]. Aquaculture Nutrition, 2014,21(5): 690—701
[17]Pianesso D, Neto J R, Silva L P D, et al. Determination of tryptophan requirements for juvenile silver catfish (Rhamdia quelen) and its effects on growth performance, plasma and hepatic metabolites and digestive enzymes activity [J]. Animal Feed Science & Technology, 2015, 210:172—183
[18]Sun Y P, Guan L Z, Xiong J H, et al. Effects of L-tryptophan supplemented dietary on growth performance and 5-HT and GABA levels in juvenile Litopenaeus vannamei [J]. Aquaculture International, 2015, 23(1): 235—251
[19]Lowry O H, Rosebrough N J, Farr A L, et al. Protein measurement with the Folin phenol reagent [J]. Journal of Biological Chemistry, 1951, 193(1): 265—275
[20]Li Y, Wang L, Jiang K Y, et al. Aquaculture nutrition,eco-fitness and environmental protection [J]. Marine Science, 2004, 28(3): 76—78 [李勇, 王雷, 蒋克勇, 等. 水产动物营养的生态适宜与环保饲料. 海洋科学, 2004,28(3): 76—78]
[21]Pastuszewska B, Tomaszewska-Zaremba D, Buraczewska L, et al. Effects of supplementing pig diets with tryptophan and acidifier on protein digestion and deposition,and on brain serotonin concentration in young pigs [J]. Animal Feed Science & Technology, 2007, 132(1—2):49—65
[22]Xia Y B. Effects of different protein diets supplemented with different tryptophan levels on performance and serum biochemical assays for piglets [D]. Thesis for Master of Science. Yangzhou University, Yangzhou. 2012 [夏彦斌. 饲粮蛋白质水平和色氨酸添加量对断奶仔猪生长性能及血液生化指标的影响. 硕士学位论文, 扬州大学,扬州. 2012]
[23]Yin Q Q, Li F C, Wang X P, et al. Effects of dietary tryptophan level on growth performance, nitrogen metabolism, serum biochemical indices and fur quality of growing rex rabbits [J]. Chinese Journal of Animal Nutrition, 2013, 25(5): 1010—1016 [殷清清, 李福昌, 王雪鹏,等. 饲粮色氨酸水平对生长獭兔生长性能、氮代谢、血清生化指标及毛皮质量的影响. 动物营养学报, 2013,25(5): 1010—1016]
[24]Wilson R P. Animal Acids and Proteins [M]. New York:Academic Press. 2002, 143—148
[25]Mu Y Y, Lam T J, Guo J Y, et al. Protein digestibility and amino acid availability of several protein sources for juvenile Chinese hairy crab Eriocheir sinesis H Milne Edwards (Decapoda, Grapsidae) [J]. Aquaculture Research,2000, 31(10): 757—765
[26]Luo Z, Tan X Y, Chen Y D, et al. Apparent digestibility coefficients of selected feed ingredients for Chinese mitten crab Eriocheir sinensis [J]. Aquaculture, 2008,285(1—4): 141—145
[27]Shi Y, Leng X J, Li X Q, et al. Effect of dietary protein levels on growth performance, whole body composition and intestinal digestive enzyme activities of Cichlasoma sp. Juvenile [J]. Acta Hydrobiologica Sinica, 2009, 33(5):874—880 [石英, 冷向军, 李小勤, 等. 饲料蛋白水平对血鹦鹉幼鱼生长、体组成和肠道蛋白消化酶活性的影响. 水生生物学报, 2009, 33(5): 874—880]
[28]Chen Y F. Dietary protein and methionine requirements of three sizes of Litopenaeus vannamei [D]. Thesis for Master of Science. Shanghai Ocean University, Shanghai. 2012 [陈义方. 不同规格凡纳滨对虾对蛋白质和蛋氨酸需要量研究. 硕士学位论文, 上海海洋大学, 上海. 2012]
[29]Zhao H X, Cao J M, Wu J K , et al. Studies of arginine re-quirement for juvenile Cobia [J]. Journal of South China Agricultural University, 2008, 28(4): 87—90 [赵红霞, 曹俊明, 吴建开, 等. 军曹鱼幼鱼对饲料中精氨酸的需要量. 华南农业大学学报, 2008, 28(4): 87 —90]
[30]Shah Alam, Teshima S I, Yaniharto D, et al. Influence of different dietary amino acid patterns on growth and body composition of juvenile Japanese flounder, Paralichthys olivaceus [J]. Aquaculture, 2002, 210(s1—4): 359—369
EFFECTS OF TRYPTOPHAN SUPPLEMENTED IN LOW PROTEIN DIETS ON APPARENT DIGESTIBILITY COEFFICIENTS, DIGESTIVE ENZYME ACTIVITY AND AMINO ACIDS COMPOSITION OF LITOPENAEUS VANNAMEI
SUN Yu-Ping1, 2, 3, QIU Jin-Mu1, 2, 3, WANG Guo-Xia1, 2, 3, HU Jun-Ru1, 2, 3, CHEN Bing1, 2, 3, LIU Shao-Yu4,CAO Jun-Ming1, 2, 3and HUANG Yan-Hua1, 2, 3
(1. Institute of Animal Science, Guangdong Academy of Agricultural Sciences, Guangzhou 510640, China; 2. Guangdong Public Laboratory of Animal Breeding and Nutrition, Guangzhou 510640, China; 3. Guangdong Key Laboratory of Animal Breeding and Nutrition, Guangzhou 510640, China; 4. Guangzhou Fishtech Aquatic Sciences Co. Ltd, Guangzhou, 510640, China)
To examine effects of L-tryptophan supplemented in low protein diets on apparent digestibility coefficients,digestive enzyme activity and amino acids composition of the whole body in Litopenaeus.vannamei, six diets including high protein diet with 40.79% crude protein (HT0), and low protein diets with 37.01% crude protein supplemented with 0 (LT0), 1.20 (LT1), 2.50 (LT2), 5.0 (LT3) and 10.0 (LT4) g/kg L-tryptophan were formulated to feed 960 shrimp with the average body weight of (2.00±0.01) g that were randomly allocated into 6 groups with 4 replicates for a 56-day experiment. The results showed that tryptophan supplemented in low protein diets significantly increased the apparent digestibility coefficients (ADCs) of crude protein (CP) and amino acids, dry matter (DM), gross energy (GE), protease activity, and the body amino acids composition (P<0.05). The ADCs of CP in LT3and LT4were significantly higher than that of LT0(P<0.05). The ADCs of methionine in LT3was significantly higher than that of LT0(P<0.05). The ADCs of tyrosine in LT3was significantly higher than that of HT0(P<0.05). The ADCs of DM in LT3and LT4were significantly higher than that of LT0 (P<0.05). The ADCs of GE in LT1, LT2, LT3and LT4were higher than that of LT0, and the ADCs of GE in LT4significantly higher than that of LT0(P<0.05). The addition of L-tryptophan significantly increased the intestine protease activity, and LT2was the highest group. The hepatopancreas protease activity in LT2, LT3and LT4were significantly higher than that of LT0(P<0.05), but there was no significant difference compared to HT0(P>0.05). Aspartic acid, glycin, alanine, methionine and leucine content of the shrimp in LT4was significantly higher than that of LT0(P<0.05), and lysine content of the shrimp in LT2were significantly higher than that of LT1(P<0.05). In conclusion, L-tryptophan supplemented in low protein diets could enhance the ADCs of CP, amino acids, DM, GE, the protease activity, as well as improve the shrimp body amino acids composition.
Litopenaeus vannamei; Low protein diets; Tryptophan; Apparent digestibility coefficients; Digestive enzyme activity; Amino acids composition
S963
A
1000-3207(2016)04-0720-08
10.7541/2016.95
2015-12-31;
2016-03-24
广东省海洋渔业科技推广专项项目(A201301B11); 广州市科技计划项目(2014J4100239); 广东省农业科学院院长基金项目(201431)资助 [Supported by the Technology Extension Foundation of Marine Fishery in Guangdong Province (A201301B11);Guangzhou Science and Technology Plan Project (2014J4100239); Presidential Foundation of the Guangdong Academy of Agricultural Sciences (201431)]
孙育平(1976—), 女, 湖南益阳人; 博士; 主要从事水产动物营养与饲料学研究。E-mail: sunnyxrdragon@sohu.com
黄燕华(1969—), 女, 湖北赤壁人; 研究员; 主要从事水产动物营养与饲料学研究及饲料生物技术的应用与开发。E-mail:huangyh111@126.com
