螺旋藻粉替代饲料中鱼粉对异育银鲫幼鱼生长、饲料利用和蛋白沉积的影响
2016-08-10曹申平韩冬解绶启金俊琰刘昊昆杨云霞朱晓鸣
曹申平韩 冬解绶启金俊琰刘昊昆杨云霞朱晓鸣
(1. 中国科学院水生生物研究所, 淡水生态与生物技术国家重点实验室, 武汉 430072; 2. 中国科学院大学, 北京 100049; 3. 淡水水产健康养殖湖北省协同创新中心, 武汉 430070; 4. 湖州师范学院, 浙江省水生生物资源养护与开发技术研究重点实验室, 中国水产科学研究院水生动物繁育与营养重点实验室, 湖州 313000)
螺旋藻粉替代饲料中鱼粉对异育银鲫幼鱼生长、饲料利用和蛋白沉积的影响
曹申平1, 2韩 冬1, 3, 4解绶启1金俊琰1刘昊昆1杨云霞1朱晓鸣1
(1. 中国科学院水生生物研究所, 淡水生态与生物技术国家重点实验室, 武汉 430072; 2. 中国科学院大学, 北京 100049; 3. 淡水水产健康养殖湖北省协同创新中心, 武汉 430070; 4. 湖州师范学院, 浙江省水生生物资源养护与开发技术研究重点实验室, 中国水产科学研究院水生动物繁育与营养重点实验室, 湖州 313000)
实验以异育银鲫“中科3号”幼鱼(3.2±0.5) g为实验对象, 研究螺旋藻粉蛋白替代饲料鱼粉蛋白(0、20%、40%、60%、80%和100%)对鱼摄食、生长、饲料利用和蛋白沉积的影响。实验设计了6种等氮(38%)等脂(10%)等能(16.50 kJ)的饲料, 每处理3个重复。采用室内循环水养殖系统, 表观饱食投喂。实验水温为(28±3)℃, 实验共持续60d。结果发现:随藻粉替代比例的增加, 鱼摄食率显著上升; 饲料效率则呈显著下降趋势; 特定生长率在20%替代组与鱼粉组无显著差异(P>0.05), 其他各替代组均显著低于鱼粉组(P<0.05); 蛋白沉积率在20%、60%替代时与鱼粉组无显著差异(P>0.05), 其他替代组显著低于鱼粉组(P<0.05); 肥满度在各替代组均显著低于鱼粉组(P<0.05); 鱼体蛋白随藻粉替代比例的增加呈现先持平后降低的趋势, 鱼体脂肪则呈先降低后升高的变化; 20%、40%和60%替代组全鱼灰分均高于全鱼粉组; 肠道消化酶(胰蛋白酶、脂肪酶和α-淀粉酶)在替代组和对照组间均无显著差异(P>0.05); 干物质表观消化率随藻粉蛋白替代比例的增加而呈显著上升, 蛋白的表观消化率则呈显著下降趋势, 总磷表观消化率在20%替代时最低, 在100%替代时最高。综合特定生长率和蛋白沉积率情况, 当鲫幼鱼饲料中鱼粉含量约为50%, 且鱼粉为唯一蛋白源时, 螺旋藻粉蛋白可替代饲料中20%鱼粉蛋白。
异育银鲫; 螺旋藻; 鱼粉; 蛋白替代; 水产饲料
鲫是我国广泛养殖的重要经济鱼类, 营养丰富,味道鲜美, 深受市场欢迎。鲫的养殖产量整体呈现稳步增长的趋势, 2014年产量达到2.77×109kg[1]。鱼粉作为鲫配合饲料中的重要蛋白源, 由于资源短缺和需求量增加, 其价格一直居高不下。因此, 寻求优质蛋白源来替代水产饲料中鱼粉一直是水产养殖行业的热点课题[2]。研究表明, 水产饲料中25%— 50%鱼粉蛋白能够被植物蛋白所替代[3]。
螺旋藻Spirulina platensis, 隶属蓝藻门颤藻目颤藻科螺旋藻属, 为低等原核生物, 单细胞或多细胞组成丝状体, 是迄今为止发现的营养最丰富均衡的物种之一, 也是当前全球开发规模最大的经济微藻[4]。其蛋白含量达60%—75%, 且氨基酸配比平衡, 其中8种人体必需氨基酸含量接近或超过联合国粮食与农业组织(Food and agriculture organization of the united nations, FAO)推荐的组成比例标准; 并具有丰富的维生素、矿物质以及螺旋藻多糖、不饱和脂肪酸等生物活性物质[5, 6]。在食品医疗方面,螺旋藻的许多功能如抗氧化、抗肿瘤等均得到证实[7, 8]。在水产养殖方面, 螺旋藻也逐渐得到广泛的应用, 不仅能促进养殖动物的生长、摄食, 同时,具有增强机体免疫力[9]、提高幼体存活率[10]和改善品质与体色[11]等效果。因此, 螺旋藻不仅可以作为蛋白源[12, 13], 也可以作为饲料添加剂[14]使用。本实验研究了以螺旋藻粉蛋白替代饲料中的鱼粉蛋白对异育银鲫(Carassis auratus gibelio var. CAS Ⅲ)幼鱼的生长、摄食、饲料利用和蛋白沉积的影响, 以确定螺旋藻粉替代鱼粉的适宜比例, 为螺旋藻粉在鲫饲料中的应用提供理论依据。
1 材料与方法
1.1 实验饲料
实验以鱼粉和螺旋藻粉作为主要蛋白源, 以α-淀粉和玉米淀粉为糖源, 以鱼油和大豆油1︰1混合作为主要脂肪源, 纤维素作为饲料填充物。鱼粉及螺旋藻的化学组成及氨基酸组成见表 1。实验设计6组等氮(38%)等脂(10%)等能(16.50 kJ)的饲料。以全鱼粉组(FM)为对照, 以螺旋藻粉蛋白替代鱼粉蛋白的20% (SP20)、40% (SP40)、60% (SP60)、80% (SP80)、100% (SP100), 共6个处理, 每处理3平行。每种饲料中添加0.1%的Y2O3用作表观消化率的指示剂。具体配方及化学组成见表 2。饲料原料过40目筛, 充分混匀后, 经饲料机(中国水产科学研究院渔业机械仪器研究所生产的SLP-45型膨化机)制成2 mm的颗粒, 70℃烘干, 置于4℃冷库密封保存。

表 1 白鱼粉与螺旋藻化学组成及氨基酸组成(%干物质)Tab. 1 The chemical composition and the amino acid profile of white fishmeal and Spirulina platensis (% dry matter)
1.2 养殖系统和养殖条件
实验在室内循环水养殖系统的圆柱形玻璃纤维缸(水体积120 L)中进行。进入每缸的流水速度为7 L/min。使用充气头在非投喂期间连续充气增氧。实验期间水温变化范围为(28±3)℃。光照周期为12L/12D, 光亮周期从8: 00至20: 00, 使用节能灯作为光源。每周监测水体溶氧和氨氮, 溶氧>7.5 mg/L,氨氮<0.1 mg/L。pH为6.0—7.0。
1.3 实验鱼及饲养
养殖实验开始之前, 对实验鱼暂养5周进行驯化。暂养饲料为本实验室配置的以鱼粉和豆粕作为主要蛋白源的颗粒饲料, 其蛋白质为36%, 脂肪为10%。暂养期间每天投喂2次, 时间为9: 00和15: 00。实验前一周, 用6种实验饲料混匀饱食投喂实验鱼, 使其适应实验饲料; 实验前一天, 实验鱼饥饿24h, 选取体格健壮、规格均匀的个体[体重(3.2±0.05) g], 称重后随机放入18个养殖缸中, 每缸20尾。实验共6个处理, 每处理3平行。生长实验持续60d (2013年8月8日—10月6日)。实验期间, 每天9:00和15:00投喂, 每次投喂1h至表观饱食。
1.4 实验取样
实验开始时, 随机取3组(每组12尾)鱼抹干称重, 冷藏于-20℃冰箱中, 用于初始体成分分析。实验结束时, 将实验鱼饥饿24h后, 称重取样: 每缸取4尾抹干称重保存于-20℃冰箱中用于体成分分析;每缸取3尾鱼, 抹干称重, 测量体长, 计算肥满度; 解剖取出内脏并称重, 计算脏体比; 每缸取6尾鱼冰上解剖取肠道, 以做肠道相关酶活性分析。
以虹吸管收集、挑选出实验鱼排出的完整有包膜的新鲜粪便条, 存于-20℃冰箱。收集足够粪便量后, 粪便样品用真空冷冻干燥机(ALPHA 2-4/LSC-16, Christ Gefriertrocknungsanlagen, Germany)冻干,冻干样放于4℃冰箱密封保存。
1.5 样品分析
实验鱼预处理: 将称重后实验鱼置于高压灭菌锅中120℃温度下蒸煮20min, 冷却后捣碎, 然后在75℃温度下烘至干燥, 称重, 计算全鱼水分含量, 再用粉碎机粉碎以做体成分分析。
实验饲料和实验鱼体成分中的干物质、粗蛋白、粗脂肪、灰分、总能及粪便中的粗蛋白的测试均参照AOAC(2003)标准方法进行测定: 干物质通过在105℃烘干至恒重, 通过失重法测定; 粗蛋白采用凯氏定氮仪(2300, Kjeltec Analyzer Unit)测定;粗脂肪采用索氏抽提仪(Soxtec System HT6,Tecator, Hoganas, Sweden)进行抽提测定; 灰分在马弗炉中550℃煅烧3h, 采用失重法测定; 能量值通过氧弹测热仪 (Philipson microbomb calorimeter,Gentry Instruments Inc, Aiken, USA) 测定。饲料和粪便中Y2O3使用电感耦合等离子体发射光谱仪(国家有色金属及电子材料分析测试中心)测定。
脂肪酶活性采用南京建成生物工程研究所的试剂盒测定, 测定原理: 脂肪酶能使甘油三脂水解,从而使甘油三脂和水制成的胶束发生分裂, 散射光或浊度因而减低, 脂肪酶活性与减低的速率有关;胰蛋白酶活性参照Erlanger[15]的方法进行测定(定义蛋白酶活性为1min使吸光值下降0.01为1U); α-淀粉酶活性测定使用碘-淀粉比色法, 选用四川迈克生物科技股份有限公司淀粉酶测定试剂盒。
1.6 数据处理
使用统计软件SPSS 18.0进行统计分析。实验结果首先进行方差齐性检验; 方差齐性后, 进行单因素方差分析(One-way ANOVA); 若各实验组间差异显著, 则进行Duncan's多重比较; P<0.05表示差异显著。

表 2 饲料配方和化学组成(%干物质)Tab. 2 Formulation and chemical composition of experiment diets (% dry matter)
2 结果
2.1 生长性能
生长结果如表 3所示: 以螺旋藻粉蛋白替代不同比例的鱼粉蛋白后, 实验鱼终末体重、摄食量、摄食率、特定生长率、饲料效率和蛋白沉积率均受到显著的影响。随着藻粉蛋白替代比例的增加,摄食率显著升高; 摄食量则呈现先上升后下降的趋势, 在SP20、SP40显著高于其他处理组(P<0.05);终末体重、特定生长率、饲料效率和蛋白沉积率均随饲料藻粉含量的增加而呈逐渐下降趋势,FM均为最高值。其中, SP20组的鱼特定生长率与FM组差异不显著; 蛋白沉积率在SP20、SP60与FM亦无显著差异(P>0.05); 此外, 鱼体肥满度在藻粉替代组显著低于鱼粉组(P<0.05); 脏体比在各处理组之间无显著差异(P>0.05)。
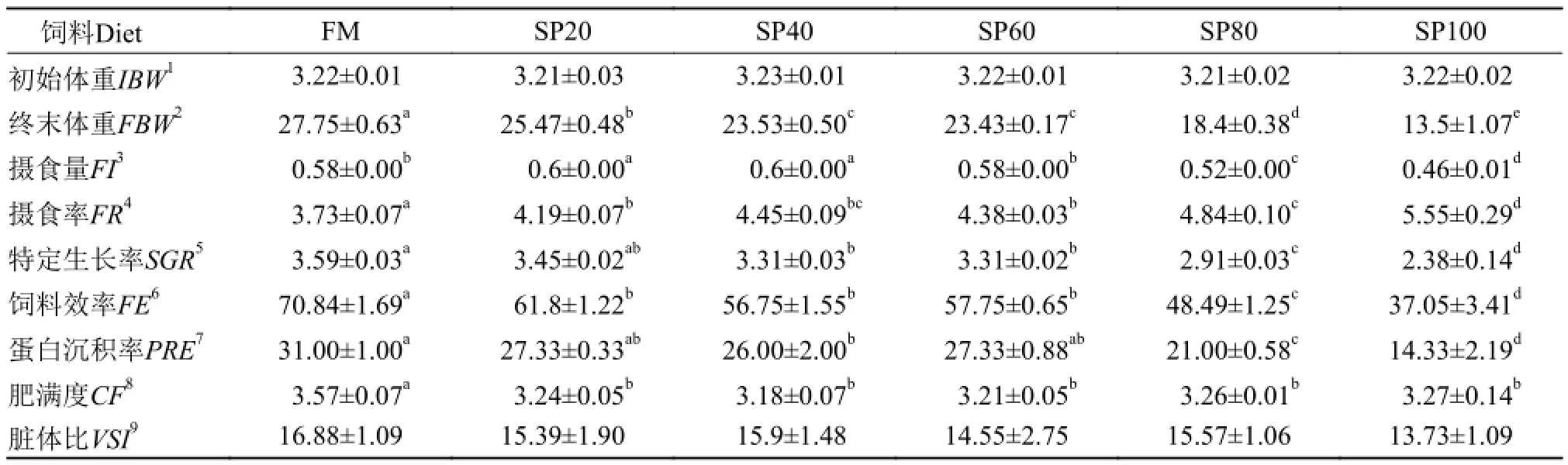
表 3 螺旋藻粉替代饲料中鱼粉蛋白对异育银鲫幼鱼生长、饲料利用和形体指标的影响Tab. 3 Effects of Spirulina platensis replacing dietary fish meal on growth, feed utilization and morphology indexes of juvenile gibel carp
2.2 鱼体生化成分
表 4中实验结果显示, 全鱼水分、粗脂肪在各处理组间无显著差异(P>0.05); SP100粗蛋白显著低于其他处理组(P<0.05), 其他处理组间无显著差异(P>0.05); 全鱼灰分在FM、SP80与SP100无显著差异(P>0.05), 而在SP20、SP40与SP60均显著高于FM(P<0.05)。

表 4 螺旋藻粉替代饲料中鱼粉蛋白对异育银鲫幼鱼生化成分的影响Tab. 4 Effects of Spirulina platensis replacing dietary fish meal on body composition of juvenile gibel carp
2.3 肠道消化酶活性
表 5的实验结果表明, 实验鱼肠道中3种消化酶(胰蛋白酶、脂肪酶和α-淀粉酶)活性在FM组和各藻粉替代组之间差异不显著(P>0.05)。
2.4 表观消化率
随着藻粉蛋白替代鱼粉蛋白比例的增加, 实验鱼的干物质、粗蛋白和总磷的表观消化率均受显著影响(表 6)。干物质表观消化率随藻粉蛋白替代鱼粉蛋白比例的增加呈显著上升趋势, 其中FM最低, SP80、SP100最高, SP20、SP40与FM无显著差异(P>0.05); 粗蛋白表观消化率呈下降趋势, 各藻粉替代组均显著低于对照FM(P<0.05), 对照组鱼粉蛋白表观消化率最高, SP60组最低; 总磷表观消化率随藻粉蛋白替代鱼粉蛋白比例的增加出现先下降后上升趋势, 其中SP20组最低, SP100组最高。
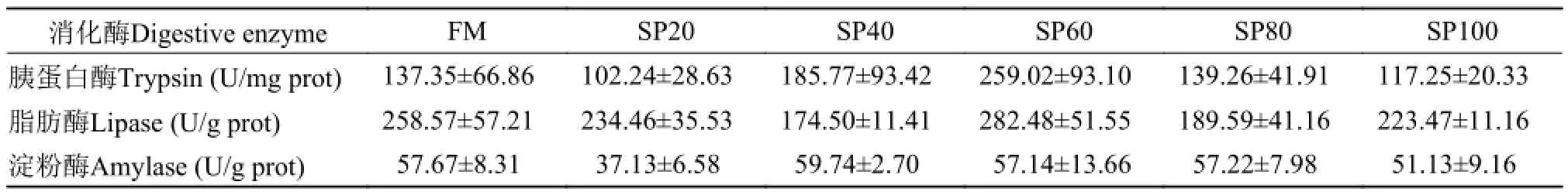
表 5 螺旋藻粉替代饲料中鱼粉蛋白对异育银鲫幼鱼肠道消化酶活性的影响Tab. 5 Effects of Spirulina platensis replacing dietary fish meal on intestinal digestive enzyme activity of juvenile gibel carp

表 6 螺旋藻粉替代饲料中鱼粉蛋白对表观消化率的影响Tab. 6 Effects of Spirulina platensis replacing dietary fish meal on apparent digestibility coefficients (ADC) of juvenile gibel carp
3 讨论
3.1 螺旋藻粉替代鱼粉对异育银鲫幼鱼摄食、生长和饲料利用的影响
在本实验中, 随藻粉替代比例的增加, 摄食率显著升高; 特定生长率在20%替代组与鱼粉组无显著差异, 其他替代组均显著低于鱼粉组; 饲料效率呈显著下降趋势; 蛋白沉积率在20%和60%替代时与鱼粉组无显著差异, 其他替代组均显著低于鱼粉对照组。这与已有的一些报道结果相似[9, 13, 16]: 螺旋藻蛋白替代40%鱼粉蛋白时对罗非鱼特定生长率和蛋白沉积率无显著影响, 超过40%替代时, 鱼体生长则受到明显抑制, 饲料效率也随替代比例的增加而出现显著下降[13]; 鹦鹉鱼(Oplegnathus fasciatus)饲料中螺旋藻粉蛋白能实现替代15%鱼粉蛋白而不影响鱼体生长和饲料利用[9]; 当藻粉蛋白替代12.5%鱼粉蛋白时, 虹鳟(Oncorhynchus mykiss)幼鱼的生长与鱼粉组相当, 替代超过25%鱼粉蛋白, 鱼体生长出现显著下降, 饲料效率随替代比例增加也出现显著下降[16]。然则也有研究发现, 印度鲤(Catla catla)在全螺旋藻粉替代组与鱼粉对照组的特定生长率、饲料转化率、蛋白质效率(protein efficiency ratio)均无显著差异[17]; 对于南亚野鲮(Labeo rohita),藻粉替代组在特定生长率上均显著高于鱼粉对照组, 但较高比例替代会使实验鱼饲料效率和蛋白沉积率出现显著降低[17]。Nandeesha等[14, 17]在实验中发现, 螺旋藻粉能完全替代鱼粉蛋白而不影响鱼体生长, 分析原因可能是其实验饲料是以鱼粉、螺旋藻粉还有米糠作为主要蛋白源, 实际鱼粉含量只有25%, 螺旋藻粉的替代量较少, 藻粉中的有益因子相对不利影响发挥更大的作用; 此外, 鱼的种类及规格大小也会造成对螺旋藻粉的利用存在差异; 同时, 实验中选用的藻粉种类与品质也会影响其适宜替代水平[18]。在本实验中, 实验鲫摄食率随藻粉替代比例的增加而显著升高, 但鱼体长势却逐渐下降。作者认为, 实验饲料均为等氮等脂等能饲料,鲫对鱼粉与螺旋藻粉在可消化蛋白含量上存在差异。随藻粉替代比例的增加, 饲料中可消化蛋白含量逐渐降低, 鱼体由于饲料中蛋白营养的缺乏, 从而出现补偿性过度摄食的情况[19, 20]。
在本实验中, 实验鱼很容易接受低藻粉替代组的实验饲料, 并且鱼体的生长性能在20%藻粉替代组与鱼粉对照组无显著差异。这与螺旋藻粉具有较均衡的氨基酸组成以及丰富的有益组分如维生素和矿物质等密切相关[21]。但螺旋藻粉蛋白替代较高比例鱼粉蛋白时, 鱼体生长则出现显著下降。研究表明, 在以植物蛋白源较高比例替代鲫饲料鱼粉时鱼体生长大多会受抑制。比如以豆粕替代鲫饲料鱼粉蛋白时就出现实验鱼生长明显下降[22]。Nengas等[23]实验发现, 以禽肉粉及其副产品替代鱼粉蛋白时, 赖氨酸与蛋氨酸的不足是制约大西洋鲷(Sparus aurata)生长的主要因素。赖氨酸与蛋氨酸是鱼体生长最重要的限制性氨基酸, 通过在饲料中添加这两种氨基酸可有效促进鱼体的生长[24]。在本实验中, 螺旋藻粉中赖氨酸含量2.67%, 鱼粉中含量为4.74%, 相比鱼粉, 螺旋藻在赖氨酸上含量明显偏低, 这可能是造成藻粉替代组鱼体生长低于鱼粉组的主要因素。
此外, 以植物蛋白源替代饲料中鱼粉蛋白时,磷缺乏是限制鱼生长的又一重要因素[25]。鱼类饲料所用的植物蛋白源中的磷有40%—90%是以植酸磷的形式存在, 该部分磷很难被鱼利用[26]。无鱼粉饲料中添加磷酸二氢钙, 不仅能促进罗非鱼生长,还提高了饲料中矿物质以及粗蛋白的消化率[27]。同样, 在全螺旋藻粉饲料中添加磷酸二氢钙也能改善罗非鱼的生长[13]。但在这两个报道中, 实验鱼在磷添加组的生长均低于全鱼粉组, 说明在用植物蛋白源替代鱼粉时还应考虑到植物蛋白对饲料品质的影响, 比如植物蛋白必需氨基酸的平衡情况、抗营养因子和适口性等。
3.2 螺旋藻粉替代鱼粉对异育银鲫幼鱼肠道消化酶的影响
消化酶活性是反映鱼体对营养物质消化吸收的重要指标。在Nandeesha等[14]实验中发现, 实验鲤在鱼粉组与螺旋藻粉组生长上无显著差异, 但肠道蛋白酶与脂肪酶活性随藻粉添加比例的升高而显著下降, 而鱼体对蛋白与脂肪的消化率却均维持在较高水平且组间无差异。在本实验中, 随藻粉添加比例的增加, 实验鱼生长呈逐渐下降趋势, 其中,肠道消化酶(胰蛋白酶、脂肪酶和α-淀粉酶)活性在各处理组间无显著差异, 饲料蛋白质的表观消化率则随藻粉添加比例的增加而显著下降, 这可能是因为异育银鲫对螺旋藻粉营养素吸收水平较差, 从而造成藻粉添加组实验鱼生长劣于鱼粉组; 也可能是螺旋藻粉中赖氨酸不足影响鱼体生长时蛋白质的合成, 而吸收进鱼体内多余的氨基酸经脱氨基作用,含氮部分以氨, 尿素和三甲胺的形式排出体外[28],从而造成藻粉组实验鱼生长较差。
3.3 螺旋藻粉替代鱼粉对异育银鲫幼鱼生化组成和蛋白沉积的影响
在鱼体生化组成上, 随藻粉替代比例的增加,鱼体蛋白质有先持平后下降的趋势; 由于在低藻粉替代时, 鱼摄食量要高于或相近于鱼粉组, 且蛋白沉积率与鱼粉组差异不显著, 从而出现鱼体蛋白在低藻粉替代组与鱼粉组相持平; 但当进一步替代时, 鱼体的摄食量减少, 蛋白沉积率也显著降低, 从而使鱼体蛋白出现显著下降。鱼体脂肪在随藻粉替代比例的增加时, 出现先降低后升高趋势。鱼体脂肪的下降, 可能与螺旋藻粉具有显著的降脂功能有密切关联[29, 30]。虽然螺旋藻脂肪含量不高, 但其含有大量的不饱和脂肪酸, 尤其是亚油酸和亚麻酸占到了45%左右, 这两者是细胞膜和线粒体膜磷脂的重要组成部分, 可以防止胆固醇和甘油三酯在肝脏与脂肪中大量堆积, 从而降低体脂的形成; 植物多酚是广泛存在于植物体内的多酚类次级代谢产物, 具有显著的抗氧化、调血脂和降血糖等功能[31]。螺旋藻粉饲料中就存在大量多酚(Polyphenol), 从而会引起藻粉组实验鱼体脂下降[9]; 此外, 植物蛋白源中多糖成分也会干扰鱼体对脂肪的吸收[32]; 在高藻粉替代组鱼体脂肪又呈上升趋势, 这应与实验鱼对脂肪的消化吸收能力有关。在本实验中, 实验鱼干物质表观消化率随藻粉添加比例的增加而升高, 而蛋白质的表观消化率却逐渐下降, 这可能是因为实验鱼对藻粉蛋白的消化能力较低, 而对藻粉脂肪等其他营养物质具有较高的消化吸收水平[33, 34], 因此,在藻粉高比例替代时, 更多脂肪在鱼体内沉积, 实验鱼体脂才会出现上升趋势。在鱼体灰分上, 低藻粉替代组(SP20、SP40和SP60)显著高于鱼粉组。这一结果与已有的一些报道不同[13, 26]。但Bureau和Cho[35]认为, 鱼和其他高等动物一样, 具有磷的恒稳机制, 可以通过调节肠道的磷吸收、尿磷排放和骨骼磷的沉积等机制, 来适应低磷和高磷的摄入, 鱼体为保持健康和良好的生长, 可能通过增加骨骼磷的大量沉积, 使骨骼达到最大矿化。这也可能是磷的表观消化率随饲料藻粉含量的增加而逐渐上升的原因。
4 结论
[1]China Fishery Statistical Yearbook [C]. China Agriculture Press. 2015, 31 [2015中国渔业统计年鉴. 中国农业出版社. 2015, 31]
[2]Tacon A G J, Metian M. Global overview on the use of fish meal and fish oil in industrially compounded aquafeeds: trends and future prospects [J]. Aquaculture,2008, 285(1): 146—158
[3]Slawski H, Adem H, Tressel R P, et al. Replacement of fishmeal by rapeseed protein concentrate in diets for common carp (Cyprinus carpio L.) [J]. The Israeli Journal of Aquaculture-Bamidgeh, 2011, 63(1): 605—611
[4]Pulz O, Gross W. Valuable products from biotechnology of microalgae [J]. Applied Microbiology and Biotechnology, 2004, 65(6): 635—648
[5]Sirakov I, Velichkova K, Nikolov G. The effect of algae meal (Spirulina) on the growth performance and carcass parameters of rainbow trout (Oncorhynchus mykiss) [J]. Journal of Bioscience and Biotechnology, 2012, SE/Online: 151—156
[6]Dernekbasi S, Unal H, Karayucel I, et al. Effect of dietary supplementation of different rates of spirulina (Spirulina platensis) on growth and feed conversion in Guppy (Poecilia reticulata Peters, 1860) [J]. Journal of
在本实验中, 鱼粉为唯一蛋白源, 以螺旋藻粉较高比例的替代饲料鱼粉蛋白会引起异育银鲫的生长、饲料利用和蛋白沉积的显著下降; 而当螺旋藻粉替代20%的鱼粉蛋白时, 鱼体的生长和蛋白沉积并未受显著的影响。因此, 当基础饲料中鱼粉含量约为50%时, 建议螺旋藻粉可替代鲫饲料中20%鱼粉蛋白。Animal and Veterinary Advances, 2010, 9(9): 1395—1399
[7]El-Sheekh M M, Hamad S M, Gomaa M. Protective effects of Spirulina on the liver function and hyperlipidemia of rats and human [J]. Brazilian Archives of Biology and Technology, 2014, 57(1): 77—86
[8]Yu H. Investigation on the antiviral and anticancer activities of polysaccharides from Spirulina platensis [D]. PhD thesis. Ocean University of China. Qingdao. 2003 [于红.钝顶螺旋藻多糖抗病毒及抗肿瘤作用的研究. 博士学位论文. 中国海洋大学, 青岛. 2003]
[9]Kim S S, Rahimnejad S, Kim K W, et al. Partial replacement of fish meal with Spirulina pacifica in diets for parrot fish (Oplegnathus fasciatus) [J]. Turkish Journal of Fisheries and Aquatic Sciences, 2013, 13(2): 197—204
[10]Güroy B, Şahin İ, Mantoğlu S, et al. Spirulina as a natural carotenoid source on growth, pigmentation and reproductive performance of yellow tail cichlid Pseudotropheus acei [J]. Aquaculture International, 2012, 20(5):869—878
[11]Teimouri M, Amirkolaie A K, Yeganeh S. The effects of Spirulina platensis meal as a feed supplement on growth performance and pigmentation of rainbow trout (Oncorhynchus mykiss) [J]. Aquaculture, 2013, 5(2): 194—202
[12]Hernández L H H, Flores G H, Araiza M A F, et al. Effects of total replacement of fishmeal with Spirulina powder and soybean meal on juvenile rainbow trout (Oncorhynchus mykiss Walbaum) [J]. Israeli Journal of Aquaculture-Bamidgeh, 2012, 64(404): 557—560
[13]Olvera-Novoa M A, Dominguez-Cen L, Olivera-Castillo L, et al. Effect of the use of the microalga Spirulina maxima as fish meal replacement in diets for tilapia, Oreochromis mossambicus (Peters), fry [J]. Aquaculture Research, 1998, 29(10): 709—715
[14]Nandeesha M, Gangadhar B, Varghese T, et al. Effect of feeding Spirulina platensis on the growth, proximate composition and organoleptic quality of common carp,Cyprinus carpio L [J]. Aquaculture Research, 1998,29(5): 305—312
[15]Erlanger B F, Kokowsky N, Cohen W. The preparation and properties of two new chromogenic substrates of trypsin [J]. Archives of Biochemistry and Biophysics,1961, 95(2): 271—278
[16]Dallaire V, Lessard P, Vandenberg G, et al. Effect of algal incorporation on growth, survival and carcass composition of rainbow trout (Oncorhynchus mykiss) fry [J]. Bioresource Technology, 2007, 98(7): 1433—1439
[17]Nandeesha M, Gangadhara B, Manissery J, et al. Growth performance of two Indian major carps, catla (Catla catla) and rohu (Labeo rohita) fed diets containing different levels of Spirulina platensis [J]. Bioresource Technology, 2001, 80(2) : 117—120
[18]Takeuchi T, Lu J, Yoshizaki G, et al. Effect on the growth and body composition of juvenile tilapia Oreochromis nlloticus fed raw Spirulina [J]. Fisheries Scinece, 2002, 68(1): 34—40
[19]Tu Y, Xie S, Han D, et al. Dietary arginine requirement for gibel carp (Carassis auratus gibelio var. CAS Ⅲ) reduces with fish size from 50g to 150g associated with modulation of genes involved in TOR signaling pathway [J]. Aquaculture, 2015, 449: 37—47
[20]Fournier V, Gouillou-Coustans M, Metailler R, et al. Excess dietary arginine affects urea excretion but does not improve N utilisation in rainbow trout Oncorhynchus mykiss and turbot Psetta maxima [J]. Aquaculture, 2003,217: 559—576
[21]Promya J, Chitmanat C. The effects of Spirulina platensis and Cladophora algae on the growth performance,meat quality and immunity stimulating capacity of the African sharptooth catfish (Clarias gariepinus) [J]. International Journal of Agricultural and Biology, 2011,13(1): 77—82
[22]Wang C, Lei W, Xie S Q. Effect of dietary replacement of fishmeal protein by soybean meal protein on growth performance, metabolism and immunity of Gibel carp (Carassius auratus gibel) [J]. Acta Hydrobiologica Sinica, 2009, 33(4): 740—748 [王崇, 雷武, 解绶启. 饲料中豆粕替代鱼粉蛋白对异育银鲫生长、代谢及免疫功能的影响. 水生生物学报, 2009, 33(4): 740—748]
[23]Nengas I, Alexis M N, Davies S J. High inclusion levels of poultry meals and related byproducts in diets for gilthead seabream Sparus aurata L [J]. Aquaculture, 1999,179(1): 13—23
[24]Lovell T. Nutrition and Feeding of Fish [M]. Van Nostrand Reinhold, New York. 1989, 267(s 1—4): 13—70
[25]Papatryphon E, Howell R A, Soares J H. Growth and mineral absorption by striped bass Morone saxatilis fed a plant feedstuff based diet supplemented with phytase [J]. Journal of the World Aquaculture Society, 1999, 30(2):161—173
[26]National Research Council (NRC). Nutrient Requirement of Fish [C]. Washington D C: National Academic Press. 1993, 50—115
[27]Zheng T, Pan Q, Li G F. Effects of phosphorus and phytase supplements on growth performance and body composition in juve nile tilapia Oreochromis niloticus×O. aureus fed fishmeal free diet [J]. Journal of Fishery Sciences of China, 2006, 13(1): 112—118 [郑涛, 潘庆, 李桂峰. 无鱼粉饲料中添加磷和植酸酶对奥尼罗非鱼生长性能及体成分的影响. 中国水产科学, 2006, 13(1):112—118]
[28]Lin D. The Research Development of Fish Nutrition [M]. Beijing: Science Press. 1993, 171—193 [林鼎. 鱼类营养研究进展. 北京: 科学出版社. 1993, 171—193]
[29]Abdel-Tawwab M, Ahmad M H. Live Spirulina (Arthrospira platensis) as a growth and immunity promoter for Nile tilapia, Oreochromis niloticus (L.), challenged with pathogenic Aeromonas hydrophila [J]. Aquaculture Research, 2009, 40(9): 1037—1046
[30]Qiao H, Wang H, Song Z, et al. Effects of dietary fish oilreplacement by microalgae raw materials on growth performance, body composition and fatty acid profile of juvenile olive flounder, Paralichthys olivaceus [J]. Aquaculture Nutrition, 2014, 20(6): 646—653
[31]Jia Q, Liu X, Wu X, et al. Hypoglycemic activity of a polyphenolic oligomer-rich extract of Cinnamomum parthenoxylon bark in normal and streptozotocin-induced diabetic rats [J]. Phytomedicine, 2009, 16(8) : 744—750
[32]Refstie S, Svihus B, Shearer K D, et al. Nutrient digestibility in Atlantic salmon and broiler chickens related to viscosity and non-starch polysaccharide content in different soyabean products [J]. Animal Feed Science and Technology, 1999, 79(4) : 331—345
[33]Palmegiano G B, Agradi E, Forneris G, et al. Spirulina as a nutrient source in diets for growing sturgeon (Acipenser baeri) [J]. Aquaculture Research, 2005, 36(2): 188—195
[34]Macias-Sancho J, Poersch L H, Bauer W, et al. Fishmeal substitution with Arthrospira (Spirulina platensis) in a practical diet for Litopenaeus vannamei: effects on growth and immunological parameters [J]. Aquaculture,2014, 426: 120—125
[35]Bureau D, Cho C. Phosphorus utilization by rainbow trout (Oncorhynchus mykiss): estimation of dissolved phosphorus waste output [J]. Aquaculture, 1999, 179(1):127—140
EFFECTS OF DIETARY FISHMEAL REPLACEMENT WITH SPIRULINA PLATENSIS POWDER ON THE GROWTH PERFORMANCE, FEED UTILIZATION AND PROTEIN DEPOSITION IN JUVENILE GIBEL CARP (CARASSIS AURATUS GIBELIO VAR. CAS )
CAO Shen-Ping1, 2, HAN Dong1, 3, 4, XIE Shou-Qi1, JIN Jun-Yan1, LIU Hao-Kun1, YANG Yun-Xia1and ZHU Xiao-Ming1
(1. State Key Laboratory of Freshwater Ecology and Biotechnology; Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China; 3. Freshwater Aquaculture Collaborative Innovation Center of Hubei Province, Wuhan 430070, China; 4. Zhejiang Provincial Key Laboratory of Aquatic Resources Conservation and Development, Key Laboratory of Aquatic Animal Genetic Breeding and Nutrition of Chinese Academy of Fishery Sciences, Huzhou University, Huzhou 313000, China)
To investigate effects of dietary replacement fishmeal protein with Spirulina platensis powder protein on feed intake, growth performance, feed utilization and protein deposition in juvenile gibel carp (Carassis auratus gibelio var. CAS Ⅲ), six isonitrogenous, isolipidic and isoenergitic diets were formulated to contain graded levels of fishmeal protein replacement by Spirulina platensis. (0, 20%, 40%, 60%, 80% and 100% respectively) for a 60-day trial. Triplicates of 20 fish [initial body weight of (3.2±0.5) g] were fed to apparent satiation with six experiment diets. The water temperature was (28±3)℃ during the experiment. With the increased proportion of Spirulina platensis in diets,feeding rate (FR) was significantly elevated while feed efficiency (FE) was significantly decreased. There was no significant difference in specific growth rate (SGR) between fishmeal group (FM) and 20% of Spirulina platensis replacement (SP20) (P>0.05), of which was significantly higher in fishmeal group than other groups (P<0.05). Meanwhile, no significant differences were found in protein retention efficiency (PRE) between FM, SP20, SP60 (P>0.05), while other groups were significantly lower than that of the FM group (P<0.05). The condition factor (CF) of FM group was significantly higher than other groups (P<0.05). The carcass protein of SP100 group was significantly lower than other group (P<0.05). A trend was observed in carcass fat, which the content of fat decreased from FM to SP40 group then increased from SP40 to SP100. The carcass ash of fish was significantly higher in SP20, SP40, SP60 than FM group (P<0.05). There was no significant difference among all treatments in intestinal digestive enzyme (trypsin, lipase, αamylase) (P>0.05). Apparent digestibility coefficients of dry matter significantly increased, while apparent digestibility coefficients of crude protein significantly decreased with the increased content of Spirulina platensis (P<0.05). The lowest apparent digestibility coefficient of total phosphorus was at SP20, and the highest one was at SP100. According to the variation of SGR and PER among all treatments, the optimum proportion of Spirulina platensis replacement dietary fishmeal protein was 20% while fishmeal as the sole protein source in the diet (the content of fishmeal in diet was about 50%).
Gibel carp; Spirulina platensis; Fishmeal; Protein replacement; Aquatic feed
S965.1
A
1000-3207(2016)04-0647-08
10.7541/2016.87
2015-10-08;
2016-01-14
公益性行业(农业)科研专项(201303053、201203015、201203083); 现代农业产业技术体系建设专项资金(CARS-46-19)资助[Supported by the Special Fund for Agro-scientific Research in the Public Interest (201303053, 201203015, 201203083); the Earmarked Fund for China Agriculture Research System (CARS-46-19)]
曹申平(1988—), 男, 安徽池州人; 硕士研究生; 主要从事鱼类营养学研究。 E-mail: csp-3036@163.com
朱晓鸣, E-mail: xmzhu@ihb.ac.cn
