饲料中添加溶菌酶对吉富罗非鱼生长、免疫-抗氧化功能及血清抗菌性能的影响
2016-08-10坛华雪铭2朱伟星3陈晓明吴钊孔纯焦建刚何亚丁王
王 坛华雪铭, 2朱伟星, 3陈晓明吴 钊孔 纯焦建刚何亚丁王 刚
(1. 上海海洋大学水产与生命学院, 上海 201306; 2. 农业部淡水水产种质资源重点实验室, 上海 201306; 3. 白银赛诺生物科技有限公司, 上海 200122)
饲料中添加溶菌酶对吉富罗非鱼生长、免疫-抗氧化功能及血清抗菌性能的影响
王 坛1华雪铭1, 2朱伟星1, 3陈晓明1吴 钊1孔 纯1焦建刚1何亚丁1王 刚1
(1. 上海海洋大学水产与生命学院, 上海 201306; 2. 农业部淡水水产种质资源重点实验室, 上海 201306; 3. 白银赛诺生物科技有限公司, 上海 200122)
为研究在饲料中添加不同水平的溶菌酶制品对吉富罗非鱼(GIFT, Oreochromis niloticus)生长性能、免疫-抗氧化功能和血清抗菌性能的影响, 选用平均体重为(11.35±0.08)g的吉富罗非鱼960尾, 随机分为6组(每组4个重复, 每个重复40尾), 分别投喂基础饲料(对照组)和5种添加水平分别为18、36、54、72和90 mg/kg溶菌酶制品的试验饲料, 养殖周期为60d。结果表明: (1) 54 mg/kg溶菌酶添加组鱼的生长性能和饲料利用情况最优, 增重率和蛋白质效率均显著高于对照组, 饲料系数显著低于对照组(P<0.05); 肝体比随溶菌酶添加水平的增加呈现下降趋势, 90 mg/kg添加组显著低于对照组(P<0.05); 脾脏指数在36和54mg/kg添加组显著低于对照组(P<0.05); 全鱼粗蛋白和粗灰分含量在54 mg/kg添加组均呈现较高水平, 显著高于对照组(P<0.05)。(2)溶菌酶添加水平对罗非鱼的免疫-抗氧化能力产生影响, 54和72 mg/kg添加水平能显著提高鱼体血清和肝脏的超氧化物歧化酶、过氧化氢酶活性, 降低丙二醛含量(P<0.05); 肝脏溶菌酶活性在54和72 mg/kg添加组均显著高于对照组(P<0.05), 而血清溶菌酶活性随溶菌酶添加水平的增加呈现下降趋势(L90组除外), 显著低于对照组(P<0.05)。(3)血清抗菌试验显示, 54和72 mg/kg溶菌酶添加组罗非鱼对大肠杆菌、金黄色葡萄球菌、嗜水气单胞菌和溶藻弧菌的抑制能力显著高于对照组(P<0.05), 而对枯草芽孢杆菌的抵抗能力最低, 比对照组分别低34.71%和42.21% (P<0.05)。结果表明, 在本试验条件下, 在吉富罗非鱼饲料中添加54 mg/kg溶菌酶制品可以改善其生长性能; 当添加水平为54和72 mg/kg时, 罗非鱼的免疫-抗氧化能力和血清抗菌性能均得到了显著提高。
吉富罗非鱼; 溶菌酶; 生长; 免疫-抗氧化功能; 抗菌性能
罗非鱼是世界性优良养殖品种之一, 在我国华南地区有广泛的养殖。近年来, 随着高密度集约化养殖模式的发展, 包括罗非鱼在内的一些鱼类养殖环境逐渐遭到恶化并滋生大量病原菌, 严重影响了鱼类的生长和机体健康。尽管使用抗生素类药物能在一定程度上缓解养殖过程中出现的上述问题,但与此同时也会产生药物残留、机体耐药性以及破坏水生动物微生态平衡等一系列不良问题, 对食品安全和人类健康构成了潜在威胁[1, 2]。因此, 寻找和开发一种和抗生素具有相似功能, 将其应用于鱼类养殖过程中又不会产生任何负面影响的抗生素替代品, 将成为解决上述问题的关键。
溶菌酶是机体细胞产生的一种具有抗菌活性的重要酶类, 广泛分布于动植物组织、体液和分泌物中, 主要通过破坏菌体细胞壁的肽聚糖而使之裂解死亡, 是包括鱼类在内的生物体非特异性免疫防御系统中的重要组成部分[3, 4]。迄今为止, 已从多种动植物组织和分泌物中发现了溶菌酶, 其对细菌、真菌和某些病毒表现出了不同程度的抗性[5, 6]。此外, 溶菌酶因具有无毒[7]、无残留[8]和耐热性强[9, 10]等优点而成为一类应用前景广阔的绿色饲料添加剂。研究表明, 在肉仔鸡[11, 12]、肉鸭[13]、断奶仔猪[14, 15]等饲粮中添加溶菌酶后对家畜家禽有促生长和提高抗病力的作用。然而, 试验动物的消化生理特点、生活环境与饲料加工工艺的不同,以及鱼的种属差异性, 均可能造成溶菌酶制品不同的应用效果。Chen等[16]在饲料中添加溶菌酶显著提高了异育银鲫(Carassius auratus gibelio)的生长性能和免疫调控能力; 而邢思华等[17]研究发现, 饲料中添加溶菌酶虽未提高草鱼(Ctenopharyngodon idellus)的生长性能, 但明显提高了其抗感染能力。
吉富罗非鱼(GIFT, Oreochromis niloticus)尽管在食性上与异育银鲫同属于杂食性, 但其消化道结构与异育银鲫和草鱼大不相同, 属于典型的有胃鱼类。本试验选用吉富罗非鱼为研究对象, 在其基础饲料中添加不同水平的溶菌酶制品, 研究该溶菌酶制品以口服方式进入罗非鱼体后对其生长、免疫-抗氧化功能和血清抗菌性能的影响, 旨在为溶菌酶制品在有胃鱼饲料中的合理利用提供理论参考。
1 材料与方法
1.1 试验饲料
根据NRC, 2011中罗非鱼的营养需求标准设计配方, 以鱼粉、豆粕、花生粕和菜籽粕为主要蛋白源, 以鱼油和豆油为主要脂肪源, 配制成粗蛋白、粗脂肪和总能水平分别为35.41%、5.77%和22.87 kJ/g的基础饲料, 在此基础上分别添加0、18、36、54、72和90 mg/kg的溶菌酶制品(上海沈李科工贸有限公司; 初始酶活性为5×103U/mg), 分别记为L0(对照组)、L18、L36、L54、L72和L90。饲料原料粉碎过40目筛, 微量成分采用逐级扩大的方法添加,与大宗原料均匀混合后用制粒机(SLP-45, 中国水产科学研究院渔业机械仪器研究所)制成粒径为2.0 mm的硬颗粒饲料, 风干后放于-20℃冰箱冷藏备用。试验饲料组成及营养水平见表 1。
1.2 试验设计与饲养管理
吉富罗非鱼来源于上海海洋大学罗非鱼育苗场, 经繁育后暂养于室外水泥池中, 用基础饲料驯化2周, 使其适应养殖环境。选择活泼健康、规格一致、平均体重为(11.35±0.08) g的吉富罗非鱼幼鱼960尾, 随机分成6组, 置于长方形水泥池的尼龙网箱(1.2 m×1.8 m×1.2 m)中, 每组设4个重复, 每个重复40尾。水源为120目筛绢过滤后的天然河水。试验期间投喂各组相对应的试验饲料, 前2周按鱼体重的6%—8%投喂, 之后为鱼体重的3%—5%, 于8:00、12:00和17:00分3次投喂, 并参照前一天的摄食情况做适当调整。养殖期间24h充气, 使昼夜溶氧>5 mg/L, 定期换水和吸污, 使氨氮含量<0.3 mg/ L, 水温26—34℃, 饲养周期为60d。
1.3 样品采集与指标测定
生长指标 试验结束后, 禁食24h, 对各重复试验鱼称重并计数, 用以统计成活率(Survival rate,SR)、增重率(Weight gain rate, WGR)和饲料系数(Feed conversion ratio, FCR)。每个网箱随机选取15尾鱼, 用150 mg/L的丁香酚水溶液将其快速麻醉,详细记录其中5尾鱼的体重、体长、脾脏重、肝脏重和头肾重量, 用以计算各器官占体重的百分比,以指数计。各组试验鱼的生长指标根据以下公式计算求得:
成活率(SR, %)=100×终末尾数/初始尾数
增重率(WGR, %)=100×[终末均重(g)-初始均重(g)]/初始均重(g)
饲料系数(FCR)=摄入饲料总量(g)/[终末体重(g)-初始体重(g)]
蛋白质效率(PER, %)=100×[终末体重(g)-初始体重(g)]/摄入蛋白量(g)
肥满度(CF, %)=100×体重(g)/[体长(cm)]3
肝体指数(HSI, %)=100×肝脏重(g)/鱼体重(g)
脾脏指数(SSI, %)=100×脾脏重(g)/鱼体重(g)
头肾指数(HKI, %)=100×头肾重(g)/鱼体重(g)
常规营养成分 每重复取2尾鱼用于全鱼营养成分分析。饲料和全鱼样品中常规营养成分的测定部分参照AOAC (2000)的方法。其中, 饲料水分采用105℃烘箱干燥恒重法测定, 全鱼水分采用冷冻干燥法测定; 饲料和全鱼粗蛋白含量采用凯氏定氮法(总氮×6.25)测定; 粗脂肪含量采用氯仿甲醇提取法测定; 粗灰分含量采用马弗炉550℃高温灼烧法测定; 总能水平的测定采用氧弹式热量计法。
血清和肝脏免疫-抗氧化相关指标 分别从每个重复随机取吉富罗非鱼10尾, 经150 mg/L的丁香酚水溶液快速麻醉后, 用肝素化的无菌注射器自尾静脉采血, 血样在4℃冰箱中静置4h后,4000 r/min离心10min制备血清。采血后, 解剖其中8尾鱼的肝脏组织, 所有样本分装后, -20℃冻存备用。

表 1 吉富罗非鱼基础饲料组成及营养水平(%, 风干基础)Tab. 1 Composition and nutrient levels of the basal diet for GIFT tilapia (%, air-dry basis)
取适量解冻后的肝脏组织, 用预冷的生理盐水(0.86%)漂洗, 滤纸拭干, 称重, 放于玻璃匀浆管中,按1∶9 (m∶v)比例加入生理盐水, 用玻璃匀浆机匀浆。匀浆液在4℃下4000 r/min离心10min, 取上清液待测。血清直接取自保存于-20℃冰箱中的样本解冻后待测。
溶菌酶(LZM)活性采用冰浴终止法测定。稀释样品与底物(溶壁微球菌粉, 南京建成生物工程研究所)在冰水浴中混匀后于570 nm处测定透光度(T样品0), 然后37℃水浴30min, 随后立即置于冰水浴中终止反应10min, 于570 nm处测定透光度(T样品),利用反应前后浊度的变化定义溶菌酶的活力大小。计算公式: 溶菌酶活性A(U/mL)=[(T样品-T样品0)/ (T标准-T标准0)]×标准管酶活力(溶菌酶标准品, 南京建成生物工程研究所)。
总超氧化物歧化酶(T-SOD)、过氧化氢酶(CAT)和丙二醛(MDA)含量均采用南京建成生物工程研究所提供的试剂盒进行测定。
肝脏组织样本上清液中总蛋白含量的检测采用考马斯亮蓝法, 使用南京建成生物工程研究所提供的蛋白定量测试盒进行测定。
肝脏LZM、T-SOD、CAT活性及MDA含量定义为每mg总蛋白中含有的单位数。
血清抗菌活性 选择革兰氏阳性菌(G+)中的金黄色葡萄球菌(Staphylococcus aureus)、枯草芽孢杆菌(Bacillus subtilis)以及革兰氏阴性菌(G-)中的嗜水气单胞菌(Aeromonas hydrophila)、大肠杆菌(Escherichia coli)和溶藻弧菌(Vibrio alginolyticus)进行抗菌试验。各菌种均来源于上海海洋大学病原库。其中, 金黄色葡萄球菌和大肠杆菌接种于LB琼脂培养基中; 枯草芽孢杆菌接种于营养琼脂(NA)培养基中; 嗜水气单胞菌和溶藻弧菌接种于胰蛋白胨大豆琼脂(TSA)培养基(后者加入1%的NaCl)中[18]。挑取1—2 mm的新鲜单一菌落接种在5 mL相适宜的液体培养基中(上述), 于摇床中以200—250 r/min的速度, 30℃条件下培养16h, 并调整菌悬液的浓度值为A600=0.5 (麦氏标准)[19]。
血清抗菌活性的测定参考Sunyer和Tort[20]的方法并略有改动。取100 µL细菌稀释液(1/10)于96微孔板中, 立即加入相等体积的血清样本, 与此同时,以只加入血清的微孔作为阴性对照, 以只加入细菌稀释液的微孔作为阳性对照, 在30℃条件下孵育24h, 每小时记录一次吸光度值(A650)。
1.4 数据统计分析
实验数据均以平均值±标准差(mean±SD)表示,用SPSS17.0分析软件进行单因素方差分析(one-way ANOVA), 若存在显著性差异, 则采用Duncan氏法进行多重比较, P<0.05表示差异显著。
2 结果
2.1 饲料中添加溶菌酶对吉富罗非鱼生长性能的影响

表 2 饲料中添加溶菌酶对吉富罗非鱼生长性能的影响Tab. 2 Effects of dietary lysozyme supplementation on growth performance of GIFT tilapia
在养殖试验期间, 各重复组成活率均达到100%。由表 2可知, L54组鱼的终末体重、增重率和蛋白质效率均达到最大值, 且显著高于对照组(P<0.05), 其他组鱼的末均重和增重率略高于对照组或与对照组无显著性差异(P>0.05); 与此同时,L36、L72和L90组鱼的蛋白质效率也显著高于对照组(P<0.05)。除L18组外, 其余各添加组鱼的饲料系数均低于对照组, L54组鱼的饲料系数最低(P<0.05), 其他组与对照组无显著性差异(P>0.05);肝体比在L90组鱼显著低于对照组(P<0.05), L36-L72组虽低于对照组, 但无显著性差异(P>0.05); 脾脏指数在L36和L54组显著低于对照组(P<0.05), 其余各组与对照组无显著性差异(P>0.05); 而在肥满度和头肾指数上, 各组鱼均无显著性差异(P>0.05)。
2.2 饲料中添加溶菌酶对吉富罗非鱼体成分的影响
由表 3可知, 饲料溶菌酶添加水平对吉富罗非鱼全鱼水分和粗脂肪含量无显著性影响(P>0.05),而对全鱼粗蛋白和灰分含量产生影响。L18、L54 和L90组罗非鱼的粗蛋白含量显著高于对照组(P<0.05); L54组全鱼的粗灰分含量显著高于对照组(P<0.05)。
2.3 饲料中添加溶菌酶对吉富罗非鱼免疫-抗氧化相关指标的影响
由表 4可知, 饲料溶菌酶水平对吉富罗非鱼血清和肝脏的免疫-抗氧化指标均产生显著影响(P<0.05)。血清中, L18、L36、L54和L72组鱼的溶菌酶(LZM)活性显著低于对照组(P<0.05), 而L90组显著高于对照组(P<0.05); 超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性在L54、L72和L90组均显著高于对照组和其他各组(P<0.05), 分别在L72和L54组有最大值; 丙二醛(MDA)含量在L54组显著低于对照组(P<0.05), 在L72和L90组显著高于对照组(P<0.05), 其他各组无显著性差异(P>0.05)。肝脏中, L54和L72组鱼的LZM和SOD活性均显著高于对照组和其他各组(P<0.05); MDA含量在L54组显著低于对照组和其他各组(P<0.05);CAT活性在L54、L72和L90组显著高于对照组(P<0.05), L18、L36组与对照组无显著性差异(P>0.05)。综上分析可看出, 用含不同溶菌酶添加水平的饲料喂养吉富罗非鱼60d后, L54、L72和L90组鱼的血清免疫-抗氧化系统处于激活状态, 主要表现在与免疫和抗氧化相关的酶活上; 丙二醛含量在L54组有较低水平, 但在L72和L90组出现相反的变化趋势。与此同时, 肝脏的免疫-抗氧化相关指标在L54和L72组也呈现较高水平。
2.4 血清抗菌活性
由表 5可知, 用含不同溶菌酶添加水平的饲料喂养吉富罗非鱼60d后, 各组鱼的血清对试验菌种表现出了不同的抑制能力。从整体水平上看,L54和L72组鱼的血清对大肠杆菌(E. coli)、金黄色葡萄球菌(S. aureus)、嗜水气单胞菌(A. hydrophila)和溶藻弧菌(V. alginolyticus)的抑制能力均显著高于对照组(P<0.05), 并对金黄色葡萄球菌表现出了最大的抑制作用; 对于枯草芽孢杆菌(B. subtilis)而言, 各组鱼血清对其的抑制能力总体低于其他受试菌种, 且L36-L90组对该菌的抑制能力显著低于对照组和L18组(P<0.05), 其中, L54和L72组表现出了最低的抗菌活力, 与对照组相比分别降低34.71%和42.21%(P<0.05)。

表 3 饲料中添加溶菌酶对吉富罗非鱼体成分的影响Tab. 3 Effects of dietary lysozyme supplementation on body composition of GIFT tilapia (%)

表 4 饲料中添加溶菌酶对吉富罗非鱼超氧化物歧化酶、过氧化氢酶、溶菌酶活性和丙二醛含量的影响Tab. 4 Effects of dietary lysozyme supplementation on SOD, CAT, LZM activity and MDA content of GIFT tilapia
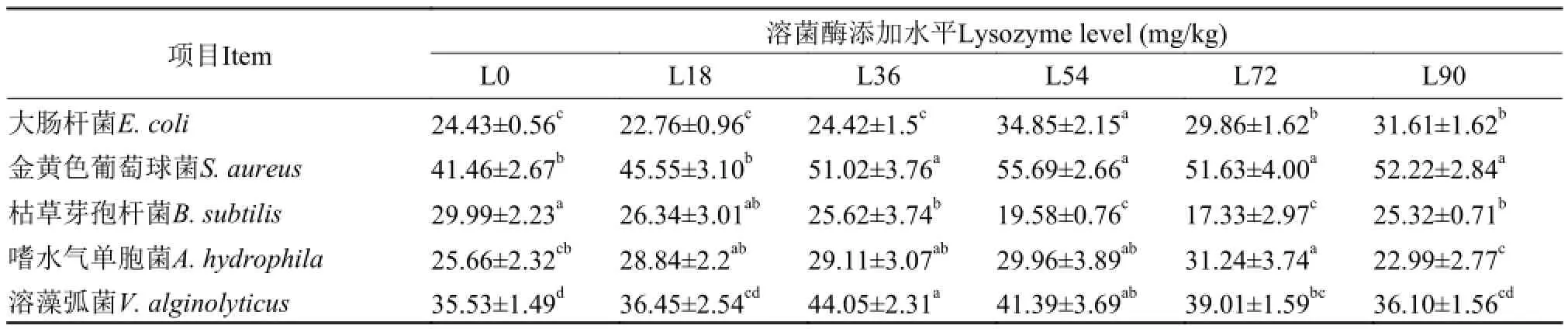
表 5 饲料中添加溶菌酶对吉富罗非鱼血清抗菌活性的影响Tab. 5 Effects of dietary lysozyme supplementation on serum antimicrobial activity of GIFT tilapia (%)
3 讨论
3.1 饲料中添加溶菌酶对吉富罗非鱼生长性能和饲料利用的影响
本试验结果显示, 溶菌酶制品添加水平在36—90 mg/kg时, 吉富罗非鱼的增重率和蛋白质效率总体呈现一个上升趋势, 饲料系数呈现下降趋势(相较于对照组), 其中, 54 mg/kg添加水平下吉富罗非鱼表现出了最佳的生长效果, 但在高剂量添加水平下, 罗非鱼的增重和饲料利用又呈现出略微下降的趋势, 说明该溶菌酶制品在适宜添加范围内可改善吉富罗非鱼的生长和饲料利用, 但是添加水平过高可能降低其促生长作用。随溶菌酶添加水平的提高, 肝体比在组间呈现下降趋势, 90 mg/kg添加组显著低于对照组(P<0.05), 说明饲用溶菌酶有助于对贪食性鱼类患脂肪肝等脂肪蓄积性疾病的预防, 这可能源于溶菌酶具有类似消化酶的功能[21, 22],使得溶菌酶饲料组的罗非鱼对营养物质的消化吸收(未发表数据)和对饲料的利用率有不同程度的提高, 因此促进了鱼体生长并降低了肝脏负担。抗菌实验表明, 添加较高水平的溶菌酶(54和72 mg/kg)能够保护芽孢杆菌在罗非鱼体内的生长和繁殖, 而对金黄色葡萄球菌等有害菌起到了较强的抑制作用, 推测该溶菌酶制品对罗非鱼的促生长作用还可能与机体内群落多样性的降低有关, 从而集中更多的能量用于生长。
3.2 饲料中添加溶菌酶对吉富罗非鱼体成分的影响
在本试验中, 溶菌酶添加组鱼的粗蛋白和粗灰分含量总体呈现一个上升趋势(L72组除外), 可能原因在于饲料中添加溶菌酶后有利于鱼体对蛋白质等营养物质的消化吸收及其在机体中的合成与沉积, 相关研究结果已在畜禽动物上得到证实[23—25]。另一方面, 当添加水平为54和90 mg/kg时, 罗非鱼的肝体比均有下降趋势, 而全鱼粗蛋白含量显著高于对照组(P<0.05), 说明在此投喂水平和养殖环境下, 为确保机体的正常生长, 罗非鱼更多地动用了肝脏中的脂肪源作为能源物质, 以缓解可能存在的食物限制对鱼类生长和营养价值方面的不良影响[26]。目前, 有关溶菌酶制品添加到饲料中对鱼体成分的影响仅见于异育银鲫[16], 关于此方面的问题有待进一步研究。
3.3 饲料中添加溶菌酶对吉富罗非鱼免疫-抗氧化能力的影响
鱼类属于低等的变温脊椎动物, 其特异性免疫系统发育尚不完善, 主要依靠自身的非特异性免疫来抵抗病原生物的入侵[27]。溶菌酶(LZM)、超氧化物歧化酶(SOD)及过氧化氢酶(CAT)是鱼类免疫防御和抗氧化体系中的重要组成部分, 在免疫应答和抗氧化过程中起着不可忽视的作用。LZM可清除其他抗菌因子作用后所剩余的细菌细胞壁并增强其他免疫因子的抗菌敏感性[28]; SOD具有清除机体过多氧自由基的功能, 能够维持机体免受氧化损伤, 且SOD与生物的免疫水平密切相关, 能够增强吞噬细胞的防御能力和整个机体的免疫功能[29];CAT对于清除超氧化物歧化酶歧化超氧阴离子自由基(O2-)产生的过氧化氢(H2O2)起着重要作用, 和SOD具有相类似的生物学功能[30]。本研究表明, 在饲料中添加54、72和90 mg/kg溶菌酶能显著提高吉富罗非鱼的血清SOD和CAT活性, 这与邢思华等[17]在草鱼中研究结果相类似, 并认为溶菌酶进入鱼体后对内源性免疫酶(SOD和ALP)有激活作用。Chen等[16]在异育银鲫饲料中添加溶菌酶后并没有提高血清SOD的活性, 然而攻毒后血清中的SOD活性显著提高, 这可能与鱼的种类和自身反馈调节机制的不同有关, 但上述结果都能说明饲料中添加一定量的溶菌酶可以改变鱼体的免疫状态。MDA是脂质过氧化物的主要分解产物, 具有很强的生物毒性, MDA含量升高与氧自由基产生过多密切相关[31]。当溶菌酶添加水平为54 mg/kg时, 血清MDA含量最低, 但是72和90 mg/kg添加组又显著高于对照组, 结合肝脏SOD分析可知, L90组鱼的SOD活性较低, 因此累积的MDA可能代谢进入血液循环, 从而使该组鱼血清中的MDA含量升高, 这可能与鱼体的自我调节机制有关。肝脏作为鱼体的代谢活动中心, 其免疫-抗氧化水平的变化对于整个机体免疫-抗氧化轴系功能的发挥具有重要作用。研究结果表明, 饲料中添加54和72 mg/kg溶菌酶显著提高了吉富罗非鱼肝脏中的LZM、SOD和CAT活性, 并且MDA含量在L54组显著低于对照组(P<0.05), 说明该饲用溶菌酶对吉富罗非鱼肝脏的免疫-抗氧化功能起到了积极的调控作用。与此同时, 血清LZM活性随添加水平的提高呈现下降趋势(L90组除外), 这可能由于添加溶菌酶后降低了鱼体的菌群多样性(未发表数据), 从而削弱了机体自身的免疫活化[16, 32, 33]。研究表明, 当溶菌酶进入鱼体后, 主要通过抑制内环境葡萄球菌科等的繁殖,使肠道菌群多样性降低, 进而通过削弱和阻断病原体相关分子模式与识别受体之间的相关联系而使机体自身免疫活化水平降低; 然而在肝脏中呈现升高的趋势, 这又可能与肝脏较为独立的局部微循环有关。研究表明, 大多通过门静脉入肝的病原体可跳过脾脏和淋巴系统, 直接与肝脏免疫系统相互作用, 并在肝脏中形成一个局部免疫微环境[34]。
3.4 饲料中添加溶菌酶对吉富罗非鱼血清抗菌性能的影响
在鱼类血清中含有丰富的非特异性体液因子,是抵抗外来病原菌入侵的一道重要屏障[35]。因而,血清抗菌活性的大小可作为表征鱼类免疫功能的一项直接指标[36]。本试验结果表明, 各组鱼的血清均能抑制试验菌的生长速度, 但不同的添加水平存在较大的差异。在较高剂量添加水平下, L54、L72和L90组鱼的血清对大肠杆菌(E. coli)和金黄色葡萄球菌(S. aureus)的抑制能力显著高于对照组(P<0.05), 而低剂量添加组与对照组无显著性差异(P>0.05)。于此同时, 高剂量添加组鱼的免疫-抗氧化相关酶活性也显著高于对照组, 说明机体抗菌性能的发挥与其免疫-抗氧化水平密切相关[37]; 而免疫和抗氧化功能的有效调节也得益于试验鱼相对高效的饲料利用率, 为免疫-抗氧化系统的功能发挥提供了营养保障[38]。嗜水气单胞菌(A. hydrophila)是淡水鱼类中常见的条件致病菌; 溶藻弧菌(V. alginolytcus)是海水中的一种嗜盐性弧菌, 能够引起多种鱼类的创伤性感染[39], 二者均属革兰氏阴性菌(G-)。在本试验条件下, 各组鱼血清对这两种菌的抑制作用均呈现一个先升后降的变化趋势, 这可能是由于过高剂量(90 mg/kg)的溶菌酶进入鱼体后产生的排异行为, 在一定程度上削弱了其抗菌性能,因此降低了对弧菌科的抵抗作用[40]。另一方面, 在溶菌酶制品同一添加水平条件下, 各组鱼血清对S. aureus的抑制作用更大, 其原因是溶菌酶对革兰氏阳性菌的抑菌效果要明显优于革兰氏阴性菌[41, 42]。而各组鱼的血清对枯草芽孢杆菌(B. subtilis)的抑制作用明显低于其他各菌种, 这可能与溶菌酶制品的选择性抑菌性能有关, 研究表明溶菌酶对病原菌具有较强的抑菌作用, 而对诸如芽孢杆菌科的有益菌则无抑制能力或抑制能力较弱[16, 43]。
4 小结
在本试验条件下, 在吉富罗非鱼饲料中添加54 mg/kg溶菌酶制品可以改善其生长性能; 当添加水平为54和72 mg/kg时, 罗非鱼的免疫-抗氧化能力和血清抗菌性能均有显著提高。
[1]Rico A, Van den Brink P J. Probabilistic risk assessment of veterinary medicines applied to four major aquaculture species produced in Asia [J]. Science of the Total Environment, 2014, 468—469: 630—641
[2]Zhao M, Wang K Y, Wang J, et al. Tetracycline antibiotics resistance and its genetic determinants in Aeromonas veronii isolated from Channel catfish (Ictalurus punctatus) [J]. Acta Hydrobiologica Sinica, 2014, 38(2):386—392 [赵敏, 汪开毓, 王均, 等. 斑点叉尾鲖源维氏气单胞菌对四环素类抗生素的耐药性及耐药基因的检测. 水生生物学报, 2014, 38(2): 386—392]
[3]Saurabh S, Sahoo P K. Lysozyme: an important defence molecule of fish innate immune system [J]. Aquaculture Research, 2008, 39(3): 223—239
[4]Callewaert L, Michiels C W. Lysozymes in the animal kingdom [J]. Journal of Biosciences, 2010, 35(1):127—160
[5]Zhang X, Wu F X, Sun M, et al. Study on antimicrobial and antiviral activities in vitro of marine microorganism lysozyme [J]. Scientia Agricultura Sinica, 2007, 40(11):2626—2631 [张琇, 吴发兴, 孙谧, 等. 海洋微生物溶菌酶体外抗菌抗病毒活性研究. 中国农业科学, 2007,40(11): 2626—2631]
[6]Cao T, Liu T J, Wang Y J. Research and application of Microbial lysozyme [J]. China Condiment, 2011, 36(3):23—26 [曹涛, 刘同军, 王艳君. 微生物溶菌酶的研究及应用. 中国调味品, 2011, 36(3): 23—26]
[7]Cerven D, DeGeorge G, Bethell D. 28-Day repeated dose oral toxicity of recombinant human apo-lactoferrin or recombinant human lysozyme in rats [J]. Regulatory Toxicology and Pharmacology, 2008, 51(2): 162—167
[8]Bukharin O V, Valyshev A V. Microbial inhibitors of lysozyme [J]. Zhurnal Mikrobiologii, Epidemiologii, Immunobiologii, 2006, (4): 8—13
[9]Manas P, Munoz B, Sanz D, et al. Inactivation of lysozyme by ultrasonic waves under pressure at different temperatures [J]. Enzyme and Microbial Technology, 2006,39(6): 1177—1182
[10]Xing S H, Hua X M, Zhu Z Y, et al. Study on the stability of fishery lysozyme product [J]. Feed Industry, 2014,35(22): 20—23 [邢思华, 华雪铭, 朱站英, 等. 渔用溶菌酶制品的稳定性研究. 饲料工业, 2014, 35(22): 20—23]
[11]Wang J, Bi X, Tian Y M. Effects of special lysozyme on growth performance and development of immune organs of broilers [J]. Cereal and Feed Industry, 2013, (11):51—54 [王军, 毕雪, 田玉民. 一种专用溶菌酶对肉仔鸡生长性能和免疫器官发育的影晌. 粮食与饲料工业,2013, (11): 51—54]
[12]Zhang S Q, Zhu Z K, Wang M C, et al. Effects of lysozyme on growth performance, metabolism and immune indices of broilers fed with corn-soybean basal diets [J]. Chinese Journal of Animal Nutrition, 2008, 20(4):463—468 [张世卿, 朱忠珂, 王明成, 等. 玉米-豆粕日粮添加溶菌酶对肉仔鸡生长性能, 代谢及免疫指标的影响. 动物营养学报, 2008, 20(4): 463—468]
[13]Gu W Z, Zhang G J. Effects of lysozyme on growth performance and immune organ index of meat duck [J]. Feed Industry, 2008, 29(24): 46—48 [顾维智, 张国基. 溶菌酶对肉鸭生长性能和免疫器官指数的影响. 饲料工业,2008, 29(24): 46—48]
[14]Wang X K, Wang X S, Wang G Y, et al. Effect of lysozyme on growth performance of the weaned piglet [J]. Feed Industry, 2008, 29(22): 31—33 [王晓可, 王晓硕,王根彦, 等. 溶菌酶对断奶仔猪生长性能的影响. 饲料工业, 2008, 29(22): 31—33]
[15]Li X, Tan Z J, Fu D W, et al. Effects of lysozyme on growth performance and blood biochemical indices of the weaned piglets [J]. Swine Production, 2012, (6): 9—12[李鑫, 谭志坚, 符德文, 等. 溶菌酶对断奶仔猪生长性能和血液生化指标的影响. 养猪, 2012, (6): 9—12]
[16]Chen Y, Zhu X, Yang Y, et al. Effect of dietary lysozyme on growth, immune response, intestine microbiota,intestine morphology and resistance to Aeromonas hydrophilia in gibel carp (Carassius auratus gibelio) [J]. Aquaculture Nutrition, 2014, 20(3): 229—241
[17]Xing S H, Hua X M, Zhu Z Y, et al. Effect of dietary lysozyme levels on growth and anti-infection ability of Ctenopharyngodon idellus [J]. Journal of Huazhong Agricultural University, 2013, 31(6): 731—736 [邢思华, 华雪铭, 朱站英, 等. 饲料中添加溶菌酶对草鱼生长性能和抗感染能力的影响. 华中农业大学学报, 2013, 31(6):731—736]
[18]Liu P C, Lin J Y, Hsiao P T, et al. Isolation and characterization of pathogenic Vibrio alginolyticus from diseased cobia Rachycentron canadum [J]. Journal of Basic Microbiology, 2004, 44(1): 23—28
[19]Forbes B A, Sahm D F, Weissfeld A S. Bailey and Scott's Diagnostic Microbiology (The 10th Edition) [M]. StLouis, MO: Mosby. 1998, 673—685
[20]Sunyer J O, Tort L. Natural hemolytic and bactericidal activities of sea bream Sparus aurata serum are effected by the alternative complement pathway [J]. Veterinary Immunology and Immunopathology, 1995, 45(3):333—345
[21]McHenery J G, Birkbeck T H. Characterization of the lysozyme of Mytilus edulis (L) [J]. Comparative Biochemistry and Physiology Part B: Comparative Biochemistry, 1982, 71(4): 583—589
[22]McDade J E, Tripp M R. Lysozyme in oyster mantle mucus [J]. Journal of Invertebrate Pathology, 1967, 9(4):581—582
[23]Ding Y N. Effects of recombinant lysozyme on growth performance and carcass traits in broilers [J]. Journal of Anhui Agricultural Sciences, 2012, 40(34): 16623, 16626[丁亦男. 人重组溶菌酶对肉鸡营养消化及肠道组织结构的影响. 安徽农业科学, 2012, 40(34): 16623, 16626]
[24]Cheng S J, Ma L B, Zhang W. Effect of lysozyme on growth performance and apparent digestibility of nutrients in broiler [J]. Feed China, 2009, (19): 32—34 [程时军, 马立保, 张伟. 溶菌酶对肉鸡生长性能与营养物质表观消化率的影响. 饲料广角, 2009, (19): 32—34]
[25]Liu Y, Ren Y L, Yang X H, et al. Application and prospect of microbial lysozyme in feed industry [J]. Modern Agricultural Science and Technology, 2005, (12): 79—80[刘莹, 任于翎, 杨翔华, 等. 微生物溶菌酶在饲料工业中的应用及其展望. 现代农业科技, 2005, (12): 79—80]
[26]Zhou L X, Han D, Zhu X M, et al. Effects of ration restriction and refeeding on the growth, feeding and body composition of Cyprinus longipectoralis juveniles [J]. Acta Hydrobiologica Sinica, 2013, 37(1): 172—176 [周良星, 韩冬, 朱晓鸣, 等. 限食及恢复投喂对春鲤幼鱼摄食、生长和鱼体组成的影响. 水生生物学报, 2013,37(1): 172—176]
[27]Rauta P R, Nayak B, Das S. Immune system and immune responses in fish and their role in comparative immunity study: a model for higher organisms [J]. Immunology Letters, 2012, 148(1): 23—33
[28]Nigam A K, Kumari U, Mittal S, et al. Comparative analysis of innate immune parameters of the skin mucous secretions from certain freshwater teleosts, inhabiting different ecological niches [J]. Fish Physiology and Biochemistry, 2012, 38(5): 1245—1256
[29]Yao C L, Wang W N, Wang A L. Progress of studies on super oxide dismutase in the body of aquatic animals [J]. Marine Sciences, 2003, 27(10): 18—21 [姚翠鸾, 王维娜,王安利. 水生动物体内超氧化物歧化酶的研究进展. 海洋科学, 2003, 27(10): 18—21]
[30]Li G F, Qian P F, Sun J J, et al. Effects of vitamin C on enzymes activities related to immunity in Claris batrachus serum [J]. Journal of Dalian Fisheries University, 2005, 19(4): 301—305 [李桂峰, 钱沛锋, 孙际佳, 等. 维生素C对胡子鲶血清免疫相关酶活性的影响. 大连水产学院学报, 2005, 19(4): 301—305]
[31]Modesto K A, Martinez C B R. Roundup® causes oxidative stress in liver and inhibits acetylcholinesterase in muscle and brain of the fish Prochilodus lineatus [J]. Chemosphere, 2010, 78(3): 294—299
[32]Li L. Relations between changes of intestinal microflora and immune function of Grass Carp (Ctenopharyngodon idellus) [D]. Huazhong Agricultural University, 2003 [李莉. 草鱼肠道菌群的变化和免疫机能的关系. 华中农业大学, 2003]
[33]Chen J J. Effects of APS on the intestinal mucous immunity and intestinal microflora in Tilapia [D]. Fujian Agriculture and Forestry University, 2009 [陈晶晶. 河蚌多糖对罗非鱼肠道黏膜免疫和菌群的影响. 福建农林大学, 2009]
[34]Ye C T, Wei X, Zhang Y. Current status of research on liver innate immunity [J]. Journal of Clinical Hepatology,2014, 30(9): 846—850 [叶传涛, 魏欣, 张颖. 肝脏固有免疫系统研究现状. 临床肝胆病杂志, 2014, 30(9):846—850]
[35]Ellis A E. Immunity to bacteria in fish [J]. Fish & Shellfish Immunology, 1999, 9(4): 291—308
[36]Mou S X, Zhou X, Peng Y Z, et al. Effect of fibrous root of Coptis chinensis franch and berberine on the non-specific immunity and resistance against Aeromonas hydrophilainfection in grass carp (Ctenopharyngodon idella)[J]. Acta Hydrobiologica Sinica, 2015, 39(2): 267—274[牟绍霞, 周霞, 彭耀宗, 等. 黄连须和小檗碱对草鱼非特异性免疫系统的影响及对嗜水气单胞菌感染的抵抗作用. 水生生物学报, 2015, 39(2): 267—274]
[37]Subramanian S, MacKinnon S L, Ross N W. A comparative study on innate immune parameters in the epidermal mucus of various fish species [J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2007, 148(3): 256—263
[38]Ming J H, Ye J Y, Zhang Y X, et al. Effects of dietary reduced glutathione on growth performance, non-specific immunity, antioxidant capacity and expression levels of IGF-I and HSP70 mRNA of grass carp (Ctenopharyngodon idella) [J]. Aquaculture, 2015, 438: 39—46
[39]Chen Y E, Jin S, Wang G L. Study on blood physiological and biochemical indices of Vibrio alginolyticus disease of Lateolabrax japonicus [J]. Journal of Oceanography in Taiwan Strait, 2005, 24(1): 104—108 [陈寅儿,金珊, 王国良. 鲈鱼溶藻弧菌病的血液生理生化指标研究. 台湾海峡, 2005, 24(1): 104—108]
[40]Yokooji T, Hamura K, Matsuo H. Intestinal absorption of lysozyme, an egg-white allergen, in rats: kinetics and effect of NSAIDs [J]. Biochemical and Biophysical Re-search communications, 2013, 438(1): 61—65
[41]Losso L N, Nakai S, Charter E A. Lysozyme [M]. In:Naidu A (Eds.), Nature Food Antimicrobial Systems. New York: CRC Press. 2000, 185—210
[42]Zhang Y H, Zhang R, Wang X X, et al. Application of lysozyme as feed additives in animal production [J]. Feed Review, 2011, (6): 23—25 [张宜辉, 张蕊, 王信喜, 等. 溶菌酶作为饲料添加剂在动物生产上的应用. 饲料博览,2011, (6): 23—25]
[43]Lu Y P, Pan H T. The research status and application progress of lysozyme [J]. Feed and Animal Husbandry: New Feed, 2008, (2): 26—27 [卢亚萍, 潘宏涛. 溶菌酶的研究现状及应用进展. 饲料与畜牧: 新饲料, 2008, (2):26—27]
EFFECTS OF DIETARY LYSOZYME SUPPLEMENTATION ON GROWTH PERFORMANCE, IMMUNE-ANTIOXIDANT CAPACITY AND SERUM ANTIBACTERIAL PROPERTIES OF GIFT TILAPIA (OREOCHROMIS NILOTICUS)
WANG Tan1, HUA Xue-Ming1, 2, ZHU Wei-Xing1, 3, CHEN Xiao-Ming1, WU Zhao1, KONG Chun1,JIAO Jian-Gang1, HE Ya-Ding1and WANG Gang1
(1. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China; 2. Key Laboratory of Genetic Resources for Freshwater Aquaculture and Fisheries, Ministry of Aquaculture, Shanghai 201306, China; 3. Bai Yin Sino Bio-science Co., Ltd, Shanghai 200122, China)
To investigate effects of dietary lysozyme supplementation on growth performance, immune-antioxidant capacity and antibacterial properties of GIFT tilapia (Oreochromis niloticus), basal diet or basal diet added with 18, 36,54, 72 or 90 mg/kg lysozyme were formulated for a 60 days experiment. The results showed that the 54 mg/kg lysozyme addition group had the best growth and feed efficiency in which weight gain rate and protein efficiency ratio increased and feed conversion ratio decreased significantly compared with the control group (P<0.05). Lysozyme supplementation decreased hepatosomatic index with significant difference in 90 mg/kg group compared with the control group (P<0.05). Spleen-somatic index was significantly lower in 36 mg/kg and 54 mg/kg groups compared with that of the control group (P<0.05). Crude protein and ash content in whole body in 54 mg/kg group were significantly higher than that of the control group (P<0.05). Lysozyme supplementation in 54 and 72 mg/kg group increased serum and liver superoxide dismutase and catalase activity but significantly decreased malondialdehyde content compared with the control group (P<0.05). Liver lysozyme activity in 54 and 72 mg/kg group was significantly higher than that of the control group, while serum lysozyme activity in groups except L90 group was significantly lower than that of the control group (P<0.05). Serum antibacterial test showed more resistance to Escherichia coli, Staphylococcus aureus, Aeromonas hydrophila, Vibrio alginolyticus in 54 and 72 mg/kg group compared with the control group but more sensitive to Bacillus subtilis with a 34.71% and 42.21% reduction, respectively. These results indicated that diet lysozyme supplementation (such as 54 mg/kg) can improve GIFT tilapia growth performance by regulating immune-antioxidant capacity of tilapia and improving serum antibacterial properties.
GIFT tilapia; Lysozyme; Growth performance; Immune-antioxidant capacity; Antimicrobial activity
S963.73
A
1000-3207(2016)04-0663-09
10.7541/2016.89
2015-07-20;
2016-01-14
广东省教育部产学研结合项目(2012B091100372); 现代农业产业技术体系专项资金(CARS-49-04B); 水产动物遗传育种中心上海市协同创新中心(ZF1206)资助 [Supported by Ministry of Education of Guangdong Province University-industry Cooperation Project (2012B091100372); China Agriculture Research System (CARS-49-04B); Shanghai Collaborative Innovation Center for Aquatic Animal Genetics and Breeding (ZF1206)]
王坛(1988—), 女, 河北晋州人; 硕士研究生; 研究方向为水产动物营养与饲料。E-mail: wangtan0818@163.com
华雪铭(1974—), 女, 副教授, 硕士生导师; 研究方向为水产动物营养与免疫。E-mail: xmhua@shou.edu.cn
