芙蓉鲤鲫幼鱼饲料适宜淀粉含量
2016-08-10林朱晓鸣韩冬杨云霞金俊琰刘昊昆解绶启
陈 林朱晓鸣韩 冬杨云霞金俊琰刘昊昆解绶启
(1. 安徽大学资源与环境工程学院, 合肥 230601; 2. 中国科学院水生生物研究所淡水生态与生物技术国家重点实验室,武汉 430072)
芙蓉鲤鲫幼鱼饲料适宜淀粉含量
陈 林1, 2朱晓鸣2韩 冬2杨云霞2金俊琰2刘昊昆2解绶启2
(1. 安徽大学资源与环境工程学院, 合肥 230601; 2. 中国科学院水生生物研究所淡水生态与生物技术国家重点实验室,武汉 430072)
实验以鱼粉和酪蛋白为主要蛋白源、以鱼油和豆油为主要脂肪源(鱼油/豆油, 1/1), 设计了7组不同玉米淀粉水平(6%、12%、18%、24%、30%、36%和42%)的等氮(35%)等脂(8%)饲料来饲喂芙蓉鲤鲫(Carassius auratus var Furong carp ♀×Cyprinus carpio red crucian carp ♂)幼鱼(8.94±0.59) g以确定其最适饲料淀粉水平。实验周期为61d。结果表明, 随饲料玉米淀粉水平的增加实验鱼增重率、特定生长率和饲料效率先上升(P<0.05)而后趋于稳定, 18%—42%饲料玉米淀粉组之间差异不显著(P>0.05)。鱼体蛋白沉积率随饲料玉米淀粉水平的增加而增加, 30%和42%处理组显著高于6%和12%处理组(P<0.05)。血浆葡萄糖没有受饲料玉米淀粉水平的影响(P>0.05), 血浆总胆固醇含量在30%处理组最高(P<0.05), 血浆甘油三酯随饲料玉米淀粉水平的增加而上升(P<0.05)。肝糖原随饲料玉米淀粉水平的增加而上升, 36%处理组显著高于6%和12%处理组(P<0.05)。肌糖原和肠道淀粉酶活性随饲料玉米淀粉水平增加而显著上升(P<0.05)。通过特定生长率和饲料淀粉水平的折线法分析表明, 芙蓉鲤鲫幼鱼达到最大生长时饲料淀粉水平为27.47%。
芙蓉鲤鲫; 淀粉需求; 饲料利用
碳水化合物是生命细胞结构的主要成分, 并且有调节细胞活动的重要功能。机体中碳水化合物主要有3种存在形式, 葡萄糖、糖原以及含糖的复合物。饲料中的碳水化合物是鱼类获取能量的最经济和主要来源, 当饲料中蛋白质维持在适当水平,适量的添加碳水化合物还能起到节约蛋白的作用[1, 2], 不仅能降低饲料成本而且还能减少氮排泄对水体的污染。然而饲料中碳水化合物含量并非越高越好, 饲料碳水化合物水平过高会抑制鱼类的生长, 导致鱼体血糖水平持续升高, 免疫功能降低[3]。研究表明, 鱼类摄食高碳水化合物饲料后肝糖原含量增加, 容易损害鱼类肝脏的正常功能, 高糖饲料还会在鱼体内转化为中性脂肪后堆积在肝脏处, 导致肝脏脂肪沉积, 肝脏脂肪含量过高导致肝脏中脂滴空泡状面积率增加, 而脂滴空泡状面积率与肝脏组织的脂肪肝病变程度成正比[4], 此外, 研究发现过高的碳水化合物水平饲料导致草鱼肠系膜脂肪过多沉积[5], 脂肪在肠系膜中沉积会使草鱼腹部膨大,可食部分相对减少[6]。碳水化合物对于维持鱼类脑、鳃组织和红细胞等组织细胞的正常功能具有重要作用[7], 鱼体摄入低碳水化合物饲料后血糖浓度降低, 脑组织可因缺乏能源而使脑细胞功能受损,造成功能障碍。影响鱼类对碳水化合物利用的因素有很多, 除了与品种、鱼体规格以及食性有关外,碳水化合物的来源、纤维素含量、投喂频率、环境温度等也会对其产生影响。因此寻求满足养殖鱼类生长的最适碳水化合物水平在生态、经济以及生活方面显得尤为重要。目前, 作为碳水化合物主要来源的玉米淀粉, 因其价格低廉, 鱼类对其利用较好而被广泛的应用于水产饲料中。
芙蓉鲤鲫(Carassius auratus var Furong carp)是湖南省水产科学研究所以散鳞镜鲤(Cyprinus carpio)为母本, 兴国红鲤(Cyprinus carpio singguoensis)为父本杂交获得杂交子代芙蓉鲤(Cyprinus capioFurong), 再以芙蓉鲤为母本, 红鲫(Carassius auratus red var.)为父本进行杂交而培育出的新品种。芙蓉鲤鲫体色偏黄, 鳞片紧密且具有生长快、肉质好、性腺败育以及抗性强等优点, 深受广大养殖户的喜爱。但是, 自芙蓉鲤鲫进行人工养殖以来其饲料配方仅参考鲫的饲料配方, 目前关于芙蓉鲤鲫幼鱼碳水化合物需求的研究还未见报道, 芙蓉鲤鲫幼鱼的碳水化合物需求量及需求特点的滞后对其健康养殖产生了不利影响。因此本实验通过配制不同玉米淀粉水平的饲料研究其对芙蓉鲤鲫幼鱼生长、体组成和生化的影响, 以确定芙蓉鲤鲫幼鱼饲料中适宜淀粉含量, 以期为配制合理的芙蓉鲤鲫饲料配方提供数据支撑。
1 材料与方法
1.1 实验设计和实验饲料
本实验以鱼粉和酪蛋白为主要蛋白源, 以玉米淀粉为碳水化合物来源, 以鱼油和豆油等比例混合为脂肪源, 设计了7组不同玉米淀粉水平的等氮等脂(蛋白为35%, 脂肪为8%)饲料。7组饲料的玉米淀粉水平为6%、12%、18%、24%、30%、36% 和42%, 饲料配方和基本组分见表 1。所有实验原料过20目筛, 充分混匀, 用单螺式膨化颗粒饲料机(SLP-45,中国上海渔业机械研究所)制作成直径为3 mm的颗粒, 75℃烘干, 保存在-20℃冰箱中备用。
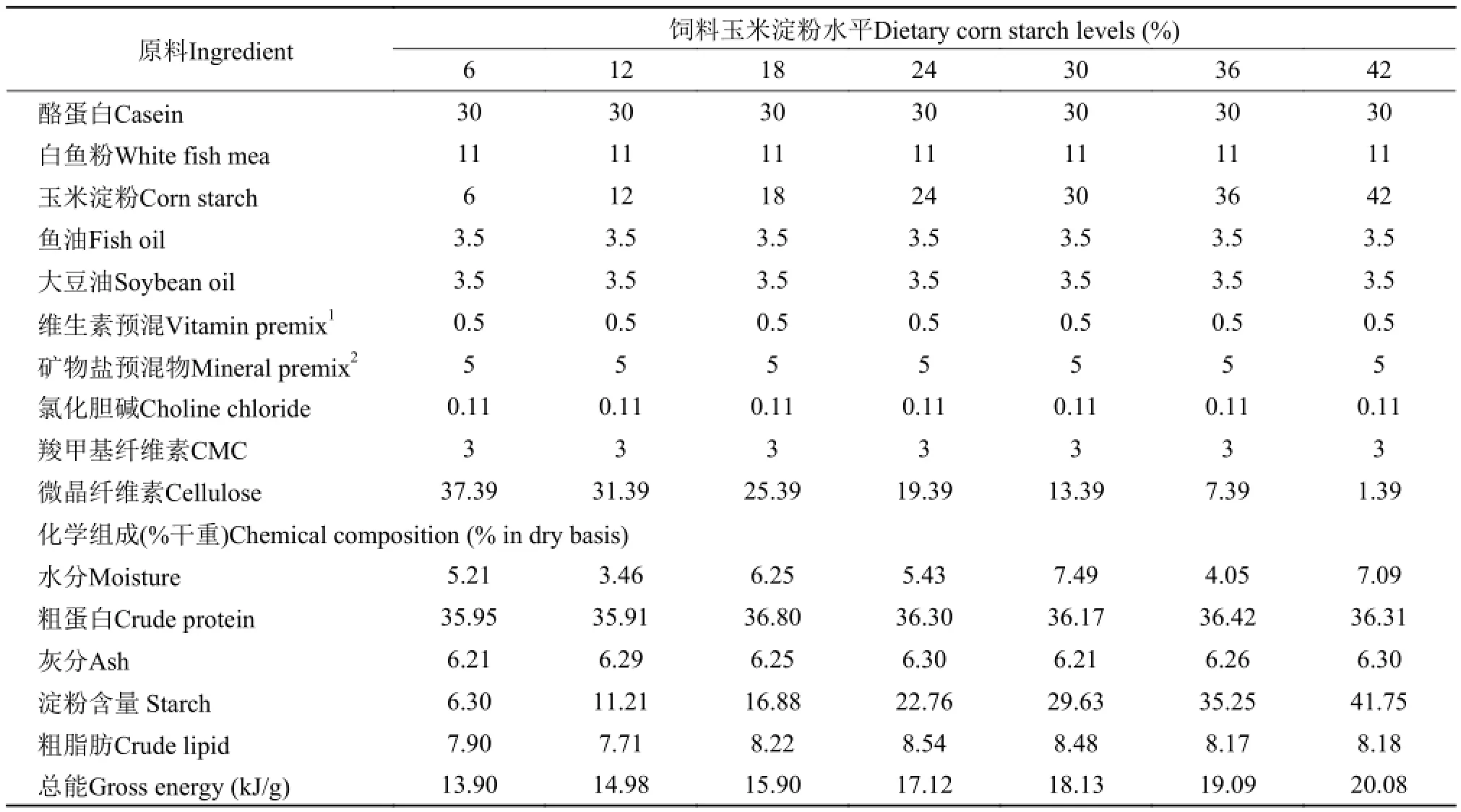
表 1 实验饲料配方和基本组分(干重)Tab. 1 Formulation and chemical composition of experimental diets (in dry basis)
1.2 实验鱼和饲养管理
本研究在湖北省石首市老河长江四大家鱼原种场进行。实验系统为室外池塘网箱(2 m×2 m× 2 m, 水深约2 m)养殖系统。实验期间水温(29.6± 1.3) ℃, 溶解氧大于5.0 mg/L, 氨氮低于0.5 mg/L, 亚硝酸盐小于0.01 mg/L, pH为8.2—8.4, 光照周期为自然光照, 池塘浮游动物见表 2, 浮游植物见表 3。
实验鱼来至湖南省水产科学研究所, 到达鱼场后在池塘网箱中暂养一个月, 使其适应池塘网箱环境以及达到实验鱼体规格。在实验开始前将实验鱼饥饿24h, 然后选择体格健壮、规格均匀的芙蓉鲤鲫幼鱼, 随机分入21个池塘网箱中, 每个网箱30尾, 尾平均体重(8.94±0.59) g。每种实验饲料随机投喂3个网箱。实验期间每天8:00和16:00进行表观饱食投喂。生长实验持续61d (2015年6月26日到2015年8月26日)。

表 2 养殖水体中浮游动物含量Tab. 2 Contents of zooplankton in aquaculture water

表 3 养殖水体中浮游植物含量Tab. 3 Contents of phyplankton in aquaculture water
1.3 实验取样
在实验开始前, 随机取3组芙蓉鲤鲫幼鱼各8尾,沥干称重后放于-20℃保存, 用于实验初始样本的基本组分分析。在养殖实验结束后, 实验鱼饥饿24h, 将每个网箱内全部实验鱼捞起沥干称重记录,然后随机选取2尾鱼称重并记录, 存放于-20℃保存,用于终末鱼体生化成分的分析。再随机取3尾鱼测定其体长、体重、肝脏重以及内脏重用于计算肥满度、肝体比和脏体比。收集3尾鱼的肝脏用于肝脏脂肪含量的测定, 并取其背肌于-20℃中保存, 用于测定背肌蛋白和脂肪含量。再随机取3尾鱼尾静脉抽血, 分别存于用肝素钠润洗的1.5 mL离心管中,室温静置1h后于4℃, 3500 r/min离心15min获取血浆样品, 将每个离心管中的血浆分装在6个200 μL的小离心管中, 经液氮速冻后-80℃保存备用, 用以分析血浆血糖、甘油三酯和胆固醇含量。抽完血后的实验鱼取肝脏、背肌和中肠, 放于冷冻管中经液氮速冻后-80℃保存备用, 用于肝糖原、肌糖原和肠道淀粉酶活性的测定。
1.4 样品分析
实验鱼初始样本、终末样本以及背肌用高压灭菌锅120℃加压处理20min, 捣碎后于75℃烘箱中烘干, 用粉碎机粉成粉末状用于基本组分测定。实验饲料、全鱼和背肌基本化学组成的分析测定都按照实验室标准方法(AOAC, 2002)进行。水分在105℃烘箱中烘3h至恒重, 灰分在550℃马弗炉中12h充分灼烧, 通过损失率计算。样品的粗蛋白含量经过消化炉420℃消化以后采用凯氏定氮法(N×6.25)使用全自动凯氏定氮仪(2300 Kjeltec Analyzer Unit, FOSS Tecator, Haganas, Sweden)测定。粗脂肪含量使用脂肪仪(Soxtec system HT6,FOSS Tecator, Haganas, Sweden)采用乙醚抽提的方法测定。总能使用能量测试仪(CALORIMETER,Parr instrument Company Moline, USA)测定。
淀粉含量采用北京博欧实德生物技术有限公司提供的爱尔兰Megazyme公司淀粉总量检测试剂盒测定。Megazyme公司研发的该试剂盒是使用耐热α-淀粉酶和淀粉葡糖苷酶的淀粉总量检测试剂盒, 该方法已被AOAC和AACC采用。实验原理: 淀粉在耐热α-淀粉酶的作用下水解为麦芽糊精, 淀粉糖苷酶可将麦芽糊精定量水解成D-葡萄糖, D-葡萄糖与空气接触被氧化成D-葡萄盐酸, 释放出H2O2,通过510 nm处测定H2O2在过氧化物酶作用下与对羟基苯甲酸和4-氨基安替比啉反应生成的醌亚胺染料的吸光度而确定样品中淀粉含量。具体操作步骤如下: (1)将饲料磨成可以通过0.5 mm筛网的粉末; (2)称取100 g左右的样品并准确记录, 加入到50 mL试管中; (3)加入0.2 mL的乙醇溶液(80% v/v),使样品润湿有助于分散, 用漩涡混合器混匀; (4)将试管冰浴, 再向每个试管中加入磁力搅拌棒和2 mL 2 mol/L的KOH, 用磁力搅拌机在冰浴状态下搅拌20min; (5)向每个试管中加入8 mL的1.2 mol/L醋酸钠缓冲液(pH 3.8), 并用磁力搅拌机搅拌。立即加入0.1 mL的耐热α-淀粉酶和0.1 mL的淀粉葡糖苷酶, 混匀, 再将试管置于50℃水浴锅中; (6)孵育试管30min, 并用漩涡混合器间歇性搅拌; (7)对于总淀粉含量<10%的样品, 用水洗瓶定量转移试管里的样品至100 mL容量瓶, 当用洗瓶洗涤试管中的溶液时用外磁铁保持试管中的磁力棒, 用蒸馏水定容至100 mL, 混匀, 离心单位体积溶液, 1800×g, 10min;(8)对于总淀粉含量>10%的样品, 直接离心,1800×g, 10min。对于这些样品, 试管里的总体积约为10.4 mL; (9)取两份离心后的单位体积样品上清溶液(0.1 mL)分别转移到5 mL离心管中(葡萄糖对照和试剂空白管分别为0.1 mL的葡萄糖标准溶液和0.1 mL的双蒸水); (10)取3.0 mL的过氧化物酶试剂加到每一试管中, 50℃水浴20min; (11)510 nm下测定每一个试管中样品的吸光度值。结果计算:
淀粉(%)=ΔA×(FV/0.1)×(1/1000)×(100/W)× (162/180)其中ΔA=相当于试剂空白读取的吸光度值, F为吸光光度值转换为葡萄糖(μg)的因子=100×(D-葡萄糖的重量)/100 μg D-葡萄糖的吸光光度值, FV为最终体积, 0.1为用于检测的样本体积, 1/1000为从μg到mg的转换, 100/W为一定重量干粉中淀粉含量以百分比表述的因子, 162/180为淀粉游离的D-葡萄糖转化为D-葡萄糖苷的因子。
淀粉干重(%)=上述淀粉(%)×{100/[(100-水含量(%)]}。
血浆胆固醇、甘油三酯以及血糖均采用上海名典生物工程有限公司所提供的试剂盒测定, 肝糖原、肌糖原和淀粉酶采用南京建成生物工程研究所提供的试剂盒测定。血浆胆固醇和甘油三酯分别采用胆固醇氧化酶法和甘油-3-磷酸氧化酶法测定, 血浆葡萄糖采用葡萄糖氧化酶法测定。糖原在浓硫酸的作用下可脱水生成糖醛衍生物, 后者再与蒽酮作用形成蓝色化合物, 与同法处理的标准葡萄糖溶液比色定量即可确定肝/肌糖原含量。淀粉酶采用碘-淀粉比色法测定, 淀粉酶能将淀粉水解成葡萄糖、麦芽糖以及糊精, 在底物浓度已知并且过量的情况下, 加入碘液与未水解的淀粉结合生成蓝色复合物, 根据蓝色的深浅可推算出水解的淀粉量,从而计算出淀粉酶活力, 匀浆液样品的蛋白浓度测定方法同Bradford(1976)的方法一致, 使用牛血清作为标准品。样品的蛋白质浓度表示为mg/mL, 酶活性表示为units/mg protein。
1.5 数据处理与统计分析
本实验测定指标及计算公式如下:
存活率(Survival rate, SR, %)=100×末尾数/初尾数
摄食率(Feeding rate, FR, %BW/d)=100×饲料摄入干物质量/[投喂天数×(初始体重+终末体重)/2]
增重率(Weight gain, WG, %)=100×(终末体重-初始体重)/初始体重
特定生长率(Specific growth rate, SGR, %/d)= 100×((ln终末体重-ln初始体重)/投喂天数)
蛋白沉积率(Protein retention efficiency, PRE,%)=100×(终末鱼体总蛋白-初始鱼体总蛋白)/蛋白总摄入量
脂肪沉积率(Lipid retention efficiency, LRE,%)=100×(终末鱼体总脂肪-初始鱼体总脂肪)/脂肪总摄入量
能量沉积率(Energy retention efficiency, EPE,%)=100×(终末鱼体总能量-初始鱼体总能量)/能量总摄入量
肥满度(Condition factor, CF, %)=100×体重/(体长)3
肝体指数(Hepatosomatic index, HSI, %)= 100×肝脏重/体重
脏体指数(Viscerasomatic index, VSI, %)= 100×内脏重/体重
实验数据采用Statistics 18.0软件进行统计分析。所有数据使用Shapiro-Wilk方法进行正态分布检测, 用Levene进行方差齐性检测。如果数据为正态分布并且方差齐性则用一元方差分析(One-wayANOVA)后, 进行Duncan法进行多重比较。P<0.05表示差异显著。数据表示为平均值±标准误(Standard error of the mean), 并根据特定生长率(SGR)和饲料淀粉水平的关系采用折线法(Broken-line analysis)的方法确定芙蓉鲤鲫幼鱼饲料适宜淀粉的含量。
2 结果
2.1 摄食、生长和饲料利用
高中历史教材的知识点众多,内容丰富,也是高中学生必学的一项重要科目。为了提高教学的实质性,更好地培养学生的历史能力,教师要在历史学科核心素养视角下开展有关的教学活动。笔者认为教师可以从以下几个方面入手:
饲料碳水化合物水平对芙蓉鲤鲫幼鱼摄食、生长和饲料利用的影响见表 4。经过8周的生长实验, 实验鱼在各处理组的存活率均在97%以上。摄食率随饲料玉米淀粉水平的增加而降低(P<0.05)。平均末重、增重率、特定生长率、饲料效率、能量沉积率均随饲料玉米淀粉水平的增加而增加(P<0.05), 但18%—42%玉米淀粉组之间差异不显著(P>0.05)。蛋白沉积率随饲料玉米淀粉水平的增加而增加(P<0.05), 30%—42%饲料玉米淀粉组之间差异不显著(P>0.05)。脂肪沉积率随饲料玉米淀粉水平的增加而上升(P<0.05), 24%—42%玉米淀粉组之间差异不显著。基于特定生长率(SGR)和饲料淀粉水平的折线法分析(图 1)表明, 芙蓉鲤鲫幼鱼达到最大生长时饲料淀粉水平为27.47%。
芙蓉鲤鲫幼鱼肥满度在36%饲料玉米淀粉处理组最低(P<0.05), 肝体比和脏体比均随饲料玉米淀粉水平的增加而上升, 且24%和42%处理组要显著高于6%、12%和18%处理组(P<0.05)。
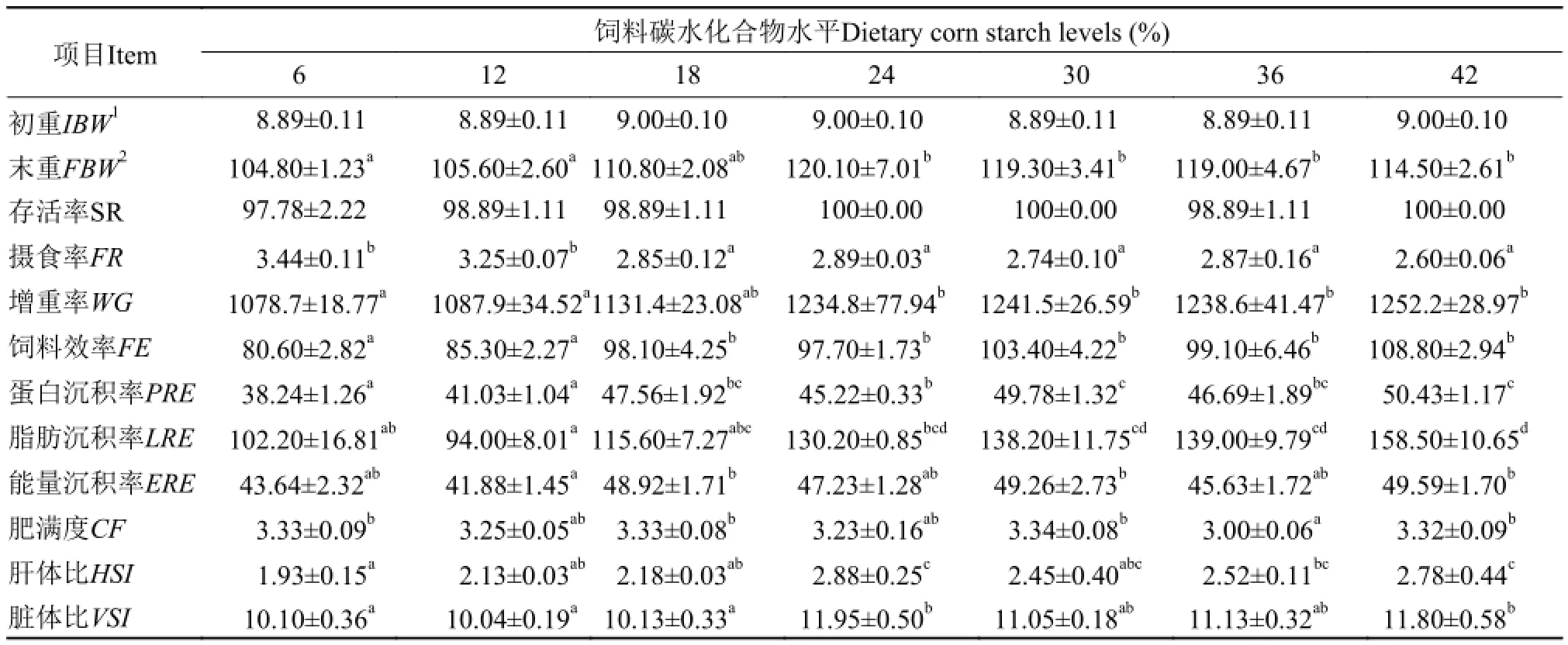
表 4 饲料玉米淀粉水平对芙蓉鲤鲫幼鱼摄食、生长和饲料利用的影响Tab. 4 Effects of dietary corn starch levels on feed intake, growth and feed utilization
2.2 鱼体和背肌基本组分
在实验结束后, 芙蓉鲤鲫鱼体水分随饲料玉米淀粉水平的增加而降低, 在12%处理组最高(P<0.05), 灰分没有受饲料玉米淀粉水平的影响(P>0.05), 粗蛋白在饲料玉米淀粉水平24%组最低(P<0.05)。随着饲料玉米淀粉水平的增加, 全鱼粗脂肪含量在上升(P<0.05)。背肌水分和粗蛋白含量随着饲料玉米淀粉水平的增加而降低(P<0.05), 粗脂肪含量随饲料玉米淀粉水平的增加而升高(P<0.05)(表 5)。
2.3 生理生化指标
表 6结果显示, 芙蓉鲤鲫血浆葡萄糖没有受饲料玉米淀粉水平的影响(P>0.05), 血浆甘油三酯随饲料玉米淀粉水平的增加而上升, 42%处理组显著高于6%处理(P<0.05), 血浆胆固醇随饲料玉米淀粉水平的增加先上升后下降, 在30%处理组最高(P<0.05)。
肠道淀粉酶活性随饲料玉米淀粉水平的增加而显著上升(P<0.05)。肝糖原随饲料玉米淀粉水平的增加而上升, 36%处理组显著高于6%和12%处理组(P<0.05)。肌糖原和肝糖原的变化趋势相似, 在36%处理组最高, 且显著高于6%—24%饲料玉米淀粉组(P<0.05)。
3 讨论
3.1 饲料不同碳水化合物水平对芙蓉鲤鲫幼鱼摄食、生长及饲料利用的影响
饲料中的碳水化合物不仅是鱼体维持正常生理生化过程和生长重要的营养素, 也是鱼体能量的重要来源。饲料碳水化合物水平过低或过高都会对鱼类的生长、饲料利用以及鱼体组成产生影响。

图 1 饲料淀粉水平对芙蓉鲤鲫幼鱼特定生长率的影响Fig. 1 Effect of specific growth rate (SGR) and dietary corn starch levels in juvenile Furong crucian carp

表 5 饲料玉米淀粉水平对芙蓉鲤鲫幼鱼鱼体和背肌基本组成的影响(%湿重)Tab. 5 Effects of dietary corn starch levels on whole body and white muscle composition of juvenile Furong crucian carp (% wet weight)
本研究得出芙蓉鲤鲫幼鱼最大生长的饲料淀粉水平为27.47%, 这和以前报道的鲤、鲫类的饲料碳水化合物适宜含量的研究结果相近。李向松[9]以玉米淀粉为碳水化合物来源, 得出异育银鲫(Carassius auratus gibelio)幼鱼(2.4 g)饲料中最适玉米淀粉添加水平为30.2%, 中规格异育银鲫(52±1) g和大规格异育银鲫(179±2) g饲料玉米淀粉的最适添加量分别为29.2%和27.2%; 何吉祥等[10]以玉米淀粉为碳水化合物来源, 得出异育银鲫幼鱼(2.85±0.09) g最适碳水化合物需求为27.65%—31.48%; 王芬[11]在饲料中高淀粉含量对异育银鲫生长、代谢及鱼体成分的影响的研究中发现异育银鲫(8.5 g)饲料中适宜的淀粉含量应低于32%; 蔡春芳等[12]用糊精含量分别为5%、25%和50%饲料饲养异育银鲫鱼种发现25%处理组生长最好; Sen等[13]以糊精为碳水化合物来源得出鲤(Cyprinus carpio)最适碳水化合物需求为26%; 鲤对碳水化合物的利用率较高,水产行业标准规定鲤饲料中可消化糖含量为30%—42%[14]。由此可以发现, 鲤鲫鱼类饲料中适宜碳水化合物含量在25%—32%, 受其品种、规格大小的影响较小。
本研究发现随饲料玉米淀粉水平的增加, 芙蓉鲤鲫的生长先上升, 然后进入平台期。这和杨俊江[15]对大规格斜带石斑鱼(Epinephelus coioides)碳水化合物水平研究结果相似, 高玉米淀粉水平饲料并未对芙蓉鲤鲫幼鱼的生长产生不利影响, 说明芙蓉鲤鲫幼鱼对玉米淀粉的耐受能力较强。一些研究表明鱼类利用碳水化合物的能力较畜禽类低, 在饲料中添加一定的碳水化合物能降低鱼类摄食率[16]。本研究发现随着饲料玉米淀粉水平的增加, 芙蓉鲤鲫幼鱼的摄食率降低, 这一结果与上述研究结果相一致。这一现象可能是和本实验为不等能设计有关, 因为一些鱼类能够在一定范围内有自发调节饲料能量的摄食, 即等能摄食机制[4, 17], 也可能与摄食率使用的体重相对值有关, 在最适饲料碳水化合物水平时, 鱼类由于生长较快, 相对摄食率可能出现数值的下降。
饲料效率可以反映鱼类摄入的饲料转化为鱼体增重的情况, 随着饲料碳水化合物水平的增加饲料效率升高, 说明高碳水化合物水平饲料的利用效果较好。在本实验中, 芙蓉鲤鲫幼鱼的饲料效率随饲料玉米淀粉水平的增加先升高, 然后进入平台期,说明饲料中适量的添加玉米淀粉能够提高芙蓉鲤鲫幼鱼的饲料效率。高玉米淀粉的添加虽然不能提高饲料效率, 但可以提高饲料蛋白沉积率和能量沉积率, 说明提高饲料玉米淀粉含量可以提高蛋白和能量的利用效率, 降低了蛋白作为能量的消耗。鱼体的蛋白沉积率随饲料玉米淀粉水平的增加而增加, 这在Sinngh等[18]对鲮(Cirrhinus mrigala)以及Mohanta等[19]对印度须鲃(Puntius gonionotus)的研究中也有报道, 说明饲料中添加适宜的玉米淀粉能够节省饲料中的蛋白质[20—22], 降低饲料成本。鱼体的脂肪沉积率随饲料玉米淀粉水平的增加而上升,说明饲料中过多的玉米淀粉转化成脂肪而在鱼体沉积。
3.2 饲料不同碳水化合物水平对芙蓉鲤鲫幼鱼形体指标的影响
形态学特征能不同程度的反映鱼类的营养状况, 这些指标因其直观、测量方便而被广泛采用。肝体比、脏体比和肥满度被看作是鱼类对长期和短期营养方式很敏感的形态学指标, 同时肝脏也是鱼体各器官中碳水化合物代谢的主要场所。本研究实验结束后, 饲料玉米淀粉水平对芙蓉鲤鲫幼鱼的形体指标产生了显著影响, 肝体比和脏体比均随饲料玉米淀粉水平的增加而上升, 付世建等[23]在南方鲇(Silurus meriordinalis Chen)中发现, 肝体指数受饲料淀粉水平的显著影响, 并且与肝糖含量正相关, 本研究也发现类似现象, 表明肝体指数的变化可能与肝糖及肝脂变化有关。
3.3 饲料不同碳水化合物水平对芙蓉鲤鲫幼鱼体成分的影响
在本研究实验结束后, 芙蓉鲤鲫幼鱼全鱼的水分随饲料玉米淀粉水平的增加而降低, 全鱼灰分含量没有受饲料玉米淀粉水平的影响, 随着饲料玉米淀粉水平的增加, 全鱼粗蛋白先升高后降低, 全鱼粗脂肪在升高, 与Keshavaanth等[24]在评估高碳水化合物饲料对鲤全鱼脂肪的影响得出的结果相一致, 表明饲料中的玉米淀粉一定程度上可以转化为鱼体脂肪。在本研究中芙蓉鲤鲫血浆甘油三酯含量提高也反映了脂肪生成的增加。芙蓉鲤鲫背肌水分和粗蛋白随饲料玉米淀粉水平的增加而降低, 背肌脂肪含量随饲料玉米淀粉水平的增加而上升, 脂肪含量的增加可能是饲喂高玉米淀粉水平饲料时鱼类肝脏和肝脏组织里的脂肪酶活性受到激活[11, 25],其机理需要进一步研究。但是也有研究发现饲料碳水化合物水平并不会对鱼体的水分、灰分以及粗蛋白产生显著影响[26, 27], 这可能和鱼的品种、规格、养殖环境、投喂频率以及饲料配方等不同有关。
3.4 饲料不同碳水化合物水平对芙蓉鲤鲫幼鱼血液学的影响
鱼类血液生化指标的变化往往可以反映营养素在机体内的代谢过程。胆固醇和甘油三酯是血脂的重要组成部分, 两者的变化可以反映脂肪在体内的部分代谢情况。在本实验中, 芙蓉鲤鲫幼鱼血浆甘油三酯随着饲料玉米淀粉水平的增加而升高,这可能是饲料中多余的玉米淀粉转化为脂肪后进行分解代谢而造成的。一般研究中发现, 鱼类摄食糖类后体内糖原和脂肪合成代谢加强, 血浆甘油三酯下降, 肝体比升高[28, 29]。而Peres等[30]在研究金头鲷(Sparus aurata)对糖的耐受时发现, 金头鲷摄食高碳水化合物饲料后甘油三酯上升, 肝体比在摄食后1h时下降, 然后肝体比上升。这可能是不同鱼类通过不同的代谢方式来调节体内血糖水平, 而芙蓉鲤鲫主要是依靠增强分解代谢的方式来降低血糖。鱼类能够自身合成胆固醇, 血液中的胆固醇绝大部分来自肝脏, 如果肝脏发生病变, 则血液中胆固醇会迅速上升。本实验血浆胆固醇随饲料玉米淀粉水平的增加先上升后降低, 说明高玉米淀粉饲料可能对芙蓉鲤鲫幼鱼的肝脏造成损害, 这一结论还需进一步验证。血液葡萄糖主要来自食物消化吸收后的葡萄糖、肝糖原以及糖异生作用[31], 本实验中血糖没有受饲料玉米淀粉水平的影响, 这可能和24h后取样以及上述的分解代谢有关。
3.5 饲料不同碳水化合物水平对芙蓉鲤鲫幼鱼组织酶学活力的影响
本实验测定了芙蓉鲤鲫中肠淀粉酶活性, 结果显示肠道淀粉酶活性随着饲料玉米淀粉水平的增加显著上升, 说明饲料中的淀粉对淀粉酶的分泌和活性有一定的刺激作用, 这与上述李向松在研究异育银鲫对碳水化合物利用中得出的中规格异育银鲫肠道淀粉酶活性随饲料碳水化合物水平的增加而上升的结果相似, 但其还得出小规格和大规格异育银鲫肠道淀粉酶活性随饲料碳水化合物水平的增加先上升后下降[8], 这可能和鱼的种类、规格及饲料配方等不同有关。饲料中的碳水化合物进入鱼体后经过消化道消化后分解成葡萄糖而被鱼体利用, 一部分作为能量而被消耗, 另一部分转化成糖原储存在肝脏或肌肉中。本实验中肌糖原随饲料玉米淀粉水平的增而上升, 肝糖原表现出相同的趋势, 刘襄河等[32]在研究饲料糊精水平对暗纹东方鲀(Takifugu obscurus)幼鱼生长影响中得出相似的结果, 说明饲料中多余的玉米淀粉可转化为糖原储存于肝脏和肌肉中。
4 小结
在以玉米淀粉为碳水化合物来源, 饲料蛋白水平为35.91%—36.80%, 脂肪水平为7.71%—8.54%,能量为13.90—20.08 kJ/g, 水温为(29.6±1.3) ℃的实验条件下, 实验结果表明: (1)饲料中过多的玉米淀粉会转化成脂肪而在鱼体沉积; (2)饲料中适宜的增加玉米淀粉含量可以起到节约蛋白的作用; (3)通过特定生长率(SGR)和饲料淀粉水平的折线法分析表明, 芙蓉鲤鲫幼鱼(8.94±0.59) g达到最大生长的饲料淀粉水平为27.47%。
致谢:
感谢安徽大学资源与环境工程学院周立志教授在文章修改中给出的宝贵意见。
[1]Mohanta K N, Mohanty S N, Jena J K. Protein-sparing effect of carbohydrate in silver barb, Puntius gonionotus fry [J]. Aquaculture Nutrition, 2007, 13(4): 311—317
[2]Arif J Z H, Umar K. Protein sparing effect and the efficiency of different compositions of carbohydrates, lipids and proteins on the growth of Rohu (Labeo rohita) fingerlings [J]. World Journal of Fish and Marine Sciences,2013, 5(3): 244—250
[3]Luo Y P, Xie X J. Progress of carbohydrate utilization in fish [J]. Journal of Fishery Sciences of China, 2010,17(2): 381—390 [罗毅平, 谢小军. 鱼类利用碳水化合物的研究进展. 中国水产科学, 2010, 17(2): 381—390]
[4]Jiang L H, Wu H Y, Huang K, et al. Effects of dietary carbohydrate levels on growth performance and liver metabolism functions of juvenile tilapia (Oreochromis niloticus) [J]. Journal of Fisheries of China, 2013, 37(2):245—255 [蒋利和, 吴宏玉, 黄凯, 等. 饲料糖水平对吉富罗非鱼幼鱼生长和肝代谢功能的影响. 水产学报,2013, 37(2): 245—255]
[5]Li T T, Zhang A H. Research progress of carbohydrate utilization in grass carp [J]. Aquatic Nutrition and Feed Science and Technology, 2015, (1): 22—25 [李婷婷, 张爱华. 草鱼对碳水化合物利用研究进展. 水产营养与饲料科技, 2015, (1): 22—25]
[6]Tian L X, Liu Y J, Liu D H, et al. Effects of glucose and corn starch on growth and the fat deposition in the mesentery of grass carp [J]. Journal of Fisheries of China, 2000,24(5): 438—441 [田丽霞, 刘永坚, 刘栋辉, 等. 葡萄糖和玉米淀粉对草鱼生长和肠系膜脂肪沉积的影响. 水产学报, 2000, 24(5): 438—441]
[7]Nakano K, Tagawa M, Takemura A, et al. Temporal changes in liver carbohydrate metabolism associated with seawater transfer in Oreochromis mossambicus [J]. Comparative Biochemistry and Physiology, 1998, 119(4):721—728
[8]Cao S P, Han D, Xie S Q, et al. Effects of dietary fishmeal replacement with Spirulina platensis powder on the growth performance, feed utilization and protein deposition in juvenile gibel carp (Carassis auratus gibelio var. CAS Ⅲ) [J]. Acta Hydrobiologica Sinica, 2016, 40(4):647-654 [曹申平, 韩冬, 解绶启, 等. 螺旋藻粉替代饲料中鱼粉对异育银鲫幼鱼生长、饲料利用和蛋白沉积的影响. 水生生物学报, 2016, 40(4): 647-654]
[9]Li X S. Dietary carbohydrate utilization in grass carp (Ctenopharynodon idellus), gibel carp (Carassius auratus gibelio var. CAS Ⅲ) and black carp (Mylopharyngodon piceus) [D]. Thesis for Doctor of Science. Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan. 2014[李向松. 草鱼. 异育银鲫和青鱼对饲料中碳水化合物利用的研究。 博士学位论文, 重工科学院水生生物研究所, 武汉. 2014]
[10]He J X, Cui K, Xu X Y, et al. Optimal dietary requirements of protein, lipid and carbohydrate for juvenile gibel carp (Carassius auratus gibelio) [J]. Journal of Anhui Agricultural University, 2014, 41(1): 30—37 [何吉祥, 崔凯, 徐晓英, 等. 异育银鲫幼鱼对蛋白质、脂肪及碳水化合物需求量的研究. 安徽农业大学学报, 2014, 41(1):30—37]
[11]Wang F. Effect of high levels of dietary starch on growth,metabolism and body composition for omnivorous gibel carp (Carassius auratus gibelio) [D]. Thesis for Master of Science. Huazhong Agriculture University,Wuhan. 2008 [王芬. 饲料中高淀粉含量对异育银鲫生长、代谢及鱼体成分的影响. 硕士学位论文, 华中农业大学, 武汉. 2008]
[12]Cai C F, Wang D Z, Huang W, et al. Utilization of carbohydrate in allogynogenetio crucian carp -effect of carbohydrate content on the growth, digestibility and body composition [J]. Journal of Suzhou University (Natural Science), 1999, 15(3): 87—90 [蔡春芳, 王道尊, 黄卫,等. 异育银鲫对糖利用性的研究-饲料糖含量对生长、消化吸收率及体成分的影响. 苏州大学学报:自然科学版, 1999, 15(3): 87—90]
[13]Sen P R, Rao N G S, Ghosh S R, et al. Observations on the protein and carbohydrate requirements of carps [J]. Aquaculture, 1978, 13(3): 245—255
[14]Lai M Y. Nutritional requirements and feed preparation of common carp [J]. Inland Fisheries, 2004, 29(7): 29—30[赖铭勇. 鲤鱼的营养需要与饲料配制. 内陆水产, 2004,29(7): 29—30]
[15]Yang J J. The Requirement of protein, lipid and carbohydrate for grouper (Epinephelus coioides) at three growth stages [D]. Thesis for Master of Science. Ocean University of China, Zhanjiang. 2013 [杨俊江. 三个生长阶段斜带石斑鱼蛋白质、脂肪和碳水化合物需要量研究. 硕士学位论文, 广东海洋大学, 湛江. 2013]
[16]Fu S J, Xie X J. Effect of dietary carbohydrate levels on growth performance in Silurus meridionalis Chen [J]. Acta Hydrobiologica Sinica, 2005, 29(4): 393—398 [付世建, 谢小军. 饲料碳水化合物水平对南方鲇生长的影响. 水生生物学报, 2005, 29(4): 393—398]
[17]Liu Y L, Mai K S, Xu W, et al. Effects of dietary starch on biochemical indexes of the serum of cobia (Rachycentron canadum) [J]. Acta Hydrobiologica Sinica, 2015,39(1): 46—51 [刘迎隆, 麦康森, 徐玮, 等. 摄食不同淀粉含量饲料对军曹鱼血清生化指标的影响. 水生生物学报, 2015, 39(1): 46—51]
[18]Singh R K, Balange A K, Ghughuskar M M. Protein sparing effect of carbohydrates in the diet of Cirrhinus mrigala (Hamilton, 1822) fry [J]. Aquaculture, 2006,258(1—4): 680—684
[19]Mohanta K N, Mohanty S N, Jena J, et al. Carbohydrate level in the diet of silver barb, Puntius gonionotus (Bleeker) fingerlings: effect on growth, nutrient utilization and whole body composition [J]. Aquaculture Research, 2009, 40(8): 927—937
[20]Grisdale H B, Shearer K D, Gatlin D M, et al. Effects of dietary protein and lipid levels on growth, protein digestibility, feed utilization and body composition of Atlantic cod (Gadus morhua) [J]. Aquaculture, 2008,283(1/4): 156—162
[21]Gao W, Liu Y J, Tian L X, et al. Effect of dietary carbohydrate to lipid ratios on growth performance, body composition, nutrient utilization and hepatic enzymes activities of herbivorous grass carp (Ctenopharyngodon idella)[J]. Aquaculture Nutrition, 2010, 16(3): 327—333
[22]Singh R K, Balange A K, Ghughuskar M M. Protein sparing effect of carbohydrates in the diet of Cirrhinus mrigala (Hamilton, 1822) fry [J]. Aquaculture, 2006,258(1—4): 680—684
[23]Fu S J, Xie X J, Yuan L Q. Effect of dietary starch level on postprandial change of HSI in southern catfish juvenile [J]. Journal of Southwest China Normal University (Natural Science), 2005, 30(3): 548—551 [付世建, 谢小军, 袁伦强. 饲料淀粉水平对南方鲇幼鱼摄食后肝指数的影响. 西南师范大学学报(自然版), 2005, 30(3):548—551]
[24]Keshavaanth P, Manjappa P, Gangadhara K. Evaluation of carbohydrate rich diets through common carp culture in manured tanks [J]. Aquaculture Nutrition, 2002, 8(3):169—174
[25]Rollin X, Médale F, Gutieres S, et al. Short and long-term nutritional modulation of acetyl-CoA carboxylase activity in selected tissues of rainbow trout (Oncorhynchus mykiss) [J]. British Journal of Nutrition, 2003, 89(6):803—810
[26]Ali M Z, Jauncey K. Optimal dietary carbohydrate to lipid ratio in African catfish Clarias gariepinus (Burchell 1822) [J]. Aquaculture, 2004, 12(2): 169—180
[27]Lee S M, Lee J H. Effect of dietary glucose, dextrin and starch on growth and body composition of juvenile starry flounder Platichthys stellatus [J]. Fisheries Science, 2004,70(1): 53—58
[28]Hemre G I, Hansen T. Utilization of different dietary starch sources and tolerance to glucose loading in Atlantic salmon (Salmo salar), during Parr-Smolt Transformation [J]. Aquaculture, 1998, 161(1—4): 145—157
[29]Deng D F, Refstie S, Hung S S O. Glycemic and glycosuric responses in white sturgeon (Acipenser transmontnus) after oral administration of simple and complex carbohydrates [J]. Aquaculture, 2001, 199(1—2): 107—117
[30]Peres H, Goncalves P, Oliva-Teres A. Glucose tolerance in Gilthead seabream (Sparus aurata) and European seabass (Dicentrarchus labrax) [J]. Aquaculture, 1999,179(1—4): 415—423
[31]Mommsen T P, Vijayan M M, Moon T W. Cortisol in teleosts: dynamics, mechanisms of action, and metabolic regulation [J]. Reviews in Fish Biology and Fisheries,1999, 9(3): 211—268
[32]Liu X H, Ye C X, Zheng L M, et al. Effect of dietary dextrin levels on growth, activity of digestive enzyme and blood biochemical indices of juvenile obscure puffer (Takifugu obscurus) [J]. Journal of Fisheries of China,2013, 37(9): 1359—1368 [刘襄河, 叶超霞, 郑丽勉, 等.饲料糊精水平对暗纹东方鲀幼鱼生长、消化酶活性和血液生化指标的影响. 水产学报, 2013, 37(9):1359—1368]
OPTIMAL DIETARY STARCH LEVEL FOR JUVENILE FURONG CRUCIAN CARP
CHEN Lin1, 2, ZHU Xiao-Ming2, HAN Dong2, YANG Yun-Xia2, JIN Jun-Yan2, LIU Hao-Kun2and XIE Shou-Qi2
(1. School of Resources and Environmental Engineering, Anhui University, Hefei 230601, China; 2. State Key Laboratory for Freshwater Ecology and Biotechnology, Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, China)
To investigate the optimal dietary starch level for juvenile Furong crucian carp, fish meal and casein and the mixture of fish oil and soybean oil (11) were used as dietary protein and lipid source to formulate seven isonitrogenous (35%) and isolipid (8%) experimental diets containing different corn starch levels (6%, 12%, 18%, 24%, 30%,36% and 42%) for a 61-day trial. The results showed that weight gain, specific growth rate and feed efficiency increased first and then tended to be stable with increased dietary corn starch (P<0.05), and that there were no significant differences between groups fed with 18%—42% dietary corn starch (P>0.05). Protein retention efficiency enhanced with increased dietary corn starch (P<0.05) and fish fed with 30% and 42% dietary corn starch had higher protein retention efficiency than those fed with 6% and 12% dietary corn starch (P<0.05). Plasma glucose concentration had no difference between groups (P>0.05). Plasma triglyceride concentration increased with higher dietary corn starch (P<0.05). Plasma total cholesterol concentration was significantly higher in 30% dietary corn starch group than other groups (P<0.05). Intestine amylase activity and muscle glycogen significantly increased with elevated dietary corn starch level (P<0.05). He- patic glycogen was significantly higher in the 36% corn starch group than others (P<0.05). Broken-line analysis based on specific growth rate (SGR) indicated that the optimal dietary starch level was about 27.47% for juvenile Furong crucian carp.
Furong crucian carp; Optimal dietary starch level; Feed utilization
S965.1
A
1000-3207(2016)04-0690-10
10.7541/2016.92
2016-01-27;
2016-03-12
现代农业产业技术体系-大宗淡水鱼类产业技术体系-鲫鱼营养与饲料岗位(CARS-46-19)资助 [Supported by Modern Agro-industry Technology Research System (CARS-46-19)]
陈林(1989—), 女, 安徽六安人; 硕士研究生; 研究方向为鱼类生理生态学。E-mail: 925781404@qq.com
解绶启(1969—), 男, 研究员; E-mail: sqxie@ihb.ac.cn
