山西老陈醋类黑精的分离及其抑菌活性
2016-08-10郭李云杨小兰山西大学生命科学学院山西太原030006
郭李云,杨小兰*(山西大学生命科学学院,山西 太原 030006)
山西老陈醋类黑精的分离及其抑菌活性
郭李云,杨小兰*
(山西大学生命科学学院,山西 太原 030006)
摘 要:为探究老陈醋类黑精的抑菌作用,采用超滤和尺寸排阻色谱法将山西老陈醋冻干粉(Shanxi aged vinegar extract,SAVE)分离成不同分子质量的水提物和类黑精部分,采用NaCl解离法将醋类黑精解离为类黑精骨架和小分子复合物两部分,用比浊法测定各组分对大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌的抑菌活性。结果表明:SAVE中的类黑精具有显著的抑菌活力(P<0.05),类黑精对SAVE的抑菌性发挥了主要作用;类黑精中分子质量在3~5 kD的组分抑菌活力最强,其对3 种受试菌的最低抑菌浓度(minimal inhibitory concentration,MIC)均为5 mg/mL;类黑精组成中的小分子复合物比类黑精骨架部分具有更强的抑菌活性。
关键词:山西老陈醋;类黑精;抑菌活性;分离
引文格式:
郭李云, 杨小兰.山西老陈醋类黑精的分离及其抑菌活性[J].食品科学, 2016, 37(13): 25-30.DOI:10.7506/spkx1002-6630-201613005. http://www.spkx.net.cn
GUO Liyun, YANG Xiaolan.Separation of melanoidin from Shanxi aged vinegar and its antibacterial activity[J].Food Science,2016, 37(13): 25-30.(in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201613005. http://www.spkx.net.cn
山西老陈醋历史悠久,为中国四大名醋之一,是人们喜爱的重要调味品。山西老陈醋由于其独特的熏醅工艺,使老陈醋富含有美拉德反应产物——类黑精。类黑精是一种结构复杂的褐色高分子质量聚合物[1]。已有研究证实,类黑精对多种细菌如幽门螺旋杆菌、齿斑葡聚糖链球菌、金黄色葡萄球菌以及芽孢杆菌等都具有显著的抑菌作用[2-3],来自食品如咖啡、啤酒、酱油和蜂蜜[4-6]中的类黑精也具有抑菌活性,然而关于老陈醋类黑精的抑菌作用目前还尚未见报道。众所周知,食醋具有杀菌抑菌的作用[7-9],而其中的类黑精是否为食醋的抑菌作用做出了贡献,还不得而知。因此,本研究对山西老陈醋冻干粉中的类黑精进行了分离纯化,并探究了类黑精及其不同组分的抑菌活性,旨在为揭示山西老陈醋的抑菌机理及其开发利用提供科学的理论依据。
1 材料与方法
1.1 材料与试剂
山西老陈醋醋醅(以高粱为原料,采用液态浓醪酒精发酵-固态醋酸发酵工艺,再经传统炭火熏醅工艺制成的醋醅)由山西紫林醋业公司提供。
牛血清白蛋白(分子质量66 kD)、鸡卵清蛋白(分子质量43 kD)、蓝色葡聚糖2000(分子质量2 000 kD)、VB12(分子质量1.36 kD) 美国Sigma公司;交联葡聚糖G-75 美国法玛西亚公司;氯化钠、浓硫酸、苯酚均为分析纯 国药集团(上海)化学试剂有限公司。
1.2 菌种与培养基
大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)、枯草芽孢杆菌(Bacillus subtilis),均为山西大学微生物实验室提供。
营养肉汤培养基(g/L):蛋白胨10、牛肉膏3、NaCl 5,蒸馏水定容至1 L,pH 7.2~7.4,121 ℃高压灭菌20 min。
1.3 仪器与设备
KQ-200KDE超声波洗涤器 昆山市超声仪器有限公司;UV-2800AH型紫外-可见分光光度计 尤尼柯(上海)仪器有限公司;RE-52旋转真空蒸发器 上海亚荣生化仪器厂;RO-NF-UF-4010超滤装置 上海摩速科学仪器有限公司;SCIENTZ-10N冷冻干燥机 宁波新芝生物科技股份有限公司;HD-5型电脑紫外检测仪上海泸西分析仪器有限公司。
1.4 方法
1.4.1 样品的制备
1.4.1.1 老陈醋冻干粉的制备及超滤分离
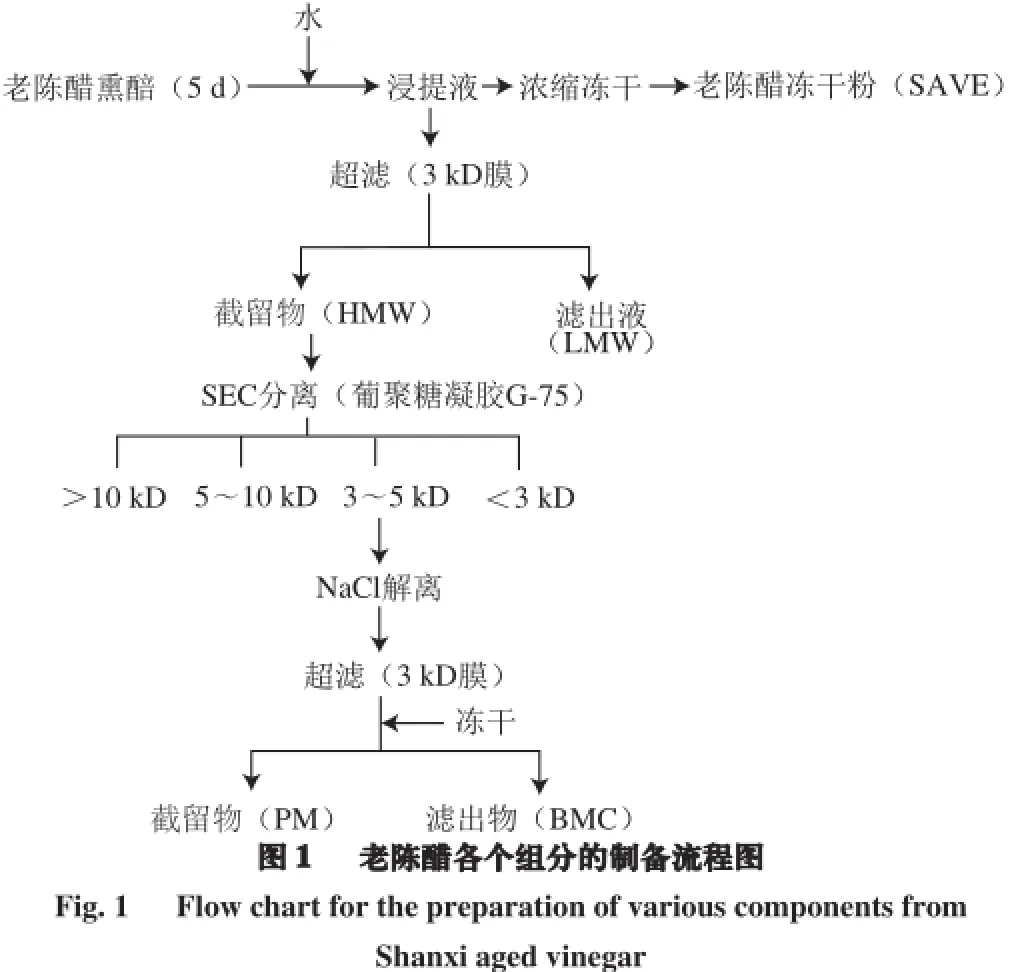
老陈醋冻干粉的制备流程如图1所示。用80 ℃热水,料液比1∶10(m/V)对老陈醋进行熏醅(经传统工艺熏制5 d)浸提,重复2 次,将所有浸提液合并得到醋醅水提液。部分水提液经过滤除渣、浓缩、冻干,得到山西老陈醋冻干粉(Shanxi aged vinegar extract,SAVE)。另一部分水提液经3 kD超滤膜分离,分子质量大于3 kD的截留液经冻干,得到老陈醋高分子质量部分(high molecular weight,HMW),分子质量小于3 kD的滤出液经冻干,得到老陈醋低分子质量部分(low molecular weight,LMW)。
1.4.1.2 醋类黑精的分离纯化
采用尺寸排阻色谱法(size exclusive chromatography,SEC)对老陈醋类黑精进行分离纯化,如图1所示。将老陈醋的高分子质量部分通过葡聚糖凝胶G-75柱(1.6 cm×50 cm)进行分离纯化,洗脱液为蒸馏水,流速为0.5 mL/min,在280 nm波长处连续检测吸光度(A280 nm),表示蛋白质含量[10],并收集洗脱液,每3 mL收集一管,用苯酚-硫酸比色法[11]测定其总糖含量,以490 nm波长处的吸光度(A490 nm)表示。同时,测定该馏分在420 nm波长处的吸光度(A420 nm),表示其褐变指数[12-13]。层析柱床的外水体积(V0)和总体积(Vt)分别用蓝色葡聚糖2000(2 000 kD)和VB12(1.36 kD)测定。按照洗脱顺序将洗脱液依据分子质量大小合并为4 个部分,分别为M>10、M5~10、M3~5和M<3,经浓缩冻干后用于抑菌实验。分子质量是根据标准蛋白质的lgM-Ve曲线公式计算得出,标准蛋白质的lgM-Ve曲线公式是由标准蛋白质的分子质量对数(lgM)与其洗脱体积(Ve)的关系得到的。蛋白质分子质量的标准品为:牛血清白蛋白(66 kD)、鸡卵清蛋白(43 kD)、凝乳蛋白酶A (25 kD)和细胞色素c(12.4 kD)。
1.4.1.3 类黑精的解离
参考Rufián-Henares[14]的方法,用NaCl将3~5 kD类黑精解离为类黑精骨架和小分子复合物两部分,具体操作如图1所示。将适量M3~5溶于2 mol/L的NaCl溶液中,在室温下放置过夜(12 h),之后使用3 kD的超滤离心管进行分离,得到的截留物(分子质量>3 kD)经浓缩冻干后,为类黑精骨架(纯类黑精(pure melanoidins,PM));得到的滤出液(分子质量<3 kD)经浓缩冻干后,为类黑精中被解离下的小分子复合物(bound melanoidin compounds,BMC)。
1.4.2 抑菌实验
1.4.2.1 菌悬液的制备
将斜面保藏的大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌经过营养肉汤培养基活化培养后,分别用无菌生理盐水制备成浓度为108CFU/mL的菌悬液备用。
1.4.2.2 老陈醋不同组分对大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌的抑菌作用
抑菌率采用比浊法[15]测定。将制备好的受试样品(老陈醋不同组分SAVE、HMW、LMW、M3~5、M5~10、M>10、PM、BMC)以一定的浓度分别添加在100 mL营养肉汤培养基中,121 ℃灭菌20 min,冷却后在超净工作台上无菌操作分别接入 0.1 mL的受试菌液,37 ℃培养24 h,在特定时间取样,用可见分光光度计测定600 nm波长处的吸光度(A600 nm),按下式计算抑菌率。
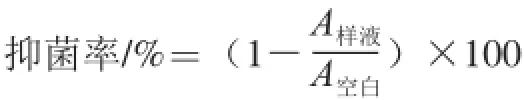
式中:A样液为含有类黑精的细菌培养液的吸光度;A空白为不含有类黑精的细菌培养液吸光度。
1.5 数据统计分析
每个样品重复测定3 次,结果取平均值。用Microsoft Office 2007的Excel软件进行平均数和标准偏差的计算,再用SPSS Statistics17.0软件对数据进行差异显著性分析,取95%置信度(P<0.05)。
2 结果与分析
2.1 SAVE的抑菌作用
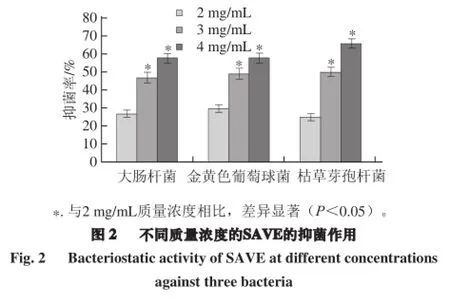
老陈醋的抑菌性已被研究证实,通常认为是其中的醋酸起了主要作用[7-9]。醋酸是一种挥发性的酸,经测定SAVE中的醋酸含量已甚微(0.6%)。但是,SAVE对大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌仍显示了显著的抑菌作用(图2),在2~4 mg/mL质量浓度范围内,随着SAVE质量浓度的增加,抑菌作用显著增大,呈现了剂量依赖效应。在4 mg/mL时,对大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌的抑菌率分别达到58%、58%和66%。先前的研究已证实,类黑精具有显著的抑菌活性[16-17],本研究制备的SAVE呈现深褐色,表明其中可能含有大量的类黑精。因此,采用SEC法对SAVE进行类黑精的分离纯化,以便进一步研究其抑菌性。
2.2 SAVE中类黑精的分离纯化
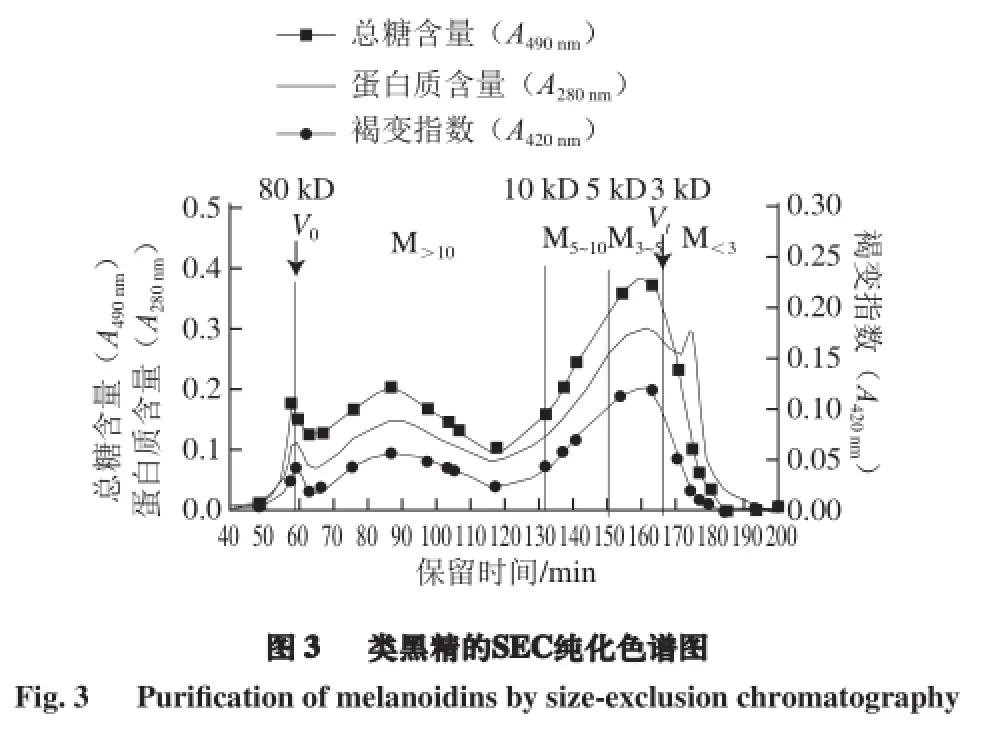
由于类黑精结构的不确切性,导致类黑精不能被直接分析。目前类黑精的分离制备是利用了类黑精高分子质量的特点,常用超滤的方法分离得到[1]。但是,许多研究把超滤得到的高分子质量物质(分子质量大于3 kD)简单定义为类黑精[18-21],而没有对其进行纯化[22-23]。本研究对超滤得到的醋HMW物质用SEC方法进行第二次纯化,结果见图3。SEC图谱显示,大部分HMW的分子质量低于80 kD,小部分物质被洗脱在外水体积(V0)。收集的馏分(3 mL/管)合并为4 个部分,根据分子质量标准曲线(lgM = -0.028 8Ve+5.940 2,R2= 0.999 6)算得其分子质量分别为M>10(分子质量>10 kD)、M5~10(分子质量在5~10 kD)、M3~5(分子质量在3~5 kD)和M<3(分子质量<3 kD)。显然,M<3是残留在HMW中的小分子质量物质。依据类黑精被定义为氨基类化合物(蛋白质和氨基酸等)和羰基类化合物(还原糖等)之间发生美拉德反应最终形成的高分子质量褐色聚合物[24-26],其相对含量可通过测定420 nm(褐色强度的波长)波长处的吸光度来进行评估[24]。所以对SEC分离后收集的馏分测定了其总糖含量(A490 nm)、蛋白质含量(A280 nm)和褐变指数(A420 nm),由图3可知,M3~5、M5~10、M>10这3 个部分的总糖和蛋白质洗脱轮廓几乎完全匹配了褐变指数,M<3部分则可能含有更多未参加美拉德反应的游离小分子蛋白物质,因此M3~5、M5~10、M>10这3 个部分可视为纯度较高的类黑精。所以SAVE中分子质量>3 kD的物质可视为类黑精复合物。
2.3 类黑精抑菌活性的研究
2.3.1 山西老陈醋类黑精的抑菌活性
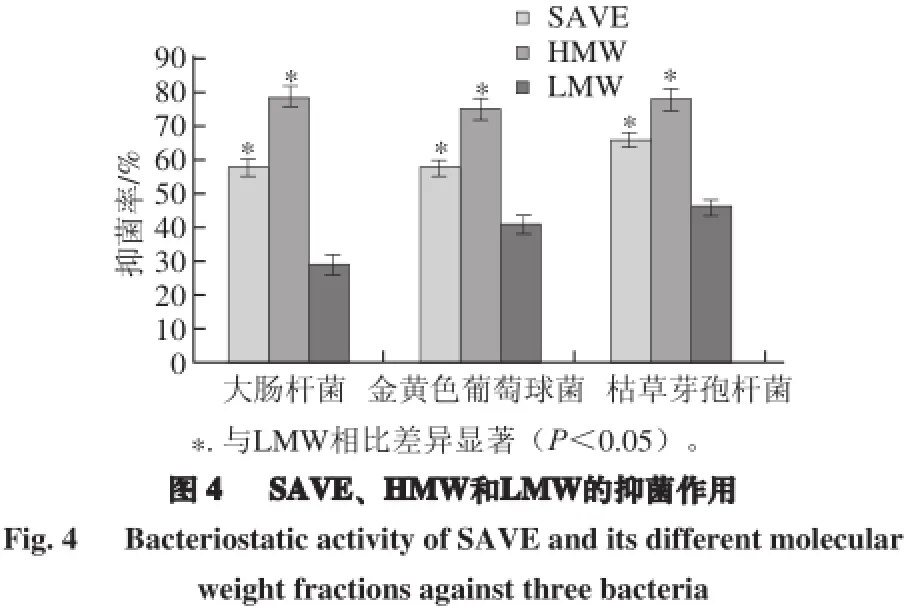
为了评价SAVE中类黑精的抑菌作用,采用超滤法将SAVE分离为HMW和LMW两个部分,比较了它们对3 种受试菌的抑菌作用。由图4可知,在相同质量浓度(4 mg/mL)时,HMW组分对大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌的抑菌率(79%、75%、78%)均显著高于SAVE(58%、58%、66%)和LMW(29%、41%、46%)。因此结果证实,HMW主要成分为类黑精物质;SAVE中的类黑精对其抑菌作用发挥了主要作用。
2.3.2 类黑精抑菌活性组分的筛选
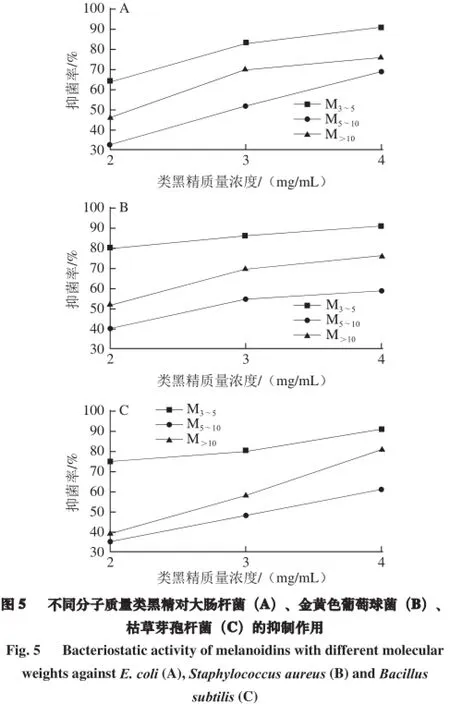
Einarsson[27]发现美拉德反应产物的抑菌活性依赖于美拉德反应产物的类型、浓度及其分子质量,比起分子质量小于1 kD的美拉德反应产物,分子质量大于1 kD的组分有更高的抑菌活性。为了筛选出老陈醋类黑精中最强的抑菌活性组分,采用SEC法从HWM中分离出3 个不同分子质量类黑精部分M3~5、M5~10、M>10,比较了它们的抑菌活力。由图5可知,此三部分类黑精物质对3 种受试菌均有显著的抑菌作用,且在2~4 mg/mL质量浓度范围内,抑菌率随质量浓度增加而增大,呈现剂量依赖效应,其中,M3~5类黑精对3 种菌的抑菌率均显著高于其他分子质量类黑精(P<0.05),表现了最强的抑菌作用。
2.3.3 不同质量浓度M3~5类黑精对大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌生长曲线的影响

生长曲线能够反映出细菌的生长状况。有研究报道[3,28],低质量浓度的类黑精有抑菌作用,而高质量浓度则会杀死细菌。由图6可知,3 个受试菌的空白对照组(类黑精质量浓度为0 mg/mL)细菌的迟缓期均为2 h左右,从2 h开始进入对数生长期,16 h左右达到了稳定期。而加入类黑精后,受试菌的生长受到明显的抑制,迟缓期延长,生长速率明显下降。例如,当类黑精质量浓度为2.5 mg/mL时,受试菌的迟缓期延长至4 h左右才开始逐渐进入对数期。同时,受试菌在对数生长期的生长速率也显著降低,使受试菌的生长量明显降低。当类黑精质量浓度为5 mg/mL时,3 种受试菌的生长均被完全抑制,其吸光度(A600 nm)随培养时间的延长无明显增加。这表明类黑精可有效地抑制受试菌的生长,M3~5类黑精的MIC为5 mg/mL。
2.4 类黑精中的抑菌成分
鉴于类黑精组成结构的极端复杂性和多样性,目前对其组成与结构给出一个确切的化学定义仍不太可能[1]。研究指出,类黑精的组成结构包括PM和BMC这两部分[1]。有研究发现,NaCl可用以释放连接在类黑精骨架上的低分子质量复合物,其作用是基于类黑精骨架上连接的小分子物质在高离子强度处理后会被解离下来[4,29-30]。Rufián-Henares等[14]对多种模式类黑精经过NaCl处理得到的PM 和BMC的抑菌活性作了研究,结果显示,BMC组分表现出比PM组分更高的抑菌活性。
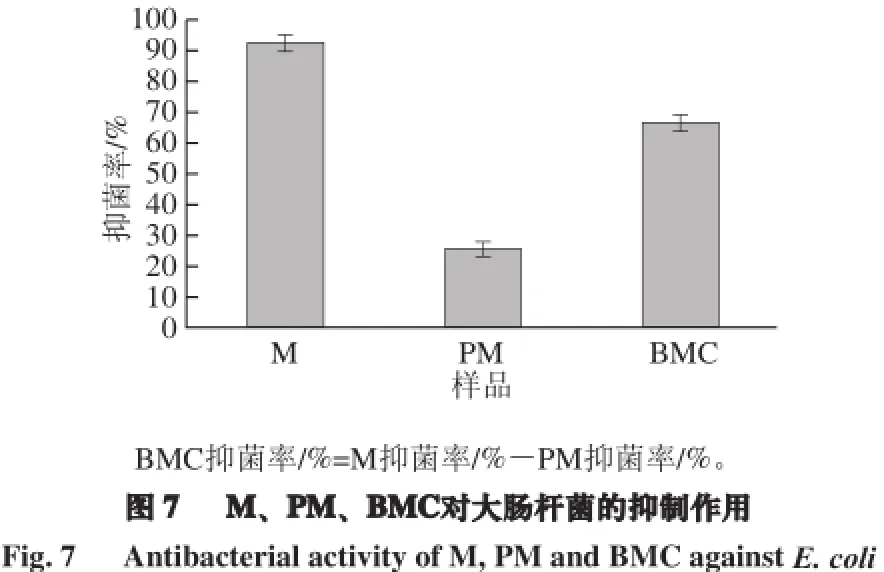
本研究采用2 mol/L的NaCl对分离得到的M3~5类黑精(M)进行解离,得到其PM和BMC两个部分,对它们的抑菌率进行了测定与评价。由图7可知,PM的抑菌率(25.89%)显著低于M的抑菌率(93.11%)且对类黑精抑菌率的贡献率仅为27.81%。鉴于BMC中含有大量NaCl无法去除,影响细菌生长,因此实验只对M及PM进行了抑菌率的测定,再通过推算得出BMC的抑菌率。经计算得出,BMC对类黑精抑菌率的贡献为72.19%。因此,类黑精组成中的小分子复合物组分比类黑精骨架组分发挥了更大的抑菌作用,这与Rufián-Henares等[14]的结论相一致。
3 结 论
山西老陈醋冻干粉对大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌均有显著的抑菌作用,在质量浓度为4 mg/mL时,对大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌的抑菌率分别达到58%、58%和66%,且在2~4 mg/mL范围内,其抑菌率随质量浓度的增加而显著增大,呈现剂量依赖效应。
SEC分离及成分分析表明,SAVE中的分子质量>3 kD的HMW物质可视为类黑精复合物。
SAVE中的类黑精对其抑菌作用发挥了主要的贡献。在相同质量浓度(4 mg/mL)时,类黑精对大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌的抑菌率(79%、75%、78%)均显著高于SAVE(58%、58%、66%)和LMW (29%、41%、46%)。
M3~5的类黑精组分抑菌活力最强。在相同质量浓度(3 mg/mL)时,M3~5对大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌的抑菌率(83%、86%、80%)均显著高于M5~10(52%、55%、48%)和M>10(70%、70%、58%),其对3 种受试菌的MIC均为5 mg/mL。
醋类黑精中的BMC比PM发挥了更大的抑菌作用。在相同质量浓度下,PM对类黑精抑菌作用的贡献仅为27.81%,而BMC对类黑精抑菌作用的贡献为72.19%。
参考文献:
[1] MOREIRA A S P, NUNES F M, DOMINGUES M R, et al.Coffee melanoidins: structures, mechanisms of formation and potential health impacts[J].Food & Function, 2012, 3(9): 903-915.DOI:10.1039/ c2fo30048f.
[2] DAGLIA M, TARSI R, PAPETTI A, et al.Antiadhesive effect of green and roasted coffee on Streptococcus mutans' adlhesive properties on saliva-coated hydroxyapatite beads[J].Journal of Agricultural and Food Chemistry, 2002, 50(5): 1225-1229.DOI:10.1021/jf010958t.
[3] RUFIÁN-HENARES J A, de la CUEVA S P.Antimicrobial activity of coffee melanoidins: a study of their metal-chelating properties[J].Journal of Agricultural and Food Chemistry, 2009, 57(2): 432-438.DOI:10.1021/jf8027842.
[4] RUFIÁN-HENARES J A, MORALES F J.Angiotensin-I converting enzyme inhibitory activity of coffee melanoidins[J].Journal of Agricultural and Food Chemistry, 2007, 55(4): 1480-1485.DOI:10.1021/jf062604d.
[5] 杨荣华, 林家莲, 周凌霄.酱油、豆酱中褐色色素的生理功能[J].中国调味品, 2000(5): 21-22.DOI:10.3969/ j.issn.1000-9973.2000.05.005.
[6] BRUDZYNSKI K, MILTTO D.The relationship between the content of Maillard reaction-like products and bioactivity of Canadian honeys[J].Food Chemistry, 2011, 124(3): 869-874.DOI:10.1016/ j.foodchem.2010.07.009.
[7] 向进乐, 罗磊, 郭香凤, 等.果醋功能性研究进[J].食品科学, 2013,34(13): 356-360.DOI:10.7506/spkx1002-6630-201313074.
[8] 王亚利, 洪厚胜, 张庆文, 等.酿造食醋在医药中的应用[J].时珍国医国药, 2008, 19(7): 1778-1780.DOI:10.3969/j.issn.1008-0805.2008.07.123.
[9] 宋晖, 张亚尼, 张亚增.醋洗液杀菌性能的实验研究[J].中国消毒学杂志, 2006, 23(6): 571.DOI:10.3969/j.issn.1001-7658.2006.06.037.
[10] 吴美云, 李世华.用紫外分光光度法快速测定糕点中蛋白质含量[J].食品科学, 1986(5): 55-59.
[11] DUBOIS N, GILLES K A, HAMILTON J K, et al.Colorimetric method for determination of sugars and related substances[J].Analytical Chemistry, 1956, 28(3): 350-356.DOI:10.1021/ ac60111a017.
[12] 项惠丹, 许时婴, 王璋.蛋白质与还原糖美拉德反应产物的抗氧化活性[J].食品科学, 2008, 29(7): 52-57.
[13] CALLIGARIS S, MANZOCCO L, ANESE M, et al.Effect of heat treatment on the antioxidant and pro-oxidant activity of milk[J].International Dairy Journal, 2004, 14(5): 421-427.DOI:10.1016/ j.idairyj.2003.10.001.
[14] RUFIÁN-HENARES J A, MORALES F J.Functional properties of melanoidins: in vitro antioxidant, antimicrobial and antihypertensive activities[J].Food Research International, 2007, 40(8): 995-1002.DOI:10.1016/j.foodres.2007.05.002.
[15] 张建荣, 马俪珍, 梁鹏.鲶鱼骨蛋白酶解物中抗菌活性物质的初步分离纯化[J].食品与发酵工业, 2009, 35(2): 48-52.
[16] GÖKMEN V, SERPEN A, FOGLIANO V.Direct measurement of the total antioxidant capacity of foods: the ‘QUENCHER' approach[J].Trends in Food Science & Technology, 2009, 20(6): 278-288.DOI:10.1016/j.tifs.2009.03.010.
[17] MORALES F J, SOMOZA V, FOGLIANO V.Physiological relevance of dietary melanoidins[J].Amino Acids, 2012, 42(4): 1097-1109.DOI:10.1007/s00726-010-0774-1.
[18] DAGLIA M, PAPETTI A, ACETI C, et al.Isolation of high molecular weight components and contribution to the protective activity of coffee against lipid peroxidation in a rat liver microsome system[J].Journal of Agricultural and Food Chemistry, 2008, 56(24): 11653-11660.DOI:10.1021/jf802018c.
[19] REICHARDT N, GNIECHWITZ D, STEINHART H, et al.Characterization of high molecular weight coffee fractions and their fermentation by human intestinal microbiota[J].Molecular Nutrition & Food Research, 2009, 53(2): 287-299.DOI:10.1002/mnfr.200700509.
[20] BEKEDAM E K, SCHOLS H A, van BOEKEL M A, et al.High molecular weight melanoidins from coffee brew[J].Journal of Agricultural and Food Chemistry, 2006, 54(20): 7658-7666.DOI:10.1021/jf0615449.
[21] STAUDER M, PAPETTI A, MASCHERPA D, et al.Antiadhesion and antibiofilm activities of high molecular weight coffee components against Streptococcus mutans[J].Journal of Agricultural and Food Chemistry, 2010, 58(22): 11662-11666.DOI:10.1021/jf1031839.
[22] MARTIN M A, RAMOS S, MATEOS R, et al.Biscuit melanoidins of different molecular masses protect human HepG2 cells against oxidative stress[J].Journal of Agricultural and Food Chemistry, 2010,57(16): 7250-7258.DOI:10.1021/jf9006032.
[23] ELENA V, DAVIDE T, ANGELA C.From balsamic to healthy: traditional balsamic vinegar melanoidins inhibit lipid peroxidation during simulated gastric digestion of meat[J].Food and Chemical Toxicology, 2010, 48(8): 2097-2102.DOI:10.1016/j.fct.2010.05.010.
[24] LANGNER E, NUNES F M, POZAROWSKI P, et al.Antiproliferative activity of melanoidins isolated from heated potato fiber (potex)in glioma cell culture model[J].Journal of Agricultural and Food Chemistry, 2011, 59(6), 2708-2716.DOI:10.1021/jf1047223.
[25] MARTINS S, JONGEN W, van BOEKEL M A J S.A review of Maillard reaction in food and implication to kinetic modeling[J].Trends Food Technology, 2001, 11(9/10): 364-373.DOI:10.1016/ S0924-2244(01)00022-X.
[26] YAYLAYAN V A, KAMINSKY E.Isolation and structural analysis of Maillard polymers: caramel and melanoidin formation in glycine/ glucose model system[J].Food Chemistry, 1998, 63(1): 25-31.DOI:10.1016/S0308-8146(97)00237-9.
[27] EINARSSON H.The effect of pH and temperature on the antibacterial effect of Maillard reaction products[J].Lebensmittel-Wissenschaft & Technologie, 1987, 20(2): 56-58.
[28] 杨剀舟, 翟晓娜, 杜秉健, 等.咖啡中功能性成分分离检测技术及安全性评价[J].食品科学, 2014, 35(3): 243-252.DOI:10.7506/ spkx1002-6630-201403049.
[29] DELGADO-ANDRADE C, MORALES F J.Unraveling the contribution of melanoidins to the antioxidant activity of coffee brews[J].Journal of Agricultural and Food Chemistry, 2005, 53(5): 1403-1407.DOI:10.1021/jf048500p.
[30] DELGADO-ANDRADE C, RUFIAN-HENARES J A, MORALES F J.Assessing the antioxidant activity of melanoidins from coffee brews by different antioxidant methods[J].Journal of Agricultural and Food Chemistry, 2005, 53(20): 7832-7836.DOI:10.1021/jf0512353.
DOI:10.7506/spkx1002-6630-201613005
中图分类号:TS201.1
文献标志码:A
文章编号:1002-6630(2016)13-0025-06
收稿日期:2015-08-10
基金项目:国家自然科学基金面上项目(31171748);山西省科技攻关项目(20140321020-01;20110321078)
作者简介:郭李云(1991—),女,硕士研究生,研究方向为食品生物技术。E-mail:guoliyunjn@163.com
*通信作者:杨小兰(1956—),女,教授,本科,研究方向为食品生物技术。E-mail:13934214833@163.com
Separation of Melanoidin from Shanxi Aged Vinegar and Its Antibacterial Activity
GUO Liyun, YANG Xiaolan*
(College of Life Science, Shanxi University, Taiyuan 030006, China)
Abstract:Shanxi aged vinegar extract (SAVE, lyophilized aqueous extract) was separated by ultrafiltration into different molecular weight aqueous soluble fractions and the high molecular weight fraction was further purified into melanoidins.Thereafter, the melanoidins were dissociated in aqueous NaCl solution into two components: skeleton and small molecular weight complex.The antibacterial activity of these components against E.coli, Staphylococcus aureus and Bacillus subtilis was determined by a turbidimetric method.Results indicated that melanoidins from SAVE had a significant antibacterial activity (P < 0.05), and they played a major role in the bacteriostatic activity of SAVE.The antimicrobial activity of the melanoidin component with molecular weight of 3-5 kD was the strongest, with minimal inhibitory concentration (MIC)of 5 mg/mL for all three bacteria tested.The small molecular weight complex from melanoidin had greater bacteriostastic activity than the skeleton part.
Key words:Shanxi aged vinegar; melanoidin; antibacterial activity; separation
