多酚化合物体外模拟消化的稳定性分析
2016-08-10王谢祎翟宇鑫戴涛涛刘继延刘成梅南昌大学食品科学与技术国家重点实验室江西南昌330047江西齐云山食品有限公司江西赣州34000
李 俶,王谢祎,翟宇鑫,戴涛涛,陈 军,*,刘继延,刘成梅(.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;.江西齐云山食品有限公司,江西 赣州 34000)
多酚化合物体外模拟消化的稳定性分析
李 俶1,王谢祎1,翟宇鑫1,戴涛涛1,陈 军1,*,刘继延2,刘成梅1
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.江西齐云山食品有限公司,江西 赣州 341000)
摘 要:选取7 种不同种类的酚类化合物,研究体外模拟胃肠道消化对其稳定性的影响。结果表明:不同酚类化合物在胃肠道消化过程中的稳定性不同。高效液相色谱分析结果显示,胃消化过程对酚酸类化合物的影响较小,其含量无显著变化,但类黄酮化合物在胃消化过程中稳定性较差,儿茶素含量下降了16.6%、表儿茶素含量下降了约6%。经模拟肠液处理后,除阿魏酸、对羟基苯甲酸外,其他酚类化合物含量均显著降低,此外,绿原酸在肠液消化过程中生成了新的物质。体外模拟胃肠液消化对混合标准品的作用结果有所不同,模拟胃液消化对混合标准品含量均无显著影响,模拟肠液消化后,仅表儿茶素、没食子酸含量分别降低为76.96%和50.30%,其他酚类化合物含量均无显著变化。
关键词:酚类化合物;体外模拟消化;高效液相色谱
引文格式:
李俶, 王谢祎, 翟宇鑫, 等.多酚化合物体外模拟消化的稳定性分析[J].食品科学, 2016, 37(13): 1-5.DOI:10.7506/ spkx1002-6630-201613001. http://www.spkx.net.cn
LI Ti, WANG Xieyi, ZHAI Yuxin, et al.Stability of polyphenols during in vitro digestion[J].Food Science, 2016, 37(13): 1-5.(in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201613001. http://www.spkx.net.cn
多酚化合物是广泛存在于植物中的次级代谢产物,在植物中的含量仅次于木质素[1],普遍存在于水果、蔬菜、坚果和谷物中[2-5]。多酚化合物具有多种生物活性,如抗氧化性[5-7]、抗菌[8-11]、抗癌[12-14]等。
大量的研究表明,自由基和脂质过氧化是引起心血管疾病、癌症、肿瘤及衰老的重要原因[15]。植物中的多酚化合物可以有效清除自由基、抑制脂质过氧化[16]。经常食用富含多酚化合物的水果和蔬菜可以减小患心脑血管疾病、癌症、糖尿病、衰老等退行性疾病的概率[17-18]。
多酚化合物虽然具有多种生理活性,但是其对温度、pH值、氧气和光较为敏感,这些因素都会显著地影响多酚化合物的稳定性,降低多酚化合物的生物利用度,进而降低其在人体内的生物活性。此外,任何一种生物活性物质在发挥其作用之前,都要经过人体的胃肠道消化,而消化也会对多酚化合物的生物活性产生影响。目前对多酚化合物大部分的研究主要集中在对某一植物或其提取液总多酚含量及其抗氧化性的影响方面,但是关于消化对多酚单体影响的研究目前较少。因此,本实验选取了果蔬中常见的几种酚类化合物,研究体外模拟胃肠道消化对其稳定性的影响,为多酚化合物保健食品的设计和研发提供一些理论参考依据。
1 材料与方法
1.1 材料与试剂
标准品表儿茶素、儿茶素、没食子酸、绿原酸、咖啡酸、阿魏酸、对羟基苯甲酸(纯度>99.9%) 阿拉丁试剂(上海)有限公司。
胃蛋白酶(≥250 U/mg)、胰蛋白酶(8×USP)、牛胆酸钠 美国Sigma公司;MD44透析袋 北京索莱宝公司;NaCl、NaHCO3、HCl均为分析纯,乙腈、乙酸均为色谱纯 西陇化工股份有限公司。
1.2 仪器与设备
HH-4型恒温数显水浴摇床 金坛市城西晓阳电子仪器厂;AR1140型分析天平 美国Oahus公司;安捷伦1260型高效液相色谱 美国Agilent公司;SunFire C18色谱柱(4.6 mm×250 mm,5 μm) 美国Waters公司。
1.3 方法
1.3.1 标准溶液配制
各准确称取100.00 mg表儿茶素、儿茶素、没食子酸、绿原酸、咖啡酸、阿魏酸、对羟基苯甲酸标准样品于10 mL不同的具塞比色管中,无水乙醇定容至5 mL,混匀备用。
单一标准品:准确吸取上述1.00 mL各标准溶液于10 mL不同的具塞比色管中,无水乙醇定容至10 mL,配制成2 mg/mL的单一标准品溶液,4 ℃保存待分析。分析前用0.22 μm滤膜过滤。
混合标准品:准确吸取上述1.00 mL各标准溶液混合于同一10 mL具塞比色管中,无水乙醇定容至10 mL,配制成相同质量浓度的混合标准溶液。分析前用0.22 μm滤膜过滤。
1.3.2 高效液相色谱(high performance liquid chromatography,HPLC)条件
HPLC仪:Agilent 1260 Infinity,色谱柱:SunFire C18柱(4.6 mm×250 mm,5 μm),流动相:A液(乙腈-0.5%乙酸水(1∶1,V/V))、B液(0.2%乙酸水),紫外检测波长:280 nm,流动相流速:0.7 mL/min,柱温:30 ℃,进样量:10 μL。梯度洗脱程序见表1。
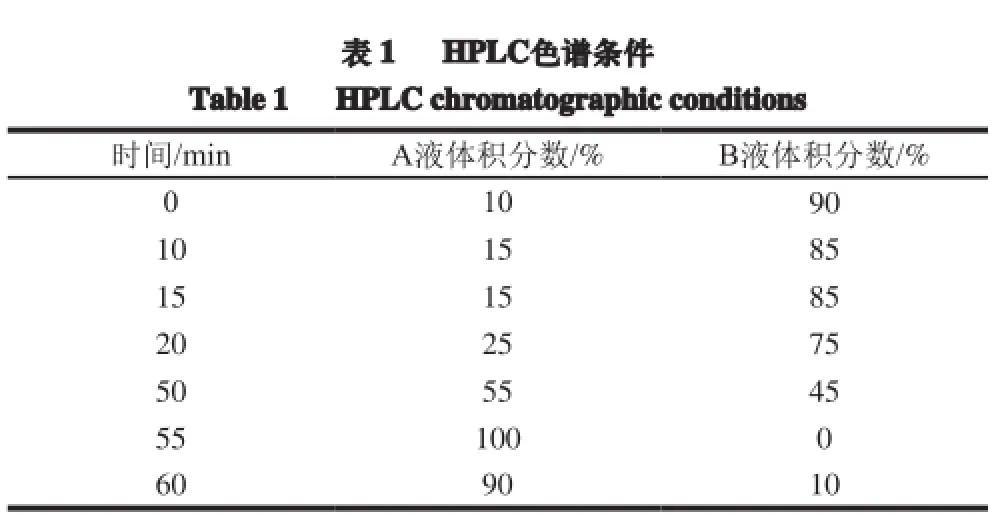
表 1 HPLC色谱条件Table 1 HPLC chromatographic conditions时间/min A液体积分数/% B液体积分数/% 0 10 90 10 15 85 15 15 85 20 25 75 50 55 45 55 100 0 60 90 10
1.3.3 标准曲线绘制
精确移取1.3.1节所制备的各标准溶液1、2、3、4、5、6 mL于10 mL容量瓶中,用超纯水定容,进样前以0.22 μm滤膜过滤。以峰面积为纵坐标,样品质量浓度为横坐标,绘制标准曲线,各多酚化合物的标准曲线方程见表2。
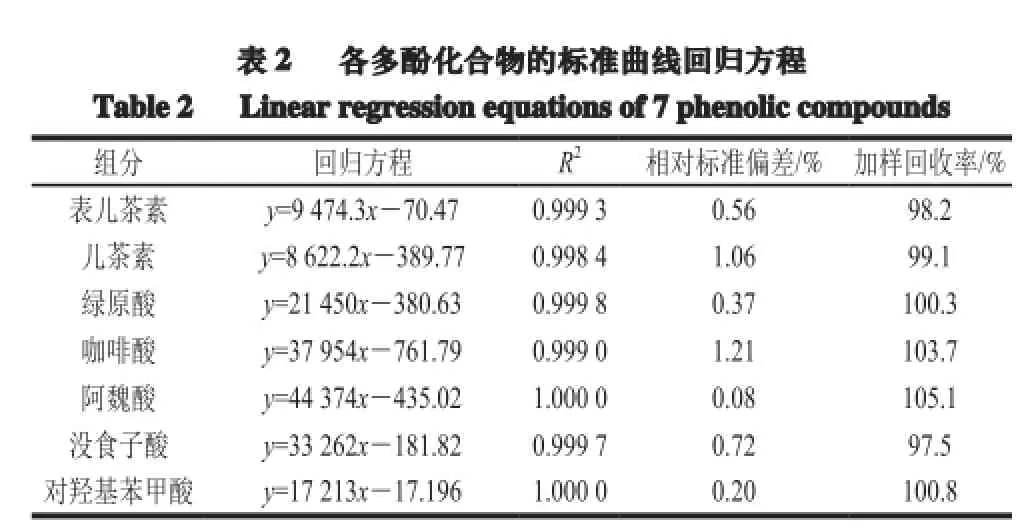
表 2 各多酚化合物的标准曲线回归方程Table 2 Linear regressionequations of 7 phenolic compounds组分 回归方程 R2相对标准偏差/% 加样回收率/%表儿茶素 y=9 474.3x-70.47 0.999 3 0.56 98.2儿茶素 y=8 622.2x-389.77 0.998 4 1.06 99.1绿原酸 y=21 450x-380.63 0.999 8 0.37 100.3咖啡酸 y=37 954x-761.79 0.999 0 1.21 103.7阿魏酸 y=44 374x-435.02 1.000 0 0.08 105.1没食子酸 y=33 262x-181.82 0.999 7 0.72 97.5对羟基苯甲酸 y=17 213x-17.196 1.000 0 0.20 100.8
1.3.4 体外模拟胃肠道消化[19-20]
模拟人体肠道温度和酸碱度环境,测定消化对所选单一标准品和混合标准品的影响。体外模拟消化过程分为两个阶段:模拟胃液消化和模拟肠道消化。
以0.1 mol/L HCl溶液配制4 mg/mL胃蛋白酶溶液,以0.1 mol/L NaHCO3溶液配制胰液胆汁混合液(2 mg/mL胰液、12 mg/mL胆汁)。
模拟胃液消化:分别于两个10 mL具塞比色管中加入4 mL 9 mg/mL的NaCl溶液和4 mL 4 mg/mL的活性胃蛋白酶溶液,混匀,以0.1 mol/L HCl溶液调整pH值至2.0~2.5。加入1 mL 2 mg/mL各标准品溶液或混合标准品溶液,于37 ℃、100 r/min水浴振荡1 h,旋转蒸发至一定体积后冻干,以超纯水定容至10 mL。HPLC分析前用0.22 μm滤膜过滤。
模拟肠液消化:用1 mol/L NaHCO3溶液调节上述胃液pH 6.5~7.0,于37 ℃、100 r/min水浴振荡45 min,加入活性胰液-胆汁混合液1.8 mL,调节pH 7.0~7.5,进行模拟肠液消化2 h,旋转蒸发至一定体积后冻干,超纯水定容至10 mL。分析前用0.22 μm滤膜过滤。
2 结果与分析
2.1 线性关系考察
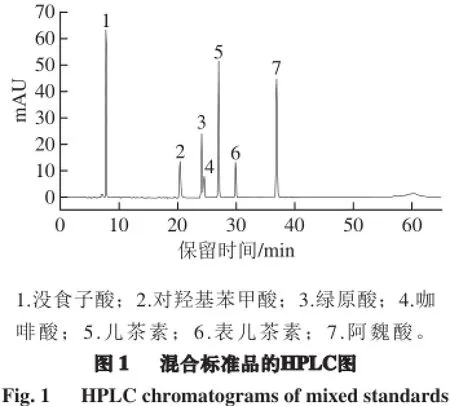
如图1所示,梯度洗脱后混合标准品得到了较好的分离。比较单一标准品的保留时间,可确定混合标准品中各物质的洗脱顺序,其中包括酚酸:苯甲酸类(没食子酸、对羟基苯甲酸)、肉桂酸类(绿原酸、咖啡酸、阿魏酸);类黄酮类(儿茶素、表儿茶素)共7 种酚类单体样品。
2.2 体外消化对单一多酚化合物的作用结果
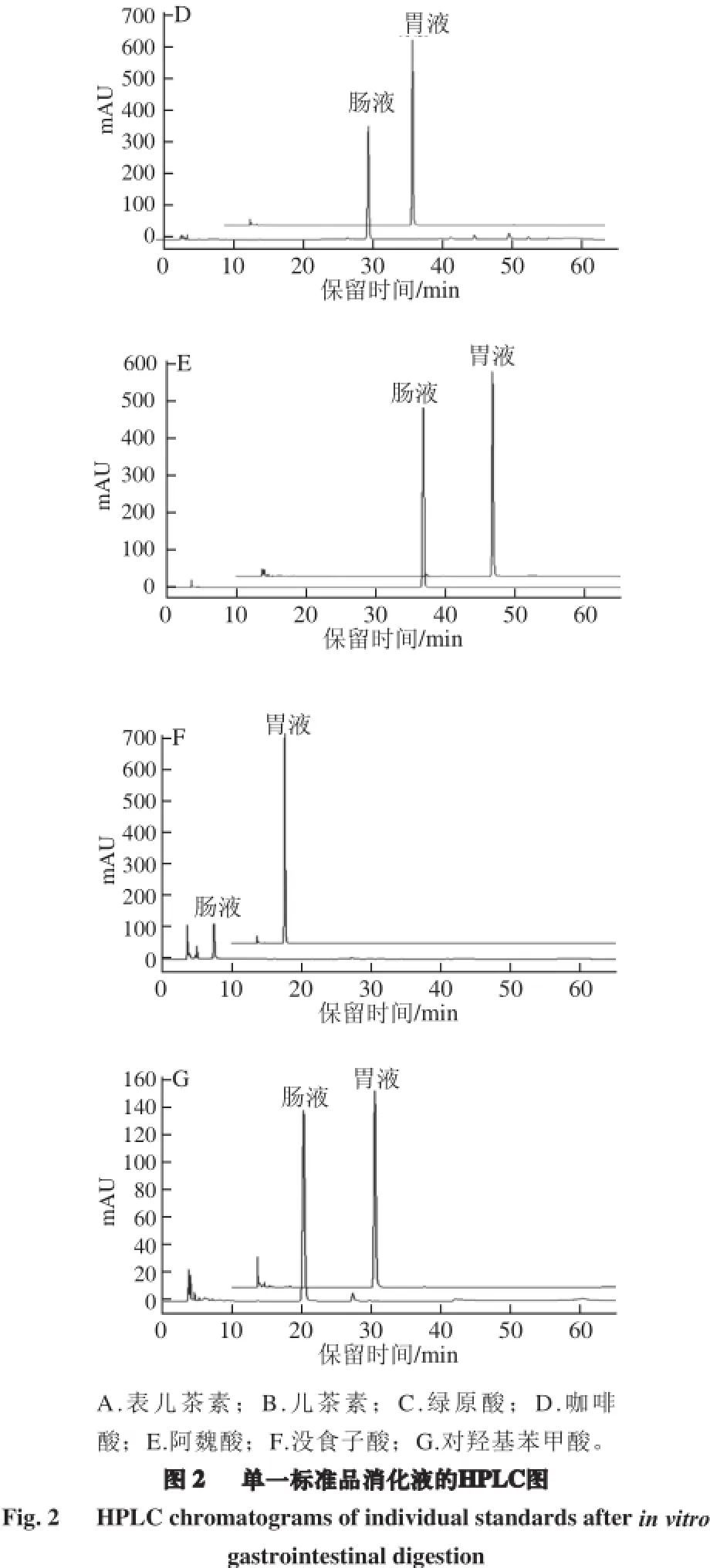
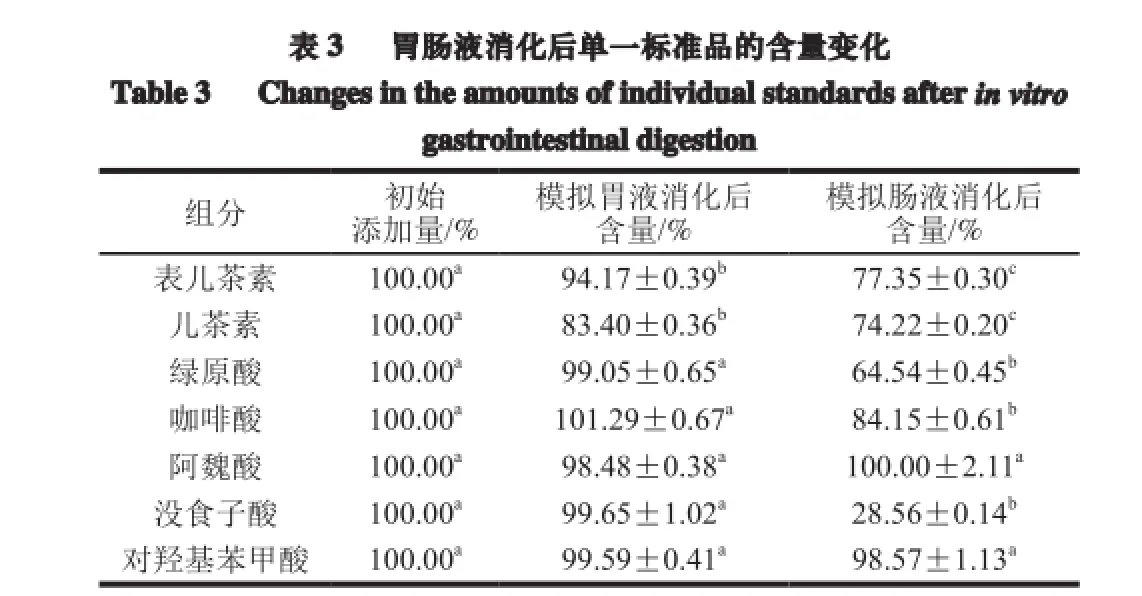
注:同行小写字母不同表示差异显著(P<0.05);表中数据均为质量分数。下同。
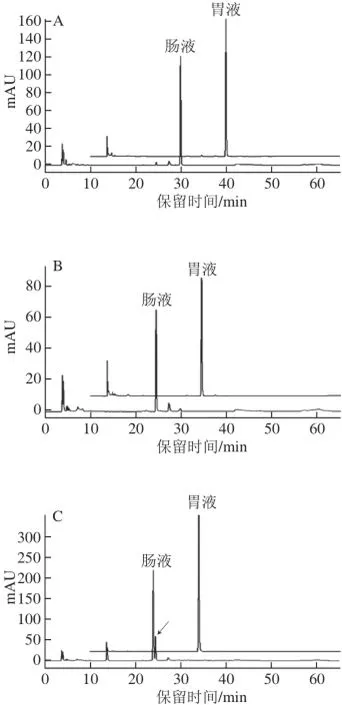
如图2和表3所示,模拟胃肠液消化对不同的酚类化合物作用效果不同。模拟胃液消化对酚酸类化合物(绿原酸、咖啡酸、阿魏酸、没食子酸和对羟基苯甲酸)的影响较小,各酚酸类化合物含量无显著变化,但对类黄酮类化合物影响较明显,二者含量显著降低,其中儿茶素含量下降最明显,降幅为16.60%,表儿茶素次之,降幅约为6%。除阿魏酸、对羟基苯甲酸外,模拟肠道消化对其他酚类单体含量均有显著影响(P<0.05),各酚类化合物在肠液中含量依次为:阿魏酸=对羟基苯甲酸>咖啡酸>表儿茶素>儿茶素>绿原酸>没食子酸,但与模拟胃液消化后各酚类单体含量相比,模拟肠液消化后下降幅度由高到低依次为:没食子酸(71%)>绿原酸(35%)>表儿茶素(16%)= 咖啡酸(16%)>儿茶素(9%)>对羟基苯甲酸=阿魏酸(0%)。由以上结果可知,模拟肠液消化对没食子酸、绿原酸的作用效果比类黄酮类化合物明显;类黄酮类化合物中的儿茶素的含量在模拟肠液消化过程中变化最小,即在所选7 种酚类化合物中,没食子酸和绿原酸在模拟肠液中最不稳定,而阿魏酸和对羟基苯甲酸最稳定。
如图2所示,绿原酸在模拟肠液环境中除了自身含量下降的同时还生成了新的物质,即产生了新的吸收峰。据文献[21]报道,肠液环境中绿原酸含量下降的同时常伴随异构化生成新绿原酸或隐绿原酸。
Tenore等[22]发现44.4%和91.8%的儿茶素在胃、肠消化液中含量有所损失,他们认为是由于儿茶素对胃肠道的酸碱pH值敏感而引起的,肠道碱性环境和溶解氧引起了儿茶素二聚体自氧化,而VC具有的显著抗氧化性,可增强儿茶素在碱性环境中的稳定性,减少其损失。任淑萌[23]研究发现高浓度的阿魏酸降解速度较慢,且在趋于中性条件下稳定性最高,转化速率常数最低,酸性条件下其稳定性有所降低,碱性条件下最低。
2.3 体外模拟消化对混合标准品的作用结果
酚类化合物单体间由于结构不同易发生空间阻碍或相互作用,进而影响其稳定性和生物活性等。胃肠液消化环境较复杂,影响因素众多,酚类化合物在消化过程中结构和含量都会发生一定的变化。为了进一步研究酚类化合物在胃肠液消化环境中存在的相互影响,本实验将所选多酚标准品等比例混合,以混合标准品形式进行胃肠液消化,以观察酚类化合物间结构与含量在模拟胃肠液中的变化,结果见图3。
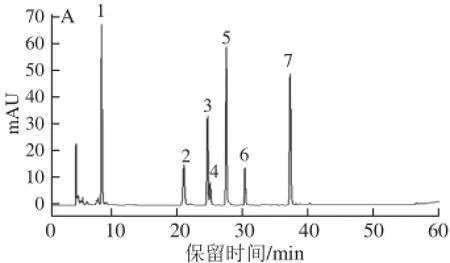
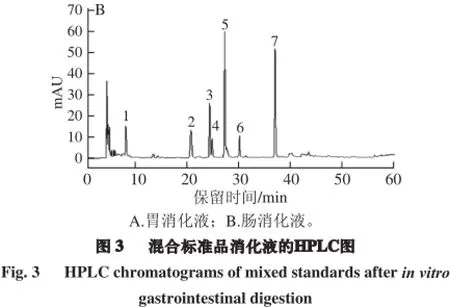
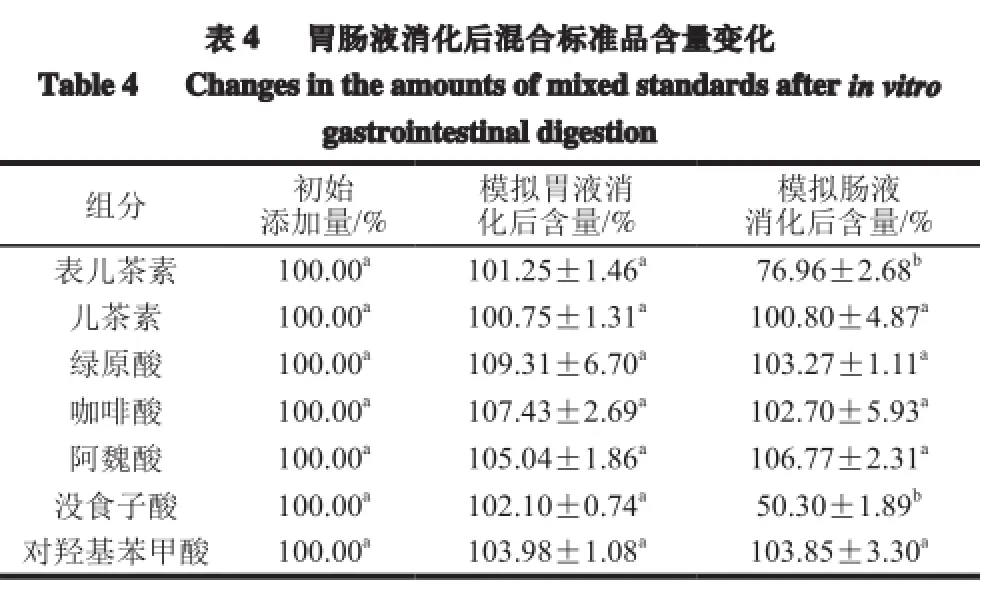
表4胃肠液消化后混合标准品含量变化Table 4 Changesin theamountsofmixed standards after in vitro gastrointestinal digestion组分 初始 模拟胃液消 模拟肠液添加量/%化后含量/%消化后含量/%表儿茶素 100.00a101.25±1.46a76.96±2.68b儿茶素 100.00a100.75±1.31a100.80±4.87a绿原酸 100.00a109.31±6.70a103.27±1.11a咖啡酸 100.00a107.43±2.69a102.70±5.93a阿魏酸 100.00a105.04±1.86a106.77±2.31a没食子酸 100.00a102.10±0.74a50.30±1.89b对羟基苯甲酸 100.00a103.98±1.08a103.85±3.30a
如图3和表4所示,与单一标准品作用效果比较,模拟胃肠道消化对混合标准品的作用效果有所不同。模拟胃液消化对混合标准品影响较小,各酚类化合物含量均无显著变化,模拟肠液消化对各酚类化合物影响则不同,儿茶素、绿原酸、咖啡酸、阿魏酸、对羟基苯甲酸含量均无显著变化,表儿茶素、没食子酸含量均下降显著(P<0.05),降幅分别为23.03%、49.70%。以上结果表明,酚类化合物单体混合后,胃肠道消化对其作用均有一定程度的降低,单体进行模拟胃液消化时,儿茶素及表儿茶素含量下降显著,而混合标准品经过模拟胃液消化后,含量均未下降,即混合酚类化合物在模拟胃液消化过程中稳定性提高;同样,混合标准品在模拟肠液内的稳定性也有所提高,除儿茶素和没食子酸外,其他5 种酚类化合物含量未发生变化。由以上结果可知,混合标准品相对于单一标准品在胃肠道消化过程中的稳定性得到了一定程度的提高,这可能是由于酚类化合物单体之间形成一定的相互作用,增加了其在胃肠液内的稳定性。
本课题组前期研究[24]发现菠萝皮中4 种多酚单体的抗氧化性与两两组合之后的多酚单体的抗氧化性不同,其理论值和实际值有差异,多酚物质之间存在拮抗和加成作用,Heo等[25]研究了12 种多酚物质之间的相互作用,发现多酚物质之间存在加成和拮抗作用,因此,本实验推测多酚之间的相互作用保护了其稳定性,同时Green等[26]发现在绿茶水提液中加入柑橘汁后,其儿茶素类均表现出较强的稳定性,这可能也是由于柑橘汁中富含的黄酮醇、黄烷酮类或萜烯等物质与儿茶素类进行相互作用,增加了其稳定性,抑制儿茶素类在高pH值条件下形成游离自由基形式,从而减少了儿茶素类物质的损失。因此本实验中混合标准品的消化稳定性也与标准品之间发生的相互作用有关。
3 结 论
不同酚类化合物在模拟胃肠道消化过程中稳定性不同。模拟胃液对酚酸类化合物的影响较小,其含量无显著变化,但类黄酮化合物在模拟胃液消化过程中稳定性较差,儿茶素含量下降16.6%,表儿茶素含量约下降6%。经模拟肠液处理后,除阿魏酸、对羟基苯甲酸外,其他酚类化合物含量均显著下降,此外,绿原酸经模拟肠液消化后还生成了新的物质。
模拟胃肠液对混合标准品的作用结果与单一标准品有所不同。模拟胃液消化对混合标准品含量均无显著影响,模拟肠液消化后,仅表儿茶素、没食子酸含量分别降低为76.96%和50.30%,其他酚类化合物含量均无显著变化。
参考文献:
[1] BOUAYED J.Polyphenols: a potential new strategy for the prevention and treatment of anxiety and depression[J].Current Nutrition & Food Science, 2010, 6: 13-18.DOI:10.2174/157340110790909608.
[2] RANILLA L G, KWON Y I, APOSTOLIDIS E, et al.Phenolic compounds, antioxidant activity and in vitro inhibitory potential against key enzymes relevant for hyperglycemia and hypertension of commonly used medicinal plants, herbs and spices in Latin America[J].Bioresource Technology, 2010, 101(12): 4676-4689.DOI:10.1016/ j.biortech.2010.01.093.
[3] TAGLIAZUCCHI D, VERZELLONI E, BERTOLINI D, et al.In vitro bio-accessibility and antioxidant activity of grape polyphenols[J].Food Chemistry, 2010, 120(2): 599-606.DOI:10.1016/ j.foodchem.2009.10.030.
[4] BANSODE R R, RANDOLPH P, AHMEDNA M, et al.Bioavailability of polyphenols from peanut skin extract associated with plasma lipid lowering function[J].Food Chemistry, 2014, 148: 24-29.DOI:10.1016/ j.foodchem.2013.09.129.
[5] COSTA P, GREVENSTUK T, COSTA A M R D, et al.Antioxidant and anti-cholinesterase activities of Lavandula viridis L'Hér extracts after in vitro gastrointestinal digestion[J].Industrial Crops & Products,2014, 55: 83-89.DOI:10.1016/j.indcrop.2014.01.049.
[6] ORDOÑEZ A A L, GOMEZ J D, VATTUONE M A, et al.Antioxidant activities of Sechium edule (Jacq.) Swartz extracts[J].Food Chemistry,2006, 97(3): 452-458.DOI:10.1016/j.foodchem.2005.05.024.
[7] DZIRI S, HASSEN I, FATNASSI S, et al.Phenolic constituents,antioxidant and antimicrobial activities of rosy garlic (Allium roseum var.odoratissimum)[J].Journal of Functional Foods, 2012, 4(2): 423-432.DOI:10.1016/j.jff.2012.01.010.
[8] SI W, GONG J, RONG T, et al.Bioassay-guided purification and identification of antimicrobial components in Chinese green tea extract[J].Journal of Chromatography A, 2006, 1125(2): 204-210.DOI:10.1016/j.chroma.2006.05.061.
[9] DAGLIA M.Polyphenols as antimicrobial agents[J].Current Opinion in Biotechnology, 2012, 23(2): 174-181.DOI:10.1016/ j.copbio.2011.08.007.
[10] SALEM M Z, ALI H M, EL-SHANHOREY N A, et al.Evaluation of extracts and essential oil from Callistemon viminalis leaves: antibacterial and antioxidant activities, total phenolic and flavonoid contents[J].Asian Pacific Journal of Tropical Medicine, 2013, 6(10): 785-791.DOI:10.1016/S1995-7645(13)60139-X.
[11] RASHED K, ĆIRIĆ A, GLAMOČLIJA J, et al.Antibacterial and antifungal activities of methanol extract and phenolic compounds from Diospyros virginiana L.[J].Industrial Crops & Products, 2014, 59(8): 210-215.DOI:10.1016/j.indcrop.2014.05.021.
[12] OUESLATI S, KSOURI R, FALLEH H, et al.Phenolic content,antioxidant, anti-infammatory and anticancer activities of the edible halophyte Suaeda fruticosa Forssk[J].Food Chemistry, 2012, 132(2): 943-947.DOI:10.1016/j.foodchem.2011.11.072.
[13] XU B, CHANG S K C.Comparative study on antiproliferation properties and cellular antioxidant activities of commonly consumed food legumes against nine human cancer cell lines[J].Food Chemistry,2012, 134(3): 1287-1296.DOI:10.1016/j.foodchem.2012.02.212.
[14] ROLEIRA F M F, TAVARES-DA-SILVA E J, VARELA C L, et al.Plant derived and dietary phenolic antioxidants: anticancer properties[J].Food Chemistry, 2015, 183: 235-258.DOI:10.1016/ j.foodchem.2015.03.039.
[15] CÉSPEDES C L, EL-HAFIDI M, PAVON N, et al.Antioxidant and cardioprotective activities of phenolic extracts from fruits of Chilean blackberry Aristotelia chilensis (Elaeocarpaceae),Maqui[J].Food Chemistry, 2008, 107(2): 820-829.DOI:10.1016/ j.foodchem.2007.08.092.
[16] OBIANG-OBOUNOU B W, RYU G H.The effect of feed moisture and temperature on tannin content, antioxidant and antimicrobial activities of extruded chestnuts[J].Food Chemistry, 2013, 141(4): 4166-4170.DOI:10.1016/j.foodchem.2013.06.129.
[17] HOGAN S, CHUNG H, ZHANG L, et al.Antiproliferative and antioxidant properties of anthocyanin-rich extract from açai[J].Food Chemistry, 2010, 118(2): 208-214.DOI:10.1016/ j.foodchem.2009.04.099.
[18] KIM H, MOON J Y, KIM H, et al.Antioxidant and antiproliferative activities of mango (Mangifera indica L.) flesh and peel[J].Food Chemistry, 2010, 121(2): 429-436.DOI:10.1016/ j.foodchem.2009.12.060.
[19] BOUAYED J, HOFFMANN L, BOHN T.Total phenolics, favonoids,anthocyanins and antioxidant activity following simulated gastrointestinal digestion and dialysis of apple varieties: bioaccessibility and potential uptake[J].Food Chemistry, 2011, 128(1): 14-21.DOI:10.1016/j.foodchem.2011.02.052.
[20] BOUAYED J, DEUßER H, HOFFMANN L, et al.Bioaccessible and dialysable polyphenols in selected apple varieties following in vitro digestion vs.their native patterns[J].Food Chemistry, 2012, 131(4): 1466-1472.DOI:10.1016/j.foodchem.2011.10.030.
[21] LÓPEZ-NICOLÁS R, GONZÁLEZ-BERMÚDEZ C A, ROSBERRUEZO G, et al.Infuence of in vitro gastrointestinal digestion of fruit juices enriched with pine bark extract on intestinal microflora[J].Food Chemistry, 2014, 157(8): 14-19.DOI:10.1016/ j.foodchem.2014.01.126.
[22] TENORE G C, CAMPIGLIA P, GIANNETTI D, et al.Simulated gastrointestinal digestion, intestinal permeation and plasma protein interaction of white, green, and black tea polyphenols[J].Food Chemistry, 2015, 169: 320-326.DOI:10.1016/j.foodchem.2014.08.006.
[23] 任淑萌.阿魏酸的降解作用规律和机理研究及其在药物质量控制中的应用[D].石家庄: 河北医科大学, 2009: 1-20.
[24] LI T, SHEN P, LIU W, et al.Major polyphenolics in pineapple peels and their antioxidant interactions[J].International Journal of Food Properties,2014, 17(8): 1805-1817.DOI:10.1080/10942912.2012.732168.
[25] HEO H J, KIM Y J, CHUNG D, et al.Antioxidant capacities of individual and combined phenolics in a model system[J].Food Chemistry, 2007,104(1): 87-92.DOI:10.1016/j.foodchem.2006.11.002.
[26] GREEN R J, MURPHY A S, SCHULZ B, et al.Common tea formulations modulate in vitro digestive recovery of green tea catechins[J].Molecular Nutrition & Food Research, 2007, 51(9): 1152-1162.DOI:10.1002/mnfr.200700086.
DOI:10.7506/spkx1002-6630-201613001
中图分类号:TS201.2
文献标志码:A
文章编号:1002-6630(2016)13-0001-05
收稿日期:2015-07-15
基金项目:国家自然科学基金地区科学基金项目(31460394);江西省科技支撑计划项目(20121BBF60039)
作者简介:李俶(1971—),女,教授,博士,研究方向为天然产物的提取与应用。E-mail:liti@ncu.edu.cn
*通信作者:陈军(1986—),男,副研究员,博士,研究方向为食品(含生物质)资源的开发利用。E-mail:chen-jun1986@hotmail.com
Stability of Polyphenols during in Vitro Digestion
LI Ti1, WANG Xieyi1, ZHAI Yuxin1, DAI Taotao1, CHEN Jun1,*, LIU Jiyan2, LIU Chengmei1
(1.State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China;2.Jiangxi Qiyunshan Food Co.Ltd., Ganzhou 341000, China)
Abstract:The aims of this study were to investigate the stability of 7 polyphenols during in vitro digestion.The changes in seven polyphenol standards at different phases of gastrointestinal (GI) digestion were estimated by an HPLC method.The results showed that no significant changes were observed in phenolic acid compounds in gastric digestion; however,flavonoids compounds decreased significantly.Except ferulic acid and р-hydroxy benzoic acid, the amounts of all phenolic compounds investigated were decreased significantly in intestinal phase and at the same time, chlorogenic acid were transformed into new compounds.The mixed standards had no significant changes during gastric digestion.However,epicatechin and gallic acid were significantly reduced to 76.96% and 50.30%, respectively after intestinal digestion, while 5 other phenolic compounds did not change noticeably.
Key words:polyphenols; in vitro digestion; high performance liquid chromatography (HPLC)
