菜籽多肽体外和细胞内抗氧化性评价及氨基酸分析
2016-08-10张怡一徐斐然石嘉怿鞠兴荣王立峰南京财经大学食品科学与工程学院江苏省现代粮食流通与安全协同创新中心江苏高校粮油质量安全控制及深加工重点实验室江苏南京210023
张 晶,张怡一,徐斐然,石嘉怿,鞠兴荣,王立峰*(南京财经大学食品科学与工程学院,江苏省现代粮食流通与安全协同创新中心,江苏高校粮油质量安全控制及深加工重点实验室,江苏 南京 210023)
菜籽多肽体外和细胞内抗氧化性评价及氨基酸分析
张 晶,张怡一,徐斐然,石嘉怿,鞠兴荣,王立峰*
(南京财经大学食品科学与工程学院,江苏省现代粮食流通与安全协同创新中心,江苏高校粮油质量安全控制及深加工重点实验室,江苏 南京 210023)
摘 要:本研究以Alcalase 2.4L酶解“双低”油菜籽宁杂19号得到的菜籽蛋白酶解物(rapeseed protein hydrolysate,RPH)为原料。通过超滤和凝胶色谱分离其活性肽组分,对酶解液及各分离组分进行抗氧化活性研究,并对抗氧化能力最高的组分进行氨基酸分析。结果表明:通过超滤将RPH分离成4 组不同分子质量范围的多肽组分,其中RPH-P4(分子质量<3 kD)具有最高的抗氧化活性;RPH-P4经Sephadex G-15凝胶柱分离后得到3 个洗脱峰,收集并测定其活性,研究发现RPH-P4-S3抗氧化能力远高于其他2 个组分(P<0.05),氧自由基吸收能力(oxygen radical absorbance capacity,ORAC)、细胞抗氧化活性(cellular antioxidant activity,CAA)、细胞内CAA实验的EC50值分别为(1 951.90±20.35) µmol TE/g、(143.38±4.11) µmol QE/g、(45.63±3.67) µg/mL;对RPH-P4-S3进行了氨基酸分析,发现其抗氧化性氨基酸含量达到72.90%,必需氨基酸含量为53.52%。研究认为,菜籽蛋白Alcalase 2.4L酶解物分离组分RPH-P4-S3具有较高的抗氧化活性及营养价值,可以作为功能性成分用于抗氧化相关的功能食品和保健品的开发。
关键词:菜籽多肽;抗氧化能力指数;细胞抗氧化能力;氨基酸分析
引文格式:
张晶, 张怡一, 徐斐然, 等.菜籽多肽体外和细胞内抗氧化性评价及氨基酸分析[J].食品科学, 2016, 37(13): 36-41.
ZHANG Jing, ZHANG Yiyi, XU Feiran, et al.Antioxidant activities in vitro and in cells and amino acid composition of rapeseed peptides[J].Food Science, 2016, 37(13): 36-41.(in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201613007. http://www.spkx.net.cn
生物体在有氧呼吸过程中会产生多种自由基,主要有超氧自由基(O·)、羟自由基(·OH)、过氧化氢(H2O2)和单氧离子(O)等[1]。Harman的自由基理论表明,细胞中过量的自由基累积会破坏蛋白质结构,使DNA变异,同时促使细胞膜脂质氧化,最终导致组织器官的老化[2]。研究发现,自由基造成的氧化损伤与冠心病、衰老、肿瘤等许多疾病有关[3-5],而体内过多的自由基则可以通过补充外源性的具有抗氧化活性的物质来清除,从而减少自由基对人体的氧化损伤,延缓人体的衰老[6];此外,自由基造成的氧化反应会降低食品品质,影响食品的风味和组织性状,破坏食品营养和食品体系的稳定性。抗氧化剂的种类很多,然而人工合成的抗氧化剂如二丁基羟基甲苯(butylated hydroxytoluene,BHT)、丁基羟基茴香醚(butyl hydroxy anisd,BHA)、没食子酸丙酯(propyl gallate,PG)等具有许多潜在的危害,可能会对人体产生不良的影响,因此在食品中添加此类抗氧化剂需要严格的监管。与此相反的是,天然抗氧化剂来源于食物,成分安全,更容易被消费者接受[7]。大量研究表明,许多动物或植物蛋白水解物(多肽)具有清除自由基和抑制脂质过氧化的能力,如Bougatef等[8]从沙丁鱼下脚料酶解物中分离得到的抗氧化肽,经测定具有较高的1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除率。He Rong等[9]研究显示Alcalase 2.4L蛋白酶和K蛋白酶酶解菜籽蛋白得到的产物具有良好的抗氧化效果。由此可知,由蛋白酶解制备得到的抗氧化肽可以作为一种新型的功能性食品添加剂、食品及化妆品中的防腐剂等,具有良好的开发应用前景。
油菜是世界第二大油料作物,仅次于大豆,而我国的油菜种植面积及产量均居世界第一位,是世界上最大的油菜生产国[10]。油菜籽去油后得到的菜籽粕中含有35%~50%的蛋白[11]。菜籽蛋白几乎不存在限制性氨基酸,营养价值高,且赖氨酸、半胱氨酸、蛋氨酸含量较高,是一种全价优质的植物蛋白[12-13]。Wolfe等[14]在2007年首次提出了建立细胞模型评价物质的抗氧活性的方法——细胞抗氧化活性(cellular antioxidant activity,CAA),该方法成本低,效率高,能更准确地反映抗氧化剂的吸收代谢等变化情况。本实验采用超滤、Sephadex G-15对菜籽粗肽(rapeseed protein hydrolysate, RPH)进行分离纯化,并研究了不同分离组分的氧自由基吸收能力(oxygen radical absorbance capacity,ORAC)及体内CAA,筛选出抗氧化性较高的组分,并对其进行氨基酸分析,确定组分中氨基酸组成,为后续菜籽抗氧化肽的机理及结构提供了一定的基础。
1 材料与方法
1.1 材料与试剂
菜籽粉,油菜籽脱壳、脱油并粉碎过筛。
Sephadex G-15凝胶填料 美国GE公司;荧光物质FL(fluorescein sodium salt)、自由基产生剂2,2'-偶氮(2-甲基丙基脒)(2,2'-azobis-2-amidinopropanedihydrochloride,AAPH)、抗氧化标准物质水溶性VE(6-hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid,Trolox)、二甲基亚砜(dimethyl sulfoxide,DMSO) 美国Sigma公司;胎牛血清(fetal bovine serum,FBS) 美国Gibco公司;四甲基偶氮唑蓝(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl tetrazolium bromide,MTT)、Hank's平衡盐溶液(Hank's balanced salt solution,HBSS)、双抗(青霉素10 000 µg/mL,链霉素10 000 µg/mL)、DMEM高糖培养基、胰蛋白酶消化液(0.25%) 北京Solarbio科技有限公司;HepG2人体肝癌细胞 上海细胞库;其他试剂均为分析纯。
1.2 仪器与设备
Beckman Coulter J6冷冻离心机 美国Beckman Coulter公司;FreeZone 2.5L台式冷冻干燥机 美国Labconco公司;Millipore Pellicon XL小型超滤装置美国Merck Millipore公司;SpectraMax M2e酶标仪美国Molecular Devices公司;HL-2B恒流泵、HD-3紫外检测仪、BSZ-100自动收集器 上海沪西分析仪器厂;3057-II型便携式记录仪 重庆川仪速达机电有限公司;HERACELL 150i二氧化碳培养箱、MSC-Advantage-1.2生物安全柜 美国Thermo Scientifc公司;L-8900型氨基酸分析仪 日本Hittachi公司。
1.3 方法
1.3.1 菜籽粗肽的制备
参照文献[15]的制备方法并进行了一定的修改。将菜籽粉溶解于去离子水中(料液比1∶20,m/V),并调节pH值至11.0,室温搅拌1 h后5 000×g离心20 min。收集上清液,并调pH值为4.5,静置1 h,5 000×g离心20 min,收集沉淀并用无水乙醇洗涤2~3 次。将沉淀重新溶解于去离子水中,调pH值为7.0,冷冻干燥即得菜籽蛋白。将菜籽蛋白溶解于去离子水中,调节溶液的pH值为9.0,温度为50 ℃,然后加入Alcalase 2.4L碱性蛋白酶(2∶100,[E]/[S])酶解5 h。酶解过程中需维持pH值不变,反应结束后95 ℃水浴灭酶10 min,10 000×g离心30 min,收集上清液,冷冻干燥即为RPH。
1.3.2 抗氧化能力指数ORAC分析
采用经修改的抗氧化能力指数ORAC的方法测定各分离组分的抗氧化能力[16-17]。首先将各分离组分用75 mmol/L的磷酸盐缓冲液(pH 7.4)进行稀释,反应在96 孔板中进行,每个孔中含有20 µL 0.02 mg/mL样品溶液或20 µL一定质量浓度梯度的Trolox标准品,再加入200 µL的Fluorescein(0.96 μmol/L),在37 ℃条件下温育20 min,然后在每个孔中加入20 µL偶氮类化合物AAPH(119 mmol/L),设定酶标仪的激发波长为485 nm,释放波长为520 nm,每5 min测定一次。ORAC值以每克样品等同于Trolox当量(Trolox equivalent,TE)的微摩尔数表示,单位为µmol TE/g。
1.3.3 HepG2细胞毒性实验
采用经修改的MTT方法测定细胞毒性[18]。首先取对数生长期细胞计数并配制成105个/mL的细胞悬液。加入100 µL细胞悬液到96 孔板各内孔中,外孔各加入100 µL PBS,放置于CO2细胞培养箱中37 ℃、5% CO2条件下培养24 h。吸弃旧培养液,在每个细胞培养孔中加入100 µL不同溶度样品并设置复孔。培养24 h后,每孔中加入质量浓度为5 mg/mL的MTT,培养4 h。吸弃旧培养液,每孔加入150 µL的DMSO,37 ℃恒温振荡30 min。置于酶标仪中570 nm波长处测定OD值。对照组以相同体积的细胞培养液代替样品溶液。细胞存活率计算见下式。
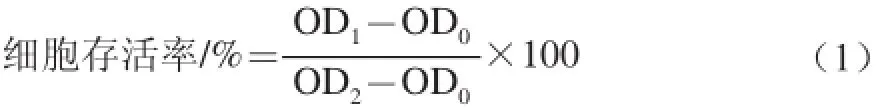
式中:OD0为空白组光密度值;OD1为实验组光密度值;OD2为对照组光密度值。
1.3.4 细胞内CAA实验
采用CAA方法测定细胞内抗氧化活性,参照文献[19]并进行了一定的修改。取对数生长期的HepG2细胞接种于96 孔板中,接种密度104个/孔,细胞悬液加入量为100 μL,于37 ℃、5% CO2条件下培养24 h。吸弃旧培养液,用PBS清洗一次,加入100 μL样品溶液(含25 μmol/L 的2',7'-二氯荧光黄双乙酸盐(2',7'-dichlorodihydrofluore scein diacetate,DCFH-DA)),培养1 h。吸弃旧培养液后,每孔加入100 μL AAPH溶液(浓度为600 μmol/L),迅速放置于酶标仪中读数,激发波长538 nm,发射波长485 nm,每5 min测定一次。CAA计算公式如下:

式中:∫SA为样品的曲线下积分面积;∫CA为对照组的曲线下积分面积。样品的半数有效浓度(EC50)以lg(ƒa/ƒu)对lgρ的中效原理来计算,这里ƒa表示样品作用效应(CAA unit),ƒu表示1-CAA unit,ρ为RPH的质量浓度/(mg/L)。EC50值以3 次平行实验计算得出,将EC50值转化为CAA值,以每克样品中相当于槲皮素的微摩尔当量(quercetin equivalent,QE)来表示,单位为µmol QE/g。
1.3.5 抗氧化肽的氨基酸组成分析
称取等量的样品分别加到2 支玻璃水解管中,加入6 mol/L的HCl溶液,在减压状态下使用酒精喷灯迅速封管,在110 ℃条件下水解24 h。反应结束后打开水解管,待水解液冷却后过滤浓缩并用0.02 mol/L的盐酸溶液溶解,然后用去离子水定容至50 mL。收集上清液过0.22 µm滤器,然后采用氨基酸分析仪进行分析。
1.3.6 菜籽抗氧化肽的超滤分离
取实验制得的菜籽蛋白酶解物用双蒸水配制成1 mg/mL的溶液,并依次通过截留分子质量为10、5、3 kD的超滤膜,超滤过程控制压力在0.10~0.22 MPa之间,分别收集<3、3~5、5~10、>10 kD各个分子质量段的透过液和酶解液,真空浓缩、冷冻干燥,称量不同分子质量肽段冻干粉的质量,并进一步分析各个分子质量段的菜籽粗品的抗氧化活性,筛选抗氧化活性最强的超滤膜分离组分。
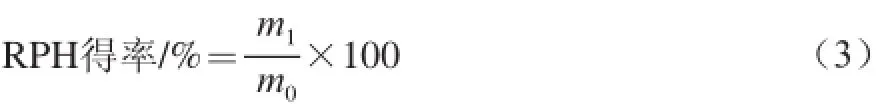
式中:m1为菜籽蛋白酶解物质量/mg;m0为原料蛋白质量/mg。
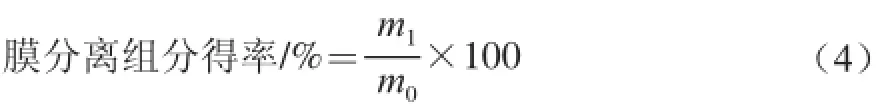
式中:m1为膜分离组分质量/mg;m0为RPH质量/mg。
1.3.7 凝胶过滤层析
用双蒸水将1.3.6节筛选出来的抗氧化活性最强的菜籽肽组分配成10 mg/mL的溶液,经0.22 μm微孔膜过滤后经过由恒流泵、层析柱、紫外检测器和自动部分收集器所组成的凝胶过滤分离层析系统,层析柱采用Sephadex G-15(1.6 cm×70 cm)。用去离子水(pH 7.0)为流动相洗脱样品,流速为60 mL/h,检测波长为280 nm,洗脱液自动部分收集,合并同一分离峰的洗脱液,真空浓缩并冷冻干燥后检测其抗氧化活性,选择抗氧化活性最强的组分进行液相色谱分离。
1.4 统计分析
2 结果与分析
2.1 菜籽抗氧化肽的超滤膜分析
2.1.1 超滤膜分离组分得率
RPH是由Alcalase 2.4L酶解菜籽蛋白5 h的产物,采用超滤分离技术将RPH分离得到4 个不同分子质量的菜籽肽组分。由表1可知,菜籽粗肽的得率达到73.41%,这说明碱性蛋白酶Alcalase 2.4L将大部分菜籽蛋白酶解成可通过离心来回收的菜籽多肽;同时,分子质量<3 kD (RPH-P4)的菜籽多肽约占总酶解物的46.32%,此结果与Girgih等[20]的研究相似,他们发现亚麻籽肽经超滤膜分离后,其中<3 kD的组分得率是其他各组分得率的3 倍。将不同超滤分离的肽段冷冻干燥保存,采用抗氧化能力指数ORAC和细胞抗氧化能力CAA的方法分别测定其体内及体外的抗氧化活性。

表1 RPH及其超滤膜分离组分得率Table 1 Yieldsof rapeseedpeptidefractions obtained fromultrafiltration组分 RPH >10 kD 5~10 kD 3~5 kD <3 kD得率/% 73.41 17.31 12.37 10.64 46.32
2.1.2 超滤膜组分的体外及体内抗氧化活性分析

如图1所示,不同超滤分离组分表现出不同的抗氧化活性,且差异性较大,其中<3 kD(RPH-P4)的ORAC值最高,为(1 547.89±34.57) µmol TE/g,其体外抗氧化性显著高于其他组分(P<0.05)。与其他相关研究相比,Alcalase 2.4L蛋白酶酶解菜籽蛋白得到的菜籽蛋白酶解物具有较高的氧自由基吸附能力。例如,郭洋[21]将蛋清蛋白酶解液超滤后测得<1 kD的组分具有最高的抗氧化活性,其ORAC为(674.76±15.54) μmol TE/g,而秋刀鱼蛋白酶解物的ORAC为883.40 TE/g[22]。
细胞毒性实验结果如图2所示,RPH及膜分离各组分中400 mg/L的质量浓度组显著抑制了HepG2细胞的增殖,组分RPH-P1和RPH细胞存活率在85%左右,其他组分细胞存活率为80%左右;当质量浓度为200 mg/L时,RPH-P2具有一定的细胞毒性。25~200 mg/L质量浓度范围内,除RPH-P2组分外,其他各组细胞存活率均达到90%以上,表明样品无明显的细胞毒性。因此,将上述实验质量浓度作为后续实验依据。
本实验细胞抗氧化能力的测定中不使用PBS清洗,即样品处理细胞后,不使用PBS清洗细胞孔,直接加入AAPH进行检测。如图3所示,菜籽蛋白酶解物及其膜分离组分细胞抗氧化能力CAA值及EC50值差异显著(P<0.05),其中<3 kD(RPH-P4)CAA值最高为(116.94±2.57) µmol QE/g,其EC50为(63.52±5.32) µg/mL。


2.2 菜籽抗氧化肽的凝胶色谱分析
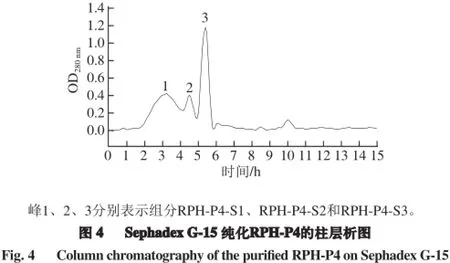
2.2.1 Sephadex G-15凝胶色谱分离
如图4所示,采用Sephadex G-15凝胶柱层析分离膜分离所得抗氧化活性最高RPH-P4的菜籽肽组分,洗脱流速为60 mL/h,检测波长为280 nm,按照洗脱时间和紫外检测的OD280 nm值作图,可以得到3 个洗脱峰。分别收集所得到的RPH-P4-S1、RPH-P4-S2、RPH-P4-S3这3 个主要的峰。将各段的洗脱液收集、冻干后,配制成0.02 mg/mL的多肽溶液,通过体外和体内细胞体系测定其抗氧化能力,并对活性最高组分进行氨基酸分析。
2.2.2 凝胶色谱分离组分的体外及体内抗氧化活性分析
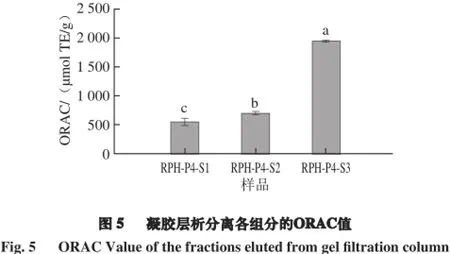
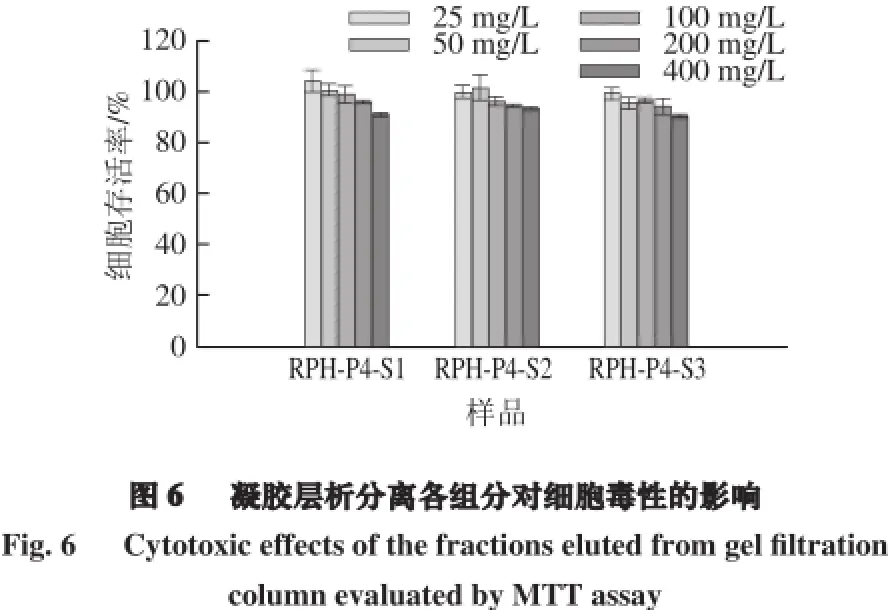

由图5可知,通过Sephadex G-15凝胶层析分离收集的各组分中,RPH-P4-S3抗氧化能力指数ORAC值为(1 951.90±20.35) µmol TE/g,显著高于其他两个组分(P<0.05)。王立峰等[23]通过Sephacryl S-100 HR凝胶柱层析分离菜籽蛋白酶解物,得到的组分3 ORAC值最高,达到(1 610.38±112.51) µmol TE/g。这说明本实验所得RPH-P4-S3具有较高的抗氧化活性。细胞毒性实验结果如图6所示,在25~400 mg/L质量浓度范围内,各组分的细胞存活率均达到90%以上,说明在此剂量范围内,菜籽蛋白酶解物本身对细胞基本毒性作用。在上述剂量范围内进行体内细胞抗氧化实验,结果如图7所示,RPH-P4-S3组分的CAA值为(143.38±4.11) µmol QE/g,EC50为(45.63±3.67) µg/mL。由此可以看出,菜籽蛋白酶解物具有较高的抗氧化活性。
2.2.3 氨基酸分析
通过ORAC和CAA实验结果可知,RPH-P4-S3具有最高的抗氧化活性,对其进行氨基酸分析。研究发现许多氨基酸及其衍生物具有抗氧化能力,例如Je等[24]通过研究牛蛙肉蛋白抗氧化肽发现酸性氨基酸(Asp和Glu)和碱性氨基酸(His、Arg、Lys)具有螯合金属离子的能力,含疏水性氨基酸(Tyr、Val、Phe、Ile、Leu和Pro)的肽链具有抑制脂质过氧化的能力等[25]。从表2可以看出,RPH-P4-S3中酸性氨基酸、碱性氨基酸、疏水性氨基酸的含量分别占总氨基酸含量的15.70%、22.90%、34.30%。这3 类抗氧化性氨基酸占总氨基酸含量的72.90%,由此可以推断该组分具有较强的抗氧化活性。此外,RPH-P4-S3中必需氨基酸含量占总氨基酸含量的53.52%,这说明该组分还具有较高的营养价值。
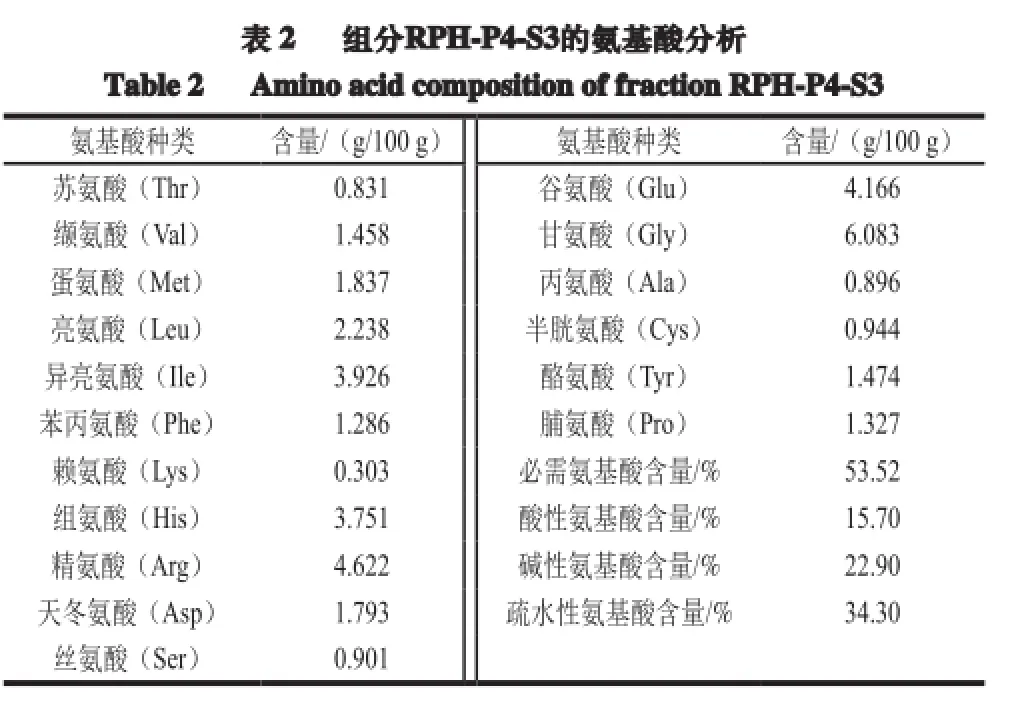
表 2 组分RPH-P4-S3的氨基酸分析Table 2 Aminoacid compositionof fractionRPH-P4-S3氨基酸种类 含量/(g/100 g) 氨基酸种类 含量/(g/100 g)苏氨酸(Thr) 0.831 谷氨酸(Glu) 4.166缬氨酸(Val) 1.458 甘氨酸(Gly) 6.083蛋氨酸(Met) 1.837 丙氨酸(Ala) 0.896亮氨酸(Leu) 2.238 半胱氨酸(Cys) 0.944异亮氨酸(Ile) 3.926 酪氨酸(Tyr) 1.474苯丙氨酸(Phe) 1.286 脯氨酸(Pro) 1.327赖氨酸(Lys) 0.303 必需氨基酸含量/% 53.52组氨酸(His) 3.751 酸性氨基酸含量/% 15.70精氨酸(Arg) 4.622 碱性氨基酸含量/% 22.90天冬氨酸(Asp) 1.793 疏水性氨基酸含量/% 34.30丝氨酸(Ser) 0.901
3 结 论
本实验了超滤及葡聚糖凝胶柱分离各组分的抗氧化能力,利用体外抗氧化能力指数(ORAC)和细胞内抗氧化能力(CAA)评价并筛选出抗氧化能力最高的组分。结果表明:通过超滤获得了较高抗氧化活性肽段RPH-P4(分子质量<3 kD)。组分RPH-P4利用Sephadex G-15凝胶层析进一步的分离纯化,最终得到强活性组分RPH-P4-S3,其ORAC值为(1 951.90±20.35) µmol TE/g,CAA值为(143.38±4.11) µmol QE/g,EC50为(45.63±3.67) µg/mL。由氨基酸分析可知RPH-P4-S3的抗氧化活性与其氨基酸组成有关,同时还具有较高的营养价值。因此,RPH-P4-S3可作为一种天然抗氧化剂应用于食品加工中,同时还可以作为功能性食品添加剂。
参考文献:
[1] JOHANSEN J S, HARRIS A K, RYCHLY D J, et al.Oxidative stress and the use of antioxidants in diabetes: linking basic science to clinical practice[J].Cardiovasc Diabetol, 2005, 4: 5-16.DOI:10.1186/1475-2840-4-5.
[2] HARMAN D.Aging: overview[J].Annals of the New York Academy of Sciences, 2001, 928: 1-21.DOI:10.1111/j.1749-6632.2001.tb05631.x.
[3] PYROR W A.Free radical biology: xenobiotics, cancer and aging[J].Annals of the New York Academy of Sciences, 1982, 393: 1-22.DOI:10.1111/j.1749-6632.1982.tb31228.x.
[4] LOMNITSKI L, BERGMAN M, SCHON I, et al.The effect of dietary vitamin E and β-carotene on oxidantion processes in the rat testis[J].Biochem Biophys Acta, 1991, 1082(1): 101-107.DOI:10.1016/0005-2760(91)90305-2.
[5] HARMAN D.Free radicals in aging[J].Molecular and Cellular Biochemistry, 1988, 84(2): 155-161.DOI:10.1007/BF00421050.
[6] 张君慧, 张晖, 王兴国, 等.抗氧化活性肽的研究进展[J].中国粮油学报, 2008, 23(6): 227-233.
[7] ARCAN I, YEMENICIOĞLU A.Antioxidant activity of protein extracts from heat-treated or thermally processed chickpeas and white beans[J].Food Chemistry, 2007, 103(2): 301-312.DOI:10.1016/ j.foodchem.2006.07.050.
[8] BOUGATEF A, NEDJAR-ARROUME N, MANNI L, et al.Purification and identification of novel antioxidant peptides from enzymatic hydrolysates of (Sardinella aurita) by-products proteins[J].Food Chemistry, 2010, 118(3): 559-565.DOI:10.1016/ j.foodchem.2009.05.021.
[9] HE R, ALASHI A, MALOMO S A, et al.Antihypertensive and free radical scavenging properties of enzymatic rapeseed protein hydrolysates[J].Food Chemistry, 2013, 141(1): 153-159.DOI:10.1016/ j.foodchem.2013.02.087.
[10] 张艳.菜籽饼粕蛋白酶法制备ACE抑制肽研究[D].武汉: 武汉工业学院, 2012.
[11] 王立峰, 袁建, 鞠兴荣, 等.双低油菜籽油脂加工副产品的研究现状与发展趋势[J].中国油脂, 2005, 30(9): 11-14.DOI:10.3321/ j.issn:1003-7969.2005.09.002.
[12] 刘大川.植物蛋白工艺学[M].北京: 中国商业出版社, 1993.
[13] 吴谋成, 袁俊华, 邵锦华, 等.油菜籽的综合加工和利用研究[J].华中农业大学学报, 1999, 18(6): 589-591.DOI:10.13300/j.cnki.hnlki.hnlkxb.1999.06.021.
[14] WOLFE K L, LIU R H.Cellular antioxidant activity (CAA) assay for assessing antioxidants, foods, and dietary supplements[J].Journal of Agricultural and Food Chemistry, 2007, 55(22): 8896-8907.DOI:10.1021/jf0715166.
[15] HE R, MALOMO S A, ALASHIl A, et al.Purifcation and hypotensive activity of rapeseed protein-derived renin and angiotensin converting enzyme inhibitory peptides[J].Journal of Functional Foods, 2013,5(2): 781-789.DOI:10.1016/j.jff.2013.01.024.
[16] WOLFE K L, KANG X M, HE X J, et al.Cellular antioxidant activity of common fruits[J].Journal of Agricultural and Food Chemistry,2008, 56(18): 8418-8426.DOI:10.1021/jf801381y.
[17] HUANG D J, OU B X, HAMPSCH-WOODILL M, et al.Highthroughput assay of oxygen radical absorbance capacity (ORAC)using a multichannel liquid handling system coupled with a microplate fourescence reader in 96-well format[J].Journal of Agricultural and Food Chemistry, 2002, 50(16): 4437-4444.DOI:10.1021/jf0201529.
[18] FELICE D L, SUN J, LIU R H.A modifed methylene blue assay for accurate cell counting[J].Journal of Functional Foods, 2009, 1(1): 109-118.DOI:10.1016/j.jff.2008.09.014.
[19] SONG W, DERITO C M, LIU M K, et al.Cellular antioxidant activity of common vegetables[J].Journal of Agricultural and Food Chemistry,2010, 58(11): 6621-6629.DOI:10.1021/jf9035832.
[20] GIRGIH A T, UDENIGWE C C, ALUKO R E.In vitro antioxidant properties of hemp seed (Cannabis sativa L.) protein hydrolysate fractions[J].Journal of the American Oil Chemists Society, 2011,88(3): 381-389.DOI:10.1007/s11746-010-1686-7.
[21] 郭洋.高活性蛋清抗氧化肽组分优选及其增效技术研究[D].长春:吉林大学, 2012.
[22] 赵强忠, 刘丹.秋刀鱼抗氧化肽制备及其抗氧化活性的研究[J].现代食品科技, 2014, 30(10): 165-171.DOI:10.13982/ j.mfst.1673-9078.2014.10.028.
[23] 王立峰, 王玉梅, 张晶, 等.菜籽蛋白水解物(RPHs)体外和细胞内抗氧化性评价及氨基酸分析研究[J].食品科学, 2015, 21(5): 36-39.DOI:10.7506/spkx1002-6630-201413009.
[24] JE J Y, QIAN Z J, KIM S K.Antioxidant peptide isolated from muscle protein of bullfrog, Rana catesbeiana Shaw.[J].Journal of Medicinal Food, 2007, 10(3): 401-407.DOI:10.1089/jmf.2006.169.
[25] RIVAL S G, FORMAROLI S, BOERIU C G, et al.Caseins and casein hydrolysates.1.Lipoxygenase inhibitory properties[J].Journal of Agricultural & Food Chemistry, 2001, 49(1): 287-294.DOI:10.1021/ jf000392t.
国家农业成果转化计划项目(2014GB2C100318);江苏省产学研前瞻性联合研究项目(BY2016009-01);
江苏省高校自然科学基金项目(14KJB550004);江苏高校优势学科建设工程资助项目;
南京财经大学研究生科技创新计划资助项目
DOI:10.7506/spkx1002-6630-201613007 10.7506/spkx1002-6630-201613007. http://www.spkx.net.cn
中图分类号:TS201.4
文献标志码:A
文章编号:1002-6630(2016)13-0036-06
收稿日期:2015-09-12
基金项目:国家重点研发计划项目(2016YFD0401401);国家高技术研究发展计划(863计划)项目(2013AA102207);
作者简介:张晶(1990—),女,硕士研究生,研究方向为食品营养。E-mail:zj1032776604@163.com
*通信作者:王立峰(1977—),男,副教授,博士,研究方向为活性蛋白肽及植物多酚的开发。E-mail:wanglifeng_8@163.com
Antioxidant Activities in Vitro and in Cells and Amino Acid Composition of Rapeseed Peptides
ZHANG Jing, ZHANG Yiyi, XU Feiran, SHI Jiayi, JU Xingrong, WANG Lifeng*
(Collaborative Innovation Center for Modern Grain Circulation and Safety, Key Laboratory of Grains and Oils Quality Control and Processing, College of Food Science and Engineering, Nanjing University of Finance and Economics, Nanjing 210023, China)
Abstract:The rapeseed protein hydrolysate (RPH) obtained by enzymatic hydrolysis of double-zero rapeseed with Alcalase 2.4L was separated by ultrafiltration and gel filtration chromatography to produce active peptide fractions.The antioxidant activity of RPH and its active peptides was evaluated in vitro.Furthermore, the amino acid composition of the most potent antioxidant fraction was analyzed.The results showed that RPH was separated into 4 fractions in different molecular weight ranges.RPH-P4 (molecular weight < 3 kD) had the strongest antioxidant capacity among these peptide fractions.RPH-P4 was further separated by gel filtration on Sephadex G-15 into 3 peaks.The antioxidant capacity of RPH-P4-S3 was far higher than that of 2 other peaks (P < 0.05).Its oxygen radical absorbance capacity (ORAC) value was (1 951.90 ± 20.35) µmol TE/g sample, cellular antioxidant activity (CAA) value (143.38 ± 4.11) µmol QE/g sample, and EC50value (45.63 ± 3.67) µg/mL.The content of antioxidant amino acids in RPH-P4-S3 was as high as 72.90%, and the essential amino acid content was 53.52%.This research suggests that RPH-P4-S3, produced by enzymatic hydrolysis of double-zero rapeseed with Alcalase 2.4L, has high antioxidant activity and nutritional value and thus can be applied in the development of antioxidant-related functional foods and healthcare products as a functional ingredient.
Key words:rapeseed peptides; oxygen radical absorbance capacity; cellular antioxidant activity; amino acid analysis
