补气破瘀息风法联合多巴丝肼治疗血管性帕金森综合征疗效观察
2016-08-10王雅娟张秀敏
王雅娟,张秀敏,周 华
(河北省唐山市中医医院,河北 唐山 063000)
临床研究
补气破瘀息风法联合多巴丝肼治疗血管性帕金森综合征疗效观察
王雅娟,张秀敏,周华
(河北省唐山市中医医院,河北 唐山 063000)
[摘要]目的观察补气破瘀息风法联合多巴丝肼治疗血管性帕金森综合征的临床疗效。方法选择血管性帕金森综合征患者32例,随机分成观察组与对照组各16例。2组患者入院后均采取肌肉松弛康复、控制原发基础性疾病等基础治疗,在此基础上,对照组给予多巴丝肼片口服,观察组给予补气破瘀息风法联合多巴丝肼片口服,2组均以4周为1个疗程,共治疗2个疗程。观察2组治疗前后运动功能、非运动功能、日常活动质量变化情况,比较2组的临床疗效。结果治疗8周后,观察组运动功能总评分、非运动功能总评分均明显低于治疗前及同期对照组(P均<0.05)。2组日常活动质量均无明显改善,且组间比较差异无统计学意义。观察组治疗总有效率为81%,对照组为44%,2组比较差异有统计学意义(P<0.05)。结论补气破瘀息风法联合多巴丝肼片口服治疗血管性帕金森综合征疗效显著,可明显改善患者运动功能及非运动功能评分。
[关键词]补气破瘀息风法;多巴丝肼;血管性帕金森综合征
血管性帕金森综合征(Vascular parkinsonism,VP)的临床表现与帕金森病相似,是一种继发性的帕金森综合征,是由机体脑血管疾病如腔隙性脑梗死、淀粉样血管疾病等或其他因素如全身性低氧血症、药物、中毒等而导致的。近几年,随着医学影像技术以及解剖学的不断发展,有越来越多的证据表明血管高危因子是最终导致VP发生的基础性病因[1-2]。临床中最为常用治疗VP的药物是多巴丝肼,是苄丝肼和左旋多巴以1∶4混合的制剂,临床疗效相对于单纯左旋多巴要高,但长期使用疗效呈下降趋势,且会产生睡眠不良、焦虑、晨僵等诸多不良症状[3]。笔者比较了中医补气破瘀息风法联合多巴丝肼片与单纯多巴丝肼治疗血管性帕金森综合征患者的疗效,现报道如下。
1临床资料
1.1一般资料选择2013年2月—2015年1月来我院就诊的血管性帕金森综合征患者32例,西医学诊断参照我国神经科学会于1985年制定的帕金森疾病与帕金森综合征的临床诊断和鉴别标准及美国Winikates等学者在1999年发布的帕金森综合征临床诊断标准。中医学诊断符合我国中医学会在1992年发布的《中医老年颤证诊断与疗效评定标准》[4]中关于颤证的临床诊断。患者均有短暂性脑出血或者脑中风、高血压疾病史;血管性帕金林综合征病程或者病史在12周以上;脑MRI成像检查显示患者基底节区和/或半卵圆地带中心多发性腔梗;年龄18~75岁,均对本研究知情并愿意积极配合参加。排除标准:①伴发严重的肝脏、心脏、肾脏、脑部以及血液等部位原发病或者功能衰竭者,合并糖尿病、肿瘤、重度感染以及精神障碍性疾病者;②处于妊娠期或者哺乳期的女性患者;③存在神志不清、认知障碍以及其他可能影响疗效评估因素的患者;④原发帕金森疾病以及其他因素如脑外伤、药物、中毒等而导致的继发性帕金森综合征者;⑤脑卒中发生后,患者肢体处于痉挛状态者;⑥治疗期内使用了其他中药或西药治疗非基础性疾病者。按数表法分成2组:观察组男9例,女7例;年龄47~72(65.2±3.6)岁;病程(4.2±1.7)年(10个月~6年);Hoehn-Yahr分期Ⅰ~Ⅱ期7例,Ⅲ~Ⅳ期9例。对照组男10例,女6例;年龄46~73(66.1±3.3)岁;病程(4.1±1.5)年(11个月~6年);Hoehn-Yahr分期Ⅰ~Ⅱ期8例,Ⅲ~Ⅳ期8例。2组性别、年龄、病程以及疾病分期比较差异无统计学意义(P均>0.05),有可比性。
1.2治疗方法患者入院后均进行基础性治疗,包括采取基础肌肉松弛方法进行康复治疗,对原发基础性疾病进行控制治疗等,基础治疗所用药物均不含有补气破瘀息风的中药组成分。在此基础上,对照组采用多巴丝肼片(上海罗氏制药有限公司生产,国药准字H10930198)125 mg口服,3次/d;观察组采用多巴丝肼片与补气破瘀息风法联合治疗,多巴丝肼片用法用量同对照组,补气破瘀息风法自拟处方:黄芪30 g、党参20 g、当归20 g、山药20 g、生地15 g、熟大黄10 g、黄芩10 g、水蛭8 g、虻虫8 g、桃仁10 g、天麻15 g、石决明10 g、生龙骨10 g、僵蚕5 g、甘草5 g,1剂/d水煎取汁500 mL,分早晚2次服用。2组均以持续4周为1个疗程,共治疗2个疗程。
1.3观察项目根据我国中医药管理局1993年发布的《中药新药治疗颤病的临床研究指导》[5],选择运动功能、非运动功能(主要含有中医四诊合参的依据)以及日常活动质量作为评估指标,并评定临床疗效。
1.3.1运动功能评分采用国际通用的帕金森病综合评价量表(Unified Parkinson disease Rating Scale,UPDRS)[6]中“运动功能”分量表,分别于治疗前、治疗4周、治疗8周时对2组进行评分。运动功能评价共有14个条目,每个条目采取0~4分计分法,总评分越高则患者运动功能越差。
1.3.2非运动功能评分分别于2组治疗前、治疗4周、治疗8周时进行非运动功能症状评分。非运动功能主要为中医学体征以及相关主症,包括流涎、畏寒肢冷、言语謇涩、小便频数、腰腿酸痛、大便干结、头晕、油汗、多汗等9项,根据《中医老年颤证诊断和疗效评定标准》[4]中的计分原则,每项主症评分为无(0分)、轻微(1分)、中度(2分)、重度(3分),积分越高症状越严重。
1.3.3日常活动质量评分采用UPDRS中“日常活动”分量表,分别于2组治疗前、治疗8周时指导患者进行评分。该部分共有13个条目,每个条目采取0~4分评价法,总评分越高,表明患者的日常活动质量越差。
1.3.4临床疗效治疗8周后对2组患者进行疗效判定,采用尼莫地平法,疗效指数=(治疗前运动功能症状评分-治疗后运动功能症状评分)/治疗前运动功能症状评分×100%。基本痊愈:疗效指数>90%;明显改善:疗效指数>45%~90%;缓解:疗效指数>15%~45%;无效:疗效指数>-15%~15%;恶化:疗效指数≤-15%。基本痊愈+明显改善+缓解计为总有效。
2结果
2.12组治疗前后运动功能评分比较治疗前,2组患者运动功能总评分比较差异无统计学意义(P>0.05);治疗8周观察组患者运动功能总评分明显低于治疗前及对照组(P均<0.05)。见表1。
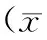
表1 2组治疗前后运动功能总评分比较±s,分)
注:①与治疗前比较,P<0.05;②与对照组比较,P<0.05。
2.22组治疗前后非运动功能评分比较治疗前,2组非运动功能症状评分比较无统计学意义(P>0.05);治疗4周、8周时,观察组非运动功能症状评分均明显低于治疗前及同期对照组(P均<0.05)。见表2。
2.32组治疗前后日常活动质量评分比较2组治疗前后日常活动质量评分比较差异无统计学意义(P均>0.05)。见表3。
2.42组临床疗效比较治疗8周后,2组明显改善率及总有效率比较差异均有统计学意义(P均<0.05)。见表4。治疗期间2组均未出现病情恶化或死亡者。观察组1例复发,对照组2例复发。
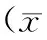
表2 2组治疗前后非运动功能评分比较 ±s,分)
注:①与治疗前比较,P<0.05;②与对照组比较,P<0.05。
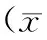
表3 2组治疗前后日常活动质量评分比较±s,分)

表4 2组临床疗效比较 例(%)
注:①与对照组比较,P<0.05。
2.5药物安全性比较2组用药期间血尿常规以及肝肾功能等均无未发现异常波动,未出现明显药物不良反应。
3讨论
血管性帕金森综合征患者大多数伴有继发性黑质神经元突触以后的解剖结构破坏,患者纹状体中的多巴胺受体(DA2R)大多出现数量减少和功能降低,所以临床上若单纯补充外源性多巴胺,其疗效通常不理想,使用左旋多巴类药物对患者突触前多巴胺的反应性提高收效不大,因此导致大部分血管性帕金森综合征患者在运用左旋多巴药物治疗时疗效不满意[7]。因此,世界卫生组织将血管性帕金森综合征列入临床难治病种范畴[8]。
血管性帕金森综合征在祖国医学中通常归于老年“颤证”的范畴,其发病机制较为复杂,病程通常迁延、易反复,患者生活质量低下。目前主要认为颤证病机关键是本虚标实,本虚是气血两虚为本,久则迁延至肝肾,而标实主要以内风、顽痰、死血为主要致病因素,所以治疗上当以补气破瘀化痰息风为重点[9]。结合血管性帕金森综合征的症状特点是以震颤、僵直、拘痉为多见,确定以补气破瘀息风法来治疗血管性帕金森综合征是以上所述祖国医学病理机制为基础的。
本研究依据补气破瘀息风法而自拟方剂,方中重用黄芪、党参大补元气,当归补血活血,山药健脾化痰,生地、熟大黄、黄芩养血清热化痰,水蛭、虻虫、桃仁破瘀活血、天麻、石决明、生龙骨、僵蚕息风清热安神,甘草调和诸药,全方起到通补结合、祛瘀生新、缓中补虚之功效,虽有破瘀息风之品,然入选之药味多为品性柔和,且用量适当,同时兼有滋阴清热养血之效,故可适用于形体羸弱、腹胀、肌肤甲错、双目黯黑的五劳虚极、内有干血之病家[10]。此方由补气、破瘀、息风三部分药物组成,充分体现了攻补兼施、缓中补虚的治疗原则。本研究结果显示,观察组采取补气破瘀息风法联合多巴丝肼治疗后,患者运动功能总评分及非运动功能总评分均显著改善,且显著低于对照组,而2组日常活动质量均无明显变化;2组总有效率比较差异有统计学意义。
综上所述,采取补气破瘀息风法联合多巴丝肼治疗血管性帕金森综合征可以明显改善患者运动功能及非运动功能,临床疗效显著,值得在临床上推广应用。
[参考文献]
[1]Lee SJ,Kim JS,Lee KS,et al. The severity of leukoaraiosis correlates with the clinical phenotype of Parkinson’s disease[J]. Arch Geriatr,2009,49(2):255-259
[2]Thanvi B,Lo N,Robinson T. Vascular parkinsonism an important cause of parkinsonism in older people[J]. Age Ageing,2005,34(2):114-119
[3]司宏波. 帕金森病的药物治疗进展[J]. 中国医药指南,2014,12(14):60-61
[4]中华全国中医学会老年医学会. 中医老年颤证诊断和疗效评定标准[J]. 北京中医学院学报,1992,15(4):39-41
[5]中华人民共和国卫生部. 中药新药临床研究指导原则(第1辑)[M]. 北京:人民卫生出版社,1993:158-161
[6]陈生弟. 帕金森病[M]. 北京:人民卫生出版社,2006:254-259
[7]尚俊奎,陈帅,樊晓蕊. 血管性帕金森综合征研究进展[J]. 国际神经病学神经外科学杂志,2013,40(5):470-473
[8]Winikate J,Jankovie J. Clinical correlate of vascular parkinsonism[J]. Arch Neurol,1999,56(1):98-102
[9]王雅娟,张秀敏. 溯本求源分析温阳逐瘀定帕汤治疗血管性帕金森综合征[J]. 成都中医药大学学报,2015,38(4):81-82
[10] 程云帆,毛琳,蒋小玲. 中西医结合治疗血管性帕金森综合征疗效观察[J]. 现代中西医结合杂志,2005,14(4):473-474
[基金项目]河北省中医药管理局立项课题(2013118)
doi:10.3969/j.issn.1008-8849.2016.21.011
[中图分类号]R742.5
[文献标识码]B
[文章编号]1008-8849(2016)21-2316-03
[收稿日期]2016-01-20
