小续命汤有效成分组对局灶性脑缺血/再灌注大鼠恢复早期的神经保护作用研究
2016-08-10贺晓丽王月华杜冠华
路 畅,杜 肖,贺晓丽,王月华,杜冠华
(中国医学科学院北京协和医学院 1.药用植物研究所,北京 100193;2.药物研究所,北京 100050)
小续命汤有效成分组对局灶性脑缺血/再灌注大鼠恢复早期的神经保护作用研究
路畅1,杜肖1,贺晓丽1,王月华2,杜冠华2
(中国医学科学院北京协和医学院 1.药用植物研究所,北京100193;2.药物研究所,北京100050)
目的观察小续命汤有效成分组对局灶性脑缺血/再灌注大鼠恢复早期的神经保护作用。方法选用健康♂ SD大鼠,采用插线法制备大鼠右侧大脑中动脉缺血/再灌注(MCAO)模型,缺血2 h后实现再灌注。应用Zea-Longa′s级标准评分法评价动物脑缺血程度,将造模成功的大鼠随机分为模型组、小续命汤有效成分低、中、高剂量组和阳性药银杏叶提取物EGb 761组,以假手术大鼠作为对照组,术后1~14 d灌胃给药,每日1次。通过Zea-Longa′s级标准评分、改良神经功能缺损评分(mNSS)和转角实验(CT)等系列行为学评价手段,评测小续命汤有效成分组对局灶性脑缺血/再灌注大鼠不同恢复时期行为学的变化,每天1次,连续测定14 d;选用TTC染色法观察大鼠脑梗死体积百分比;采用分光光度法检测大鼠脑缺血半暗带和缺血核心区脑组织中脂质过氧化物丙二醛(MDA)含量和谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)、一氧化氮合酶(NOS)活性的变化。结果随着给药时间延长,与模型组相比,小续命汤有效成分组能够有效降低MCAO大鼠神经功能缺损评分,表现为MCAO大鼠行走趋于正常,平衡木上停留时间增长,感觉功能恢复,转角实验中MCAO大鼠向右转向的比率逐渐接近正常。自给药5 d起,与模型组相比,小续命汤有效成分组开始明显改善MCAO大鼠上述神经行为学表现,差异具有显著性(P<0.05,P<0.01)。并且小续命汤有效成分组能够明显降低术后5 d和14 d MCAO大鼠脑组织梗死体积百分比(P<0.01)。此外,小续命汤有效成分组能够明显减少MCAO大鼠缺血半暗带和核心区脑匀浆的MDA含量和降低NOS活力,提高SOD和GSH-Px活力。结论小续命汤有效成分组对局灶性脑缺血/再灌注大鼠损伤恢复早期即产生神经保护作用,可能与调节脑内氧化-抗氧化平衡有关。
小续命汤有效成分组;脑缺血/再灌注;神经功能恢复;神经行为学评价;氧化应激;神经保护
脑卒中(stroke),又称脑中风,是一种突然起病的脑血液循环障碍性疾病。据报道,2.3亿患有心脑血管疾病的中国患者中,缺血性脑卒中患者达66.4%[1]。该病常常在无症状的情况下剥夺人独立生活的能力,其发病率、致残率、死亡率和复发率之高,使之成为全球关注的健康难题,且将在未来20年中给世界尤其是发展中国家患者带来更沉重的负担[2]。
中药复方小续命汤是中医从外风论治疗缺血脑卒中的经典有效方剂[3]。理论上,中药复方小续命汤通过其多途径、多靶点的治疗手段,针对缺血性脑卒中复杂的病理环节具有独特的优势和临床疗效[4]。小续命汤有效成分组包含中药复方小续命汤中所有与其治疗脑缺血损伤密切相关的药理活性组分[5]。前期研究结果显示,大鼠术前5 d预防给予小续命汤有效成分组,能够对持续性大脑中动脉缺血大鼠产生保护作用,其作用机制可能与调节脑内氧化-抗氧化平衡有关[6]。
目前,在抗脑缺血药物评价中,对脑缺血损伤引起的神经功能障碍和后期神经功能恢复关注度较低,这是致使一些在临床前动物实验中具有很好疗效的药物,在临床实验中却大都以失败告终的原因之一[7]。因此,基于上述考虑,并结合实际的临床用药,我们建立短暂性大脑中动脉缺血/再灌注大鼠模型,术后给予小续命汤有效成分组,从多种神经功能评价指标入手,探讨其对局灶性脑缺血/再灌注损伤大鼠恢复早期的神经保护作用。
1 材料
1.1实验动物健康Sprague-Dawley (SD) ♂大鼠153只,体质量230~250 g,购于北京华阜康生物科技股份有限公司,许可证号:SCXK(京)2014-0004,饲养于中国医学科学院药用植物研究所无特殊病原体(specific pathogen free,SPF)级动物房,自由饮水和摄食。
1.2药品与试剂小续命汤有效成分组(XXMD)由中国医学科学院药物研究所筛选中心提供;银杏叶提取物EGb 761(金纳多片,其中银杏黄酮苷占24%,萜类内酯占6%),由德国威玛舒培博士药厂生产;2,3,5-氯化三苯基四氮唑(2,3, 5-triphenyltetrazoliumchloride,TTC),购自Sigma公司;丙二醛(MDA)试剂盒、谷胱甘肽过氧化物酶(GSH-Px)测试盒、超氧化物歧化酶(SOD)测定试剂盒和一氧化氮合酶(NOS)测定试剂盒均购于南京建成生物工程研究所。
2 方法
2.1大鼠大脑中动脉阻塞(MCAO)模型制备SD大鼠经适应性喂养后,将大鼠禁食12 h,自由饮水。戊巴比妥钠(50 mg·kg-1)腹腔注射麻醉SD大鼠,采用线栓法制备MCAO模型[8]。血流阻断2 h后,拔出线拴,形成再灌注。假手术组大鼠只分离血管,不插入线拴。
2.2模型成功的判定按照Zea-Longa’s级标准评分法[9]对大鼠进行神经功能评分,评分等级为0~4分,分值越高,神经功能损伤越严重。
术后动物清醒和24 h,分别对大鼠进行行为学评分。评分均在1~3分者为造模成功,评分为0分、4分以及生命体征不平稳的动物弃之不用。
2.3动物分组及给药将模型成功的大鼠按体重随机分为5组:MCAO模型组(Model group)、XXMD低剂量组(XXMD-L,75 mg·kg-1)、XXMD中剂量组(XXMD-M,150 mg·kg-1)、XXMD高剂量组(XXMD-H,300 mg·kg-1)以及阳性药银杏叶提取物EGb 761组(150 mg·kg-1),以假手术组(Sham group)为对照组。
短暂性MCAO模型,给药时间设定在再灌注24 h,之后每天1次灌胃给药,连续给药14 d。小续命汤有效成分组和银杏叶提取物组均用0.5%羧甲基纤维素钠配置。假手术组与模型组给予等体积的溶剂对照。
2.4神经行为学恢复评分我们采用多种行为学评分方法,包括Zea-Longa’s级标准评分[9]、改良神经功能缺损评分(modified neurological severity scores,mNSS)[10]和转角实验(corner test,CT)[11],评估XXMD对缺血/再灌注大鼠神经功能恢复的影响。此检测在术前1 d和术后1~14 d分别进行,每天1次,实验固定在同一时间完成。
2.4.1Zea-Longa’s级标准评分见2.2。
2.4.2mNSS评分这是一个综合评价实验动物运动、感觉、平衡和反射水平的评分方法,全面反映出动物的神经系统功能等级,广泛应用于脑缺血动物神经功能评价[10]。mNSS总分18分,其中轻度损伤为0~6分,中度损伤为7~12分,重度损伤为13~18分,神经功能损伤程度随分值增大而加重。
2.4.3转角试验转角实验,能够评价缺血/再灌注大鼠胡须刺激和转向能力,测定大鼠的感觉运动功能。两块(60×40×1) cm3的木板固定成30°角,将SD大鼠面向夹角放在木板间,大鼠会向前行走,遇到阻碍后转向朝外走。观察并记录重复10次大鼠的转向方向,计算出大鼠向右转向的比率。
2.5脑梗死体积测定采用TTC染色法测定大鼠脑组织梗死体积,此实验是在行为学检测出现明显改变后进行,以进一步确定XXMD对脑缺血大鼠发挥神经保护作用的时间点。分别在给药d 5和d 14行为学实验结束后断头处死大鼠,进行TTC染色[8]。为了消除脑水肿的影响,大鼠脑梗死体积百分比以如下公式计算。
脑梗死体积百分比(BIVP)/%=(梗死对侧正常脑组织面积-梗死侧正常脑组织面积)/梗死对侧正常脑组织面积×100%
2.6脑组织(缺血核心区和半暗带区)氧化应激指标的测定给药5 d时,通过测定脑组织匀浆中MDA含量、GSH-Px 、SOD 和NOS活性来反映小续命汤有效成分组对缺血/再灌注大鼠脑组织氧化应激的影响。将大鼠断头取脑,冰冷的生理盐水漂洗,去除小脑、低位脑干和血管。应用大鼠模具,在距离额叶前端3 mm和9 mm处分别进行冠状切片(依据脑组织梗死灶大小可适当调整切片位置),取中间的脑组织块,将右侧缺血的大脑半球沿矢状缝侧2 mm处做矢状切片(弃去),剩余的脑组织即为缺血核心区和半暗带区[12]。然后,准确称取脑组织重量,按照重量(g) ∶体积(mL)=1 ∶9的比例加入相应体积的预冷的生理盐水,冰浴充分研磨后,3 000 r·min-1离心10 min,制备成10%的匀浆上清液备用。严格按照试剂盒说明书进行上述指标的操作。
3 结果
3.1MCAO模型的验证MCAO模型的稳定建立是本实验进行的基础。经过多次练习,预实验中,缺血/再灌注24 h后,MCAO模型成功率为82.35%,动物死亡率为15%,经TTC染色,脑梗死体积百分比为(50.64±8.19)%。这与相关文献报道相符[8],因此,我们认为SD大鼠MCAO模型建立成功,可以开展后续实验。

Tab 1 Five grades standard scores by Zea-Longa
3.2小续命汤有效成分组对MCAO大鼠体重的影响与假手术组相比,模型组大鼠的体重有明显的下降;随着给药时间的延长,各组大鼠的体重均有不同程度的提高。如Fig 1所示,自给药d 2开始,与模型组相比,小续命汤有效成分组高剂量组大鼠体重有所提高(P<0.05);自给药d 6开始,与模型组相比,小续命汤有效成分组(75、150、300 mg·kg-1)和阳性药银杏叶提取物组的大鼠体重均出现明显提高(P<0.05)。本实验结果显示,小续命汤有效成分组能够促进缺血/再灌注大鼠恢复体重。

Fig 1 Effect of XXMD(75~300 mg·kg-1)

*P<0.05,**P<0.01vssham group;#P<0.05,##P<0.01vsmodel group.
3.3小续命汤有效成分组对MCAO大鼠神经功能评分的影响脑缺血/再灌注大鼠出现不同程度的行为学损伤和神经功能障碍,手术大鼠表现为右侧Horner症,提尾时大鼠左前肢屈曲内收,行走时向左侧转圈,假手术大鼠表现正常。与模型组相比,随着给药时间的延长,小续命汤有效成分组和阳性药银杏叶提取物组的大鼠行为学障碍有明显改善。mNSS综合评分结果显示,自给药d 4开始,与模型组相比,小续命汤有效成分组中剂量组(150 mg·kg-1)大鼠行为学有明显改善(P<0.01);自给药d 5开始,与模型组相比,小续命汤有效成分组(75,150,300 mg·kg-1)和阳性药组的大鼠行为学均出现明显改善(P<0.05,P<0.01)。转角实验结果显示,自给药d 4开始,与模型组相比,小续命汤有效成分组中剂量组(150 mg·kg-1)大鼠行为学有明显改善(P<0.05);自给药d 6开始,与模型组相比,小续命汤有效成分组(75、150、300 mg·kg-1)和阳性药组的大鼠行为学均出现明显改善(P<0.05)。行为学实验结果表明,小续命汤有效成分组的中剂量组首先明显改善缺血/再灌注大鼠神经行为学损伤,对缺血/再灌注大鼠起到保护作用;小续命汤有效成分组各剂量组自MCAO术后5 d起,能明显改善缺血/再灌注大鼠上述神经行为学表现,与模型组相比差异具有显著性。见Fig 2。
3.4小续命汤有效成分组对MCAO大鼠脑梗死体积的影响TTC是能与组织中脱氢酶反应的脂溶性光敏感复合物,可通过染色检测动物组织中缺血梗死灶大小。经TTC染色,正常脑组织呈玫瑰红色,缺血梗死灶脱氢酶活性低,呈白色。行为学结果显示,小续命汤有效成分组各剂量组自MCAO术后5 d起,能明显改善缺血/再灌注大鼠神经行为学表现。因此,我们在缺血/再灌注后d 5、14 分别测定大鼠脑梗死体积,以进一步确定XXMD对脑缺血大鼠发挥神经保护作用的时间点。与假手术组相比,模型组大鼠脑组织均有明显的梗死灶。与模型组相比,给药5 d和14 d时,小续命汤有效成分组低、中、高剂量组及阳性药银杏叶提取物组均能明显降低大鼠脑梗死体积百分比(P<0.01)。其中,给药5 d和14 d时,小续命汤有效成分高剂量组降低MCAO大鼠脑梗死体积的效果最好,梗死范围缩小到33.27%和30.40%(P<0.01),结果见Fig 3。
3.5小续命汤有效成分组对MCAO大鼠脑组织氧化应激水平的影响大鼠右侧大脑缺血/再灌注造成脑组织能量耗竭和线粒体结构功能障碍,进而导致脑组织氧化和抗氧化水平失调。缺血/再灌注术后5 d时,缺血核心区和缺血半暗带脑匀浆中MDA含量、GSH-Px、SOD和NOS酶活力的测定结果如Fig 4所示。MCAO大鼠短暂缺血后,其脑组织MDA含量和NOS活力明显升高(P<0.01),GSH-Px和SOD活力明显下降(P<0.05,P<0.01)。而小续命汤有效成分给药组和阳性药EGb 761组能明显降低缺血/再灌注大鼠脑组织MDA含量(P<0.01,P<0.05),并且增加其SOD活力(P<0.01);小续命汤有效成分低、中剂量组和阳性药EGb 761组能够降低缺血/再灌注大鼠脑组织NOS活力(P<0.05);小续命汤有效成分低、中剂量组和阳性药EGb 761组能够明显提高缺血大鼠脑组织的GSH-Px活力(P<0.01,P<0.05)。

Fig 2 Effect of XXMD(75~300 mg·kg-1) on neurological deficit scores in rats following transient ±s,n=15~22)
A:Modified neurological severity scores(mNSS);B:Corner test(CT).*P<0.05,**P<0.01vssham group;#P<0.05,##P<0.01vsmodel group.
4 讨论
缺血性脑卒中是由多因素、多环节损伤所致的动态复杂的疾病,可大致分为缺血急性期、恢复期和后遗症时期。脑卒中急性期和恢复期的治疗,直接关系到患者的身体健康和生活质量。目前,临床上治疗急性脑卒中唯一安全有效的药物为溶栓药物—重组组织纤溶酶原激活物(tissue plasminogen activa-tor,t-PA)[13],但是t-PA的治疗时间窗为3~6 h,并且有严重的脑出血并发症,其使用受到严重限制[14]。中药大多通过挽救缺血半暗带区域尚有活力的神经组织,改善临床神经功能预后,发挥神经治疗作用,在脑卒中治疗中有明显优势。但在国内众多治疗脑卒中的中成药中,治疗脑血管病恢复期的药物寥寥无几。银杏叶提取物可通过调节脑循环和代谢发挥药效[15],用于治疗急慢性脑机能不全,对脑血管后遗症有较好疗效。中药复方制剂小续命汤针对缺血脑卒中复杂的病理环节具有独特的优势和临床疗效[4],在治疗脑卒中疾病中具有悠久的历史和广阔的前景,但其抗脑缺血损伤的机制尚不明确。小续命汤有效成分组是根据复方小续命汤的适应症和缺血脑卒中的病理机制应用多种手段筛选出的治疗脑缺血疾病的有效成分组[16]。

Fig 3 Effect of XXMD(75~300 mg·kg-1) on cerebral infarct in rats following transient ±s,n=5)
A:Representive ischemic lesions in the coronal slices with TTC staining on POD 5;B:Representive ischemic lesions in the coronal slices with TTC staining on POD 14;C:The volume percentage of cerebral infarct of rats in different groups.**P<0.01vssham group;##P<0.01vsmodel group.
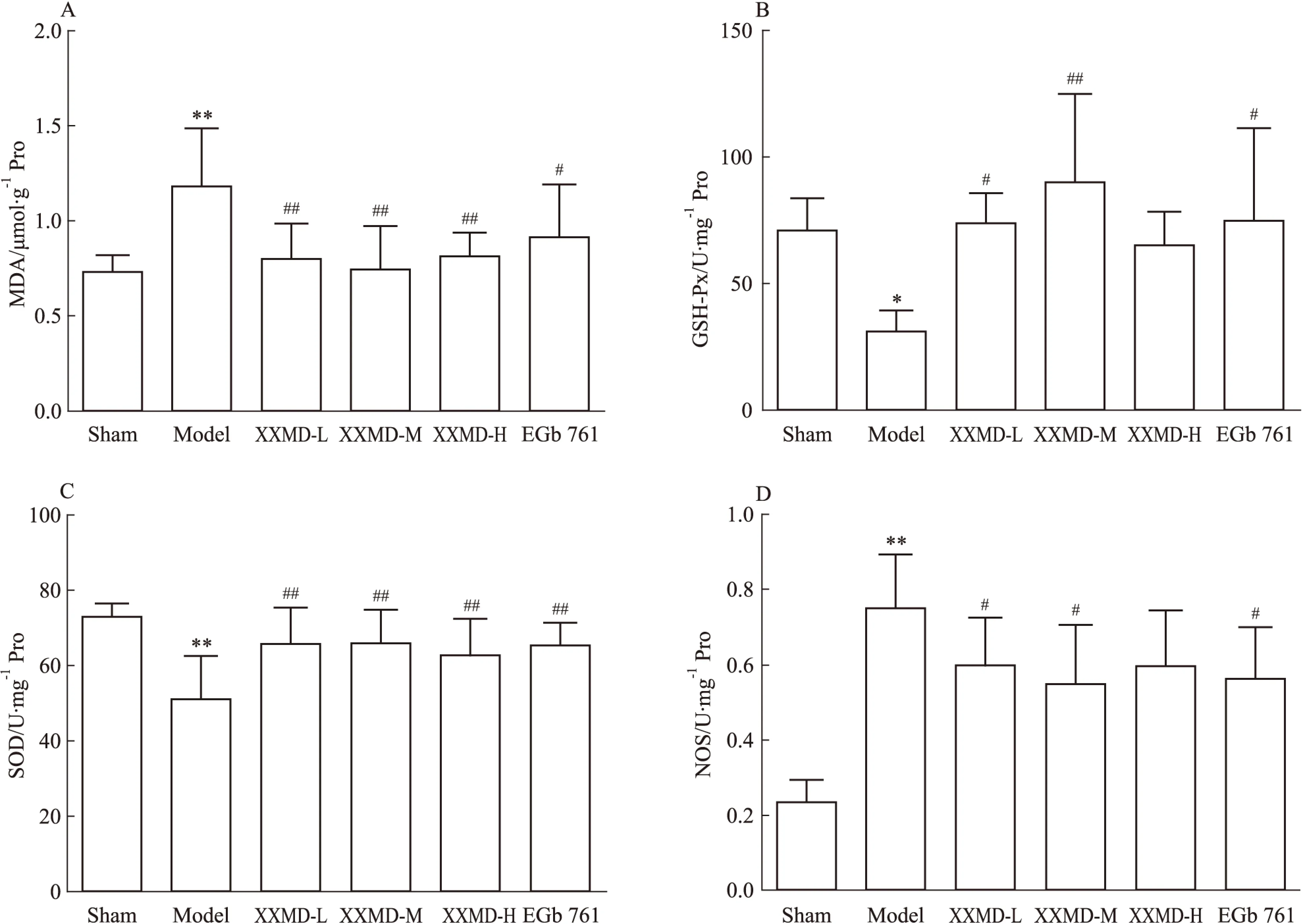
Fig 4 Effect of XXMD on content of MDA, enzyme activities of GSH-Px,SOD and NOS in ischemic core area and penumbra tissues of MCAO ±s,n=5)
世界卒中组织(WSO)强调评价药物最终临床疗效的重要指标之一是神经行为学功能恢复检测,因为这既是影响患者生活质量的重要问题,更关系到医药学界治疗脑卒中药物临床前研究和临床研究的顺利衔接[17]。基于上述考虑,我们在MCAO术后24 h首次给予小续命汤有效成分组,通过系列行为学评价手段来评测小续命汤有效成分组对局灶性脑缺血/再灌注大鼠神经功能障碍的恢复有无积极促进作用,探讨脑缺血后延迟给予小续命汤有效成分组治疗是否有效。实验结果显示,缺血后,大鼠表现为左侧前肢屈曲内收和/或行走时向左侧转圈的神经功能障碍。经过连续14 d神经行为学缺损评分,小续命汤有效成分组能够使大鼠的Horner症逐渐减轻,左前肢功能障碍减轻,平衡能力和感觉功能逐渐恢复,说明小续命汤有效成分组减轻了缺血/再灌注引起的神经功能损伤,且神经功能恢复程度与给药时间密切相关。其中自MCAO术后d 5起,与模型组相比,小续命汤有效成分组开始明显改善MCAO大鼠上述神经行为学表现,差异具有显著性。因此,我们在缺血/再灌注后d 5、14分别测定大鼠脑梗死体积,以进一步确定其对脑缺血大鼠发挥神经保护作用的时间点。综合本实验结果表明,给药5 d时,小续命汤有效成分各给药组的神经功能有明显恢复,脑梗死体积百分比明显降低,说明小续命汤有效成分组对缺血/再灌注损伤恢复早期即产生明显的保护作用。
大脑中动脉的缺血/再灌注导致脑组织ATP耗竭,线粒体结构和功能异常,产生大量的活性氧自由基(reactive oxygen species,ROS)[18],过量的ROS进一步促使线粒体膜通透性转换孔的开放,加速ROS大量生成[19],造成脑组织的氧化损伤,MDA含量增高。同时,过量的ROS破坏了内源性的还原物质,降低了GSH-Px和SOD的活力。脑组织缺血/再灌注病理进程中,NO既能促进恢复缺血半暗带区的供血,减少神经元细胞的死亡,又能促进ROS和脂质过氧化产物生成加重脑组织损伤[20]。NOS是催化O2和L-精氨酸合成NO的关键酶,NOS的活力与NO的生成量息息相关。本实验结果表明,给药5 d时,小续命汤有效成分组能够降低缺血/再灌注大鼠脑组织中缺血半暗带和核心区的MDA含量,提高其GSH-Px和SOD的活力,说明小续命汤有效成分组能够减轻缺血/再灌注脑组织的氧化应激损伤,促进维护脑组织内源性的抗氧化水平。同时,缺血/再灌注大鼠模型组脑缺血核心区和缺血半暗带组织T-NOS活性明显提高,各个给药组相应部位的T-NOS活力明显减小,说明小续命汤有效成分组可能通过降低缺血/再灌注脑组织的T-NOS活性来发挥保护作用。
综上所述,本研究证实了小续命汤有效成分组对局灶性脑缺血/再灌注大鼠损伤恢复早期即产生神经保护作用,能够明显促进MCAO大鼠神经功能的恢复,这可能与其调节脑内氧化应激水平有关。在此基础上,我们将对MCAO大鼠脑组织缺血半暗带和核心区进行系统的氧化-抗氧化水平研究,并且将对缺血/再灌注病理进程中尤为重要的细胞器—线粒体的相关机制展开进一步考察。
(致谢:本文实验是在中国医学科学院北京协和医学院药用植物研究所药理毒理中心贺晓丽副研究员的悉心指导和热忱鼓励下完成。在此,衷心的感谢我的导师贺晓丽副研究员,感谢您在实验中为我指点迷津,开拓思路,帮助我顺利完成实验和论文。同时,衷心的感谢师兄李凤金、宋维才、师姐张晓菲对我的鼓励和实验技能的指导,感谢师妹杜肖和同学胡亚在我实验和生活上的帮助和关心。)
[1]陈伟伟,高润霖,刘力生,等. 中国心血管病报告2013概要[J]. 中国循环杂志,2014, 29(7):487-8.
[1]Cheng W W,Gao R L,Liu L S,et al. A summary report of Chinese cardiovascular disease in 2013[J].ChinCircJ,2014,29(7):487-8.
[2]Kissela B M,Khoury J C,Alwell K,et al. Age at stroke:temporal trends in stroke incidence in a large,biracial population[J].Neurology,2012,79(17):1781-7.
[3]张丽瑛,陈少清,蔡树河. 小续命汤治疗缺血性脑卒中临床观察[J]. 中国医药指南,2011,9(30):149-51.
[3]Zhang L Y,Chen S Q,Cai S H. Clinical observation of Xiaoxuming decoction in treatment of acute ischemic stroke[J].GuideChinaMed,2011,9(30):149-51.
[4]Fu D L,Lu L,Zhu W Z,et al. Xiaoxuming decoction for acute ischemic stroke:A systematic review and meta-analysis[J].JEthnopharmacol,2013,148(1):1-13.
[5]杜冠华. 中药复方有效成分组学研究[J].中成药,2002,24(11):878-80.
[5]Du G H. Studies on effective component group of Chinese medicine prescription[J].ChinTraditPatMed,2002,24(11):878-80.
[6]王月华,贺晓丽,杨海光,等. 小续命汤有效成分组对局灶性脑缺血大鼠的作用[J]. 中国药学杂志,2012,47(3):194-8.
[6]Wang Y H,He X L,Yang H G,et al. Effects of the effective components group of Xiaoxuming decoction on MCAO rats[J].ChinPharmJ,2012,47(3):194-8.
[7]万东,祝慧凤,谢鹏,等. 梓醇促进脑缺血大鼠神经修复的行为学观察与评价[J]. 中国药理学通报,2012,28(9):1208-14.
[7]Wan D,Zhu H F,Xie P,et al. Obseversion and evaluation of a neurologic function recovery treatment with catalpol in rat after permanent middle cerebral artery occlusion[J].ChinPharmacolBull,2012,28(9):1208-14.
[8]叶瑞东. 人参皂甙 Rd 对缺血性脑损害的保护作用[D]. 西安:第四军医大学,2008.
[8]Ye R D. Neuroprotective effect of ginsenoside Rd against ischemic neuronal damage:aninvitroandinvivostudy[D]. Xi’an: Fourth Military Medical University,2008.
[9]Longa E Z,Weisntein P R,Carisoin S,et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[10]Chen J L,Li Y,Wang L,et al. Therapeutic benefit of intracerebral transplantation of bone marrow stromal cells after cerebral ischemia in rats[J].JNeurolSci,2001,189(1-2):49-57.
[11]Shen L H,Li Y,Chen J,et al. Intracarotid transplantation of bone marrow stromal cells increases axon-myelin remodeling after stroke[J].Neuroscience,2006,137(2):393-9.
[12]Ashwal S,Tone B,Tian H R,et al. Core and penumbral nitric oxide synthase activity during cerebral ischemia and reperfusion[J].Stroke,1998,29(5):1037-46.
[13]Radermacher K A,Wingler K,Langhauser F,et al. Neuroprotection after stroke by targeting NOX 4 as a source of oxidative stress[J].AntioxidRedoxSignal,2013,18(12):1418-27.
[14]Gropen T I,Gagliano P J,Blake CA,et al. Quality improvement in acute stroke:the New York State Stroke Center Designation Project[J].Neurology,2006,67(1):88-93.
[15]候晞,梁枫,李爱剑,等. 银杏叶提取物联合依达拉奉对气虚血瘀型脑缺血/再灌注大鼠血液学的影响[J]. 中国药理学通报,2010,26(8):1049-53.
[15]Hou X,Liang F,Li A J,et al. Effects of EGb combined with ED on hematology in cerebral ischemia reperfusion injury in rats with Qi deficiency and blood stasis[J].ChinPharmacolBull,2010,26(8):1049-53.
[16]王月华,张海霞,杜冠华,等. 小续命汤有效成分组的高通量筛选研究[J]. 中西医结合学报,2006,4(1):64-7.
[16]Wang Y H,Zhang H X,Du G H, et al. High-throughput screening assay for groups of effective components extracted from Xiaoxuming recipe[J].JChinIntegrMed,2006,4(1):64-7.
[17]杜万良. 2007年成人缺血性卒中早期治疗指南[J]. 中国卒中杂志,2007,2(7):614-21.
[17]Du W L. Guidelines for early treatment of ischemic stroke in adults in 2007[J].ChinJStroke,2007,2(7):614-21.
[18]Kuniyasu N,Hideyuki Y,Gab S K,et al. Mitochondrial and apoptotic neuronal death signaling pathways in cerebral ischemia[J].BiochimBiophysActa,2010,1802(1):92-9.
[19]Zorov D B,Juhaszova M,Steven J,et al. Mitochondrial reactive oxygen species(ROS)and ROS-induced ROS release[J].PhysiolRev,2014,94(3):909-50.
[20]Moro M A,Cardenas A,Hurtado O,et al. Nitric oxide and cerebral ischemic preconditioning[J].CellCalcium,2004,36(3-4):323-9.
Neuroprotective effect of active components of Xiaoxuming decoction on focal cerebral ischemia/reperfusion injury in rats during early recovery period
LU Chang1, DU Xiao1, HE Xiao-li1, WANG Yue-hua2, DU Guan-hua2
(1.InstituteofMedicinalPlantDevelopment,ChineseAcademyofMedicalSciencesandPekingUnionMedicalCollege,Beijing100193,China;2.InstituteofMateriaMedica,ChineseAcademyofMedicalSciences,Beijing100050,China)
AimTo explore the protective effect of active components of Xiaoxuming decoction(XXMD) on focal cerebral ischemia/reperfusion injury in rats during early recovery period.MethodsThe ischemia and reperfusion of middle cerebral artery model rats were established by nylon wire with 2 hours ischemic time on healthy male SD rats. The models of MCAO were evaluated by Zea-Longa′s standard score. The model rats were randomly divided into sham operation group, the ischemia/reperfusion model group, the active components group of Xiaoxuming decoction and the positive group (extract of ginkgo biloba leaves EGb 761). Rats were orally administrated with different drugs 24 h after operation for up to 14 days, once a day. The effect of active components of Xiaoxuming decoction on behavior changes of MCAO rats in different recovery period was evaluated by a series of behavioral assessent methods such as modified neurological severity scores and corner test. The infarct volume was observed by TTC staining. Moreover, the contents of MDA and the activities of GSH-Px, SOD and NOS in the penumbra and core tissues of rat brain were detected by spectrophotometric method.ResultsCompared with the I/R model group,the active components group of XXMD could significantly alleviate the neurological deficit scores with prolonged administration. The motion function tended to be normal, stayed longer on the balance beam, sensory function gradually restored sensitivity, reduced the radio of turning to the right. Among them, compared with model group, the active components of XXMD could effectively improve the neurological dysfunction after five days of administration(P<0.05,P<0.01). Meanwhile, the active components of Xiaoxuming decoction could significantly reduce the infarct volume percentage in the cerebral tissue on post operation day 5 and 14(P<0.01). In addition, the active components of XXMD could reduce the content of MDA and the activity of NOS, increase the activity of SOD and GSH-Px.ConclusionThe active components of XXMD can generate neuroprotective effect in early stage of recovery and may play a major role in regulating the level of oxidative stress in rat brain.
active components of XXMD; cerebral ischemia reperfusion; recovery of neurological function; neurological behavioral evaluation; oxidative stress; neuroprotective effect
2016-02-23,
2016-04-25
国家自然科学基金资助项目(No 81473586;81202192;81273654)
路畅(1989-),女,硕士生,研究方向:神经药理学,E-mail:lu890402@163.com;贺晓丽(1982-),女,博士,副研究员,硕士生导师,研究方向:神经药理学和抗肿瘤药理学,通讯作者,Tel:010-57833233,E-mail:xlhe@implad.ac.cn;杜冠华(1956-),男,博士,研究员,博士生导师,研究方向:神经药理学与新药发现,通讯作者,E-mail:dugh@imm.ac.cn
10.3969/j.issn.1001-1978.2016.07.011
A
1001-1978(2016)07-0938-07
R-332;R289.5;R322.81;R743.310.531
网络出版时间:2016-6-20 11:49网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160620.1149.022.html