益生菌对大鼠酒精性肝损伤的保护作用及机制研究
2016-08-10周治彤周晓彬王文成马爱国
梁 惠,吕 锐,傅 泳,周治彤,刘 颖,周晓彬,王文成,刘 曼,马爱国
(1. 青岛大学医学院医学营养研究所,山东 青岛 266021;2. 青岛大学医学院病原生物学实验室,山东 青岛 266071;3. 江南大学食品科学与工程,江苏 无锡 214122;4. 青岛大学医学院细胞与分子生物学实验室,山东 青岛 266071;5. 青岛大学医学院流行病学和卫生统计学教研室,山东 青岛 266021 )
益生菌对大鼠酒精性肝损伤的保护作用及机制研究
梁惠1,吕锐2,傅泳1,周治彤3,刘颖4,周晓彬5,王文成1,刘曼1,马爱国1
(1. 青岛大学医学院医学营养研究所,山东 青岛266021;2. 青岛大学医学院病原生物学实验室,山东 青岛266071;3. 江南大学食品科学与工程,江苏 无锡214122;4. 青岛大学医学院细胞与分子生物学实验室,山东 青岛266071;5. 青岛大学医学院流行病学和卫生统计学教研室,山东 青岛266021 )
目的探讨益生菌对大鼠酒精性肝损伤的保护作用。方法建立酒精性肝损伤模型,同时以碧悠益生菌发酵乳5×108CFU·kg-1·d-1灌胃干预,持续8周。HE染色观察各组大鼠肝组织病理学改变;透射电镜观察肝及小肠组织超微结构变化;酶法检测血清转氨酶及ALP活力;ELISA法检测血清DAO和D-LA水平;免疫组化法检测小肠组织FOXO4表达情况;16S rDNA高通量测序进行粪便肠道菌群结构分子生态学分析。结果益生菌干预使酒精诱导的肝脂肪变性得到明显缓解,肝及小肠组织超微结构亦得到不同程度改善,其病理学评分明显降低(P<0.05);同时,血清ALT、AST、ALP、DAO和D-LA水平均明显下降,小肠FOXO4表达明显提高(P<0.05)。益生菌干预在肠道菌群菌门、菌属水平均较酒精模型组有不同程度改变,丰度最高的前20个菌属与正常对照组一致率达到90%,对恢复肠道菌群多样性及丰度正常状态具有一定调节作用。结论益生菌对大鼠酒精性肝损伤具有一定保护作用,其作用机制可能与益生菌纠正肠道菌群结构紊乱,修复肠道屏障功能,改善肠道内环境有关。
益生菌;酒精性肝损伤;肠道屏障功能;肠道菌群;16S rDNA高通量测序;分子生态学
长期过量酒精摄入可导致肝功能异常和肝纤维化,而“肝肠轴”的存在,使肠道微生态紊乱及肠道屏障功能破坏成为酒精性肝损伤重要发病机制之一[1-2]。益生菌制剂是一类能促进肠道菌群生态平衡,对宿主健康有益的活体微生物制剂。1994年,Nanji[3]等首先发现乳酸菌Lactobacillus GG干预能够缓解酒精灌胃大鼠内毒素血症和肝损伤。此后,越来越多的证据表明,补充益生菌对酒精性损伤具有明显改善作用[4-5]。但目前从肠道菌群结构分子生态学角度系统探讨益生菌调节肠道菌群,改善酒精性肝损伤作用机制研究鲜有报道。本实验以碧悠益生菌发酵乳为干预物,观察其对大鼠酒精性肝损伤改善效果,同时采用Illumina宏基因组高通量测序技术[6]对肠道菌群16S rDNA进行测序分析,系统探讨益生菌调节肠道菌群,改善酒精性肝损伤分子生态学作用机制。
1 材料与方法
1.1主要试剂及仪器碧悠益生菌发酵乳,包含嗜热链球菌、保加利亚乳杆菌及乳双歧杆菌,其含量为1×1011CFU·L-1,由达能乳品销售(上海)有限公司提供;兔抗FOXO4多克隆抗体(北京博奥森生物技术有限公司);DAO、D-LA ELISA检测试剂盒(上海迪奥生物科技有限公司);细菌基因组DNA提取试剂盒(QIAgen)。肠道菌群基因组DNA样品16S rDNA高通量测序,委托上海生工生物工程股份有限公司完成。JEM1200EX透射电镜(JEOL);BioPhotometer plus6132型核酸蛋白检测仪(Eppendorf)。
1.2动物模型建立及分组SPF级♂ Wistar大鼠,体质量180~220 g,青岛市药品检验所提供,动物合格证号:SCXK(鲁)20090007。适应性喂养1周后,随机分为3组。正常对照组给予生理盐水灌胃,持续8周;酒精模型组给予56°红星二锅头灌胃,5.5 mL·kg-1·d-11周+7.5 mL·kg-1·d-11周+8.0 mL·kg-1·d-11周+9.0 mL·kg-1·d-11周+11 mL·kg-1·d-14周;益生菌干预组给予5×108CFU·kg-1·d-1灌胃,1 h后给予56°红星二锅头灌胃,剂量同酒精模型组,持续8周。末次灌胃后,采用代谢笼收集各组大鼠粪便各3~5粒,-80 ℃冻存备用。腹主动脉取血,摘取肝及小肠组织用于后续实验。
1.3肝组织病理学观察取肝组织(0.9 cm×0.9 cm×0.5 cm),体积分数为0.1的中性甲醛固定,常规石蜡包埋、切片,HE染色,中性树胶封片,光学显微镜下观察各组大鼠肝组织形态学改变。
1.4肝脏及小肠组织超微结构观察将肝脏及肠组织(1 mm3)分别于体积分数为0.025的戊二醛固定4 h,0.1 mol·L-1磷酸缓冲液漂洗,体积分数为0.01的锇酸固定1 h。磷酸缓冲液漂洗,丙酮逐级脱水,环氧树脂包埋,50~70 nm厚度切片,体积分数为0.03的醋酸双氧铀和柠檬酸铅染色,透射电镜观察。
1.5肝脏功能血清学指标检测采用赖氏法检测各组大鼠血清谷丙转氨酶(ALT)和谷草转氨酶(AST)活力,采用微量酶标法检测血清碱性磷酸酶(ALP)活力,操作步骤严格按试剂盒说明书进行。
1.6肠黏膜屏障功能血清学指标检测采用ELISA实验检测血清二胺氧化酶(DAO)和D-乳酸(D-LA)水平,操作步骤严格按试剂盒说明书进行。
1.7免疫组化实验检测小肠组织中FOXO4表达按照免疫组化SP试剂盒说明书对小肠组织切片进行免疫组化染色。每组切片随机选取50个视野,采用Simple PCI图像分析系统,于光学显微镜下观察小肠组织中叉头样转录因子O4(FOXO4)表达情况。对所测定组织的背底进行光密度值(OD)检测,定出标准作为参考值;通过手动选择阳性细胞及阳性区域,计算机数据自动统计系统计算出所测细胞平均光密度值。FOXO4表达阳性细胞以细胞核染色出现棕黄色颗粒为判断标准,OD值越大,表明FOXO4阳性表达越强。
1.8粪便肠道菌群16S rDNA高通量测序称取100 mg粪便样品,采用细菌基因组DNA提取试剂盒获得肠道菌群基因组DNA,将浓度及纯度检测合格的DNA样品送至上海生工生物工程股份有限公司,对16S rDNA V3~V4区域进行高通量测序,测序平台为Illumina Miseq 2×300,引物为341F,805R。使用Qiime、Muscle 3.8.31、MEGAN 5.7.1、RDP classifier、fasttree 2.1.3等多种软件对测序结果进行系统的肠道菌群结构分子生态学分析。

2 结果
2.1益生菌干预对大鼠肝脏组织病理学改变的影响结果显示,正常对照组大鼠肝小叶结构清晰,肝索呈放射状排列,肝细胞亦无明显脂肪变性。酒精模型组大鼠肝细胞肿胀,出现明显脂肪变性,胞质空泡化,可见炎性细胞浸润和坏死,其病理学评分较正常对照组明显升高(P<0.05)。益生菌干预组大鼠肝脏脂肪变性较酒精模型组明显得到改善,肝索排列较为整齐,组织结构趋向正常,肝脏病理学评分较酒精模型组明显降低(P<0.05)。见Tab 1,Fig 1。
2.2益生菌干预对大鼠肝脏组织超微结构的影响结果显示,正常对照组肝细胞核呈圆形或椭圆形,核膜完整,核仁清晰,线粒体形态正常,嵴结构清晰,粗面内质网结构正常,核糖体丰富,少见脂滴。酒精模型组肝细胞核呈不规则形,核膜不规则或模糊,脂滴增多。线粒体肿胀变形,嵴结构模糊,粗面内质网肿胀断裂,排列紊乱。益生菌干预组肝细胞核形态趋于正常,核膜完整,胞质脂滴数量减少,线粒体结构基本正常,病变明显减轻,粗面内质网退化与排列紊乱程度有所改善。见Fig 2。

Tab 1 Effect of probiotics on pathological observation of liver tissue in ±s)
*P<0.05vscontrol group;#P<0.05vsalcohol group

Fig 1 Pathological observation of liver tissue by HE staining in rats(×400)
A:Control;B:Alcohol;C:Probiotics
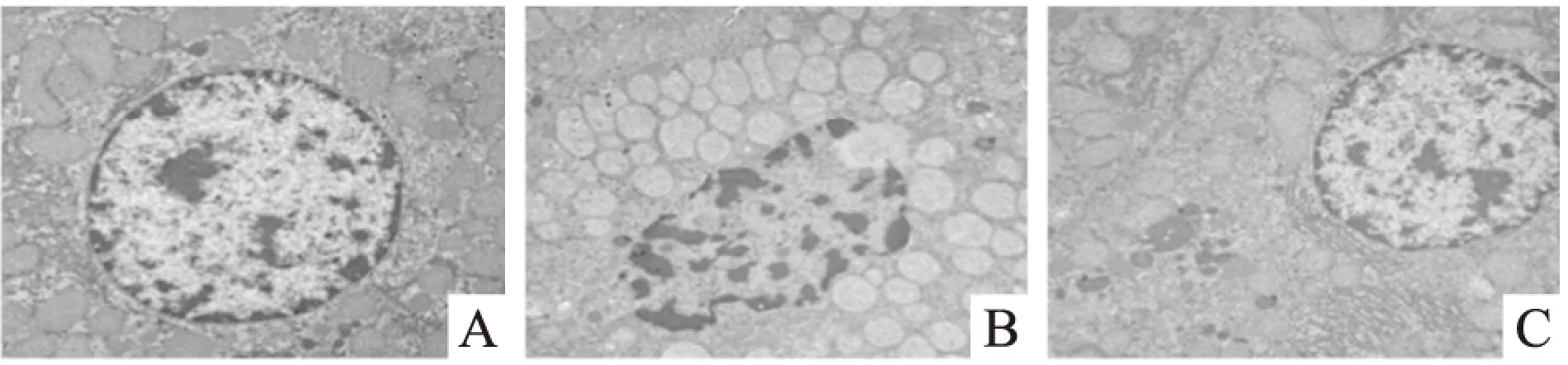
Fig 2 Transmission electron microscopy of liver in rats
A:Control;B:Alcohol;C:Probiotics
2.3益生菌干预对大鼠小肠组织超微结构的影响结果显示,正常对照组小肠上皮柱状细胞排列整齐,小肠绒毛丰富,细胞间紧密连接结构完整清晰。酒精模型组出现小肠微绒毛排列稀疏,紧密连接肿大等病理改变。益生菌干预组小肠柱状上皮及微绒毛排列情况均得到不同程度改善,紧密连接肿胀减轻。见Fig 3。

Fig 3 Transmission electron microscopy of small intestine in rats
A:Control;B:Alcohol;C:Probiotics
2.4益生菌干预对大鼠肝脏功能的影响结果显示,酒精模型组大鼠血清ALT、AST及ALP水平均明显上升,分别为正常对照组的1.4、1.3和1.4倍(P<0.05)。益生菌干预组ALT、AST及ALP水平均较酒精模型组明显降低(P<0.05)。见Tab 2。
Tab 2Effect of probiotics on serum ALT,

GroupnALTASTALPControl1340.55±5.60102.55±13.27135.87±12.47Alcohol857.17±8.24*131.64±14.22*190.38±17.08*Probiotics1045.81±7.75#110.69±13.28#165.06±13.44#
*P<0.05vscontrol group;#P<0.05vsalcohol group
2.5益生菌对大鼠血清中DAO及D-LA水平的影响结果显示,酒精模型组大鼠血清中DAO及D-LA水平明显升高,均达到正常对照组的1.3倍(P<0.05);补充益生菌后大鼠血清中DAO及D-LA水平分别较酒精模型组明显降低了20.2%和23.6%(P<0.05)。见Tab 3。

Tab 3 Changes of plasma DAO and
*P<0.05vscontrol group;#P<0.05vsalcohol group
2.6益生菌对大鼠小肠组织FOXO4表达的影响结果显示,酒精模型组FOXO4表达明显减少,达到正常对照组的50.0%,益生菌干预组FOXO4表达则较酒精模型组明显提高了38.5%(P<0.05)。见Fig 4,Tab 3。

Fig 4 Expression of FOXO4 in small intestine detected by immunohistochemistry(×400)
A:Control;B:Alcohol;C:Probiotics
2.7粪便肠道菌群16S rDNA高通量测序分析
2.7.1测序概况各组样品共获得453 467条高质量标签序列,在97%相似性水平下对序列进行聚类分析,共产生91 104条OTU序列。分析结果显示,各组间标签序列及OTU序列数目有所差别,但差异均无显著性(P>0.05)。见Tab 4。
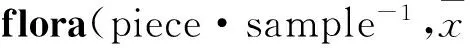
Tab 4 Comparison of sequence number in fecal intestinal ±s)
同时,本实验以OTU数据为计算依据构建VENN图进行菌群多样性定性分析。结果显示,酒精模型组与正常对照组的共有OTU序列为1 956条,而益生菌干预组与正常对照组的共有序列则为2 061条;同时,酒精模型组的OTU中有46.7%在其他组中没有出现,而正常对照组和益生菌干预组的这一数值分别是54.1%和52.9%。提示酒精损伤后大鼠肠道菌群多样性可能受到了一定影响,益生菌补充对恢复肠道菌群正常状态具有一定调节作用。见Fig 5。
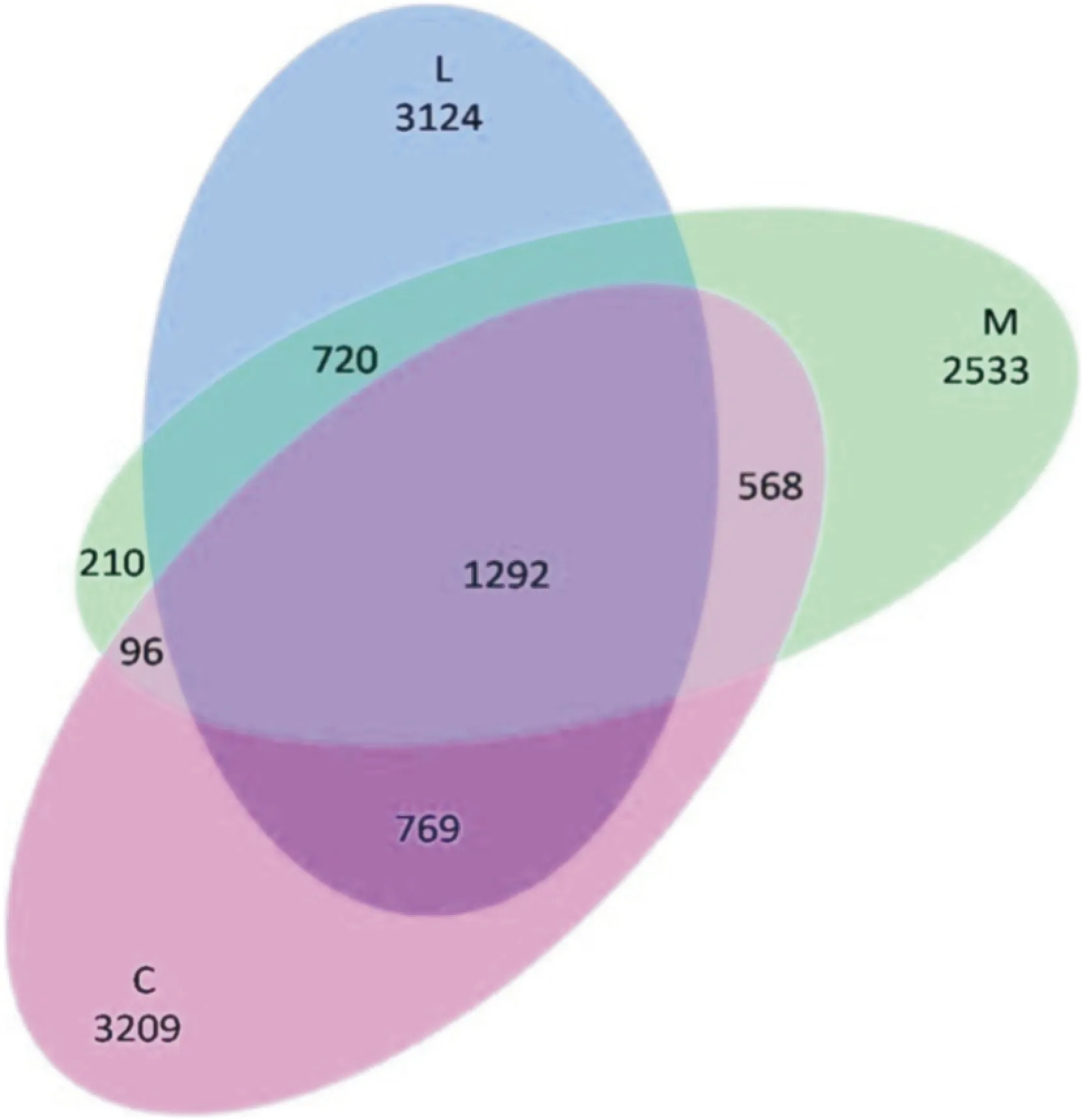
Fig 5 Qualitative analysis of intestinal microbial flora diversity among groups
C:Control;M:Alcohol;L:Probiotics
2.7.2Alpha多样性分析Alpha多样性反映的是单个样品内部的物种多样性,包括ACE指数、chaol指数、coverage、shannon指数和Simpson指数等。本实验对所有样品alpha多样性进行计算,并做出相应稀疏曲线图。
2.7.2.1菌群丰度评估通过ACE指数和Chao1指数等评估各组样品菌群丰度。结果显示,酒精损伤后肠道菌群丰度有所降低,益生菌对恢复菌群丰度具有一定调节作用,但各组间差异均未见显著性(P>0.05)。见Tab 5,Fig 6。
2.7.2.2菌群多样性分析通过shannon指数和Simpson指数评估各组样品菌群多样性。结果显示,酒精损伤使肠道菌群多样性有所降低,而益生菌对恢复菌群多样性具有一定调节作用,但各组间差异均未见显著性(P>0.05)。见Tab 5,Fig 6。
2.7.2.3样品文库覆盖率评估为衡量样本取样深度,进行Coverage指数和稀疏性曲线分析。结果表明,随着测序量的增加,还会有新的物种出现。但各组样本Coverage指数均趋近于85 %,提示测序深度已经基本能够覆盖该微生物群落中绝大多数细菌。分析结果还显示,在测序量较低(<500)时,各组样本Shannon指数均明显上升,随着测序量的扩大,Shannon指数逐渐变缓并最终均达到平台期,Shannon指数均趋近于7.0,Simpson指数多小于0.006,表明多样性已基本达到饱和,均匀度较高,可用于后续分析。见Tab 5,Fig 6。
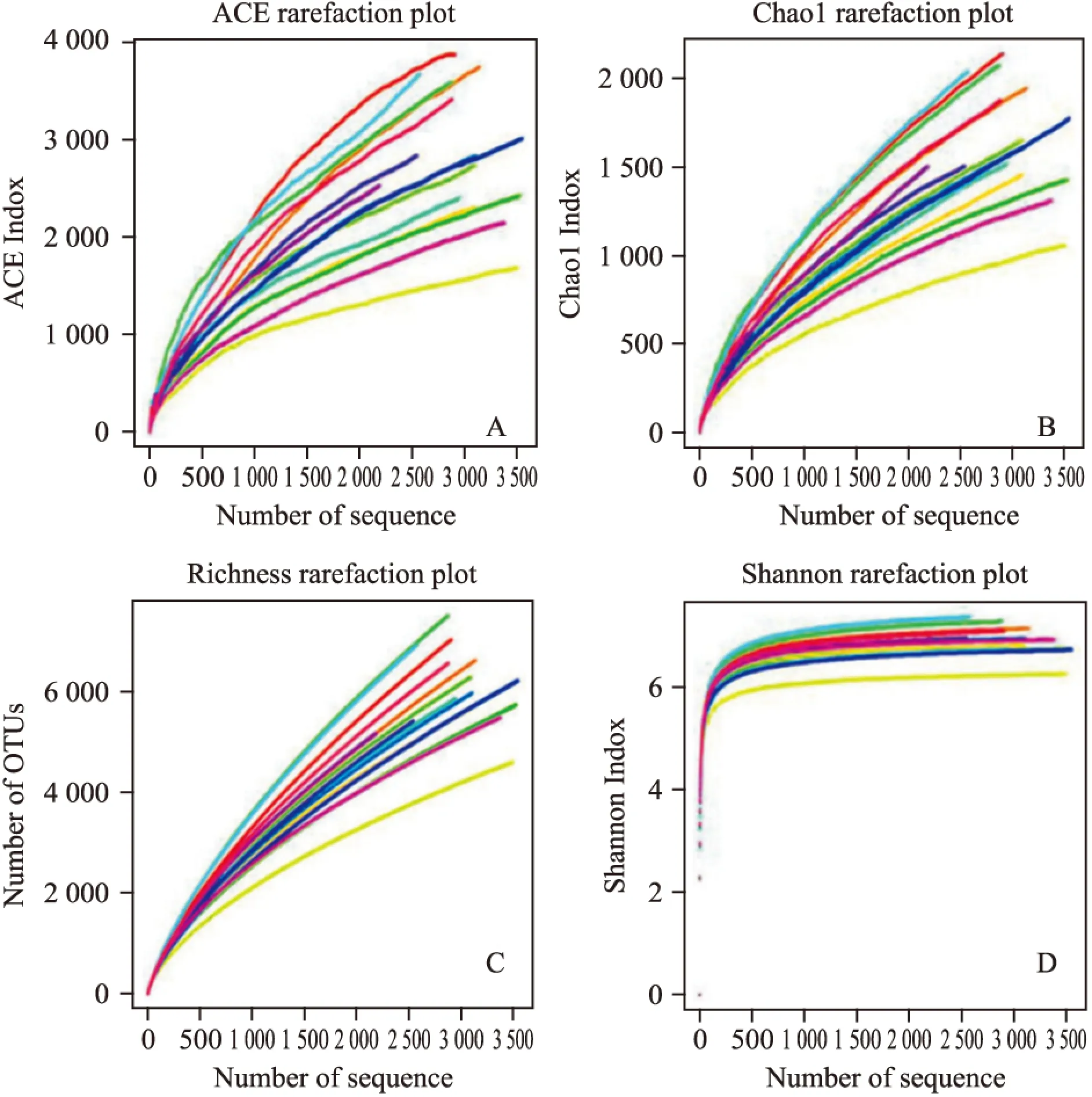
Fig 6 Alpha analysis of intestinal microbial flora among groups
A:ACE rarefaction plot;B:Chao1 rarefaction plot;C:Richness rarefaction plot;D:Shannon rarefaction plot
2.7.3肠道菌群菌门水平丰度分析结果发现,各组大鼠肠道菌群主要分属11个菌门,其最优势菌门均为厚壁菌门(firmicutes)、拟杆菌门(bacteroidetes)和变形菌门(proteobacteria)。酒精模型组肠道菌群中厚壁菌门数量较正常对照组明显减少,而拟杆菌门数量明显增多(P<0.05);益生菌干预后,厚壁菌门数量较酒精模型组增加,而拟杆菌门数量有所减少,但差异均未见显著性(P>0.05)。非优势菌门中,酒精模型组柔膜菌门(tenericutes)和迷踪菌门(elusimicrobia)数量与正常对照组比较明显增高,而益生菌干预组迷踪菌门数量则较酒精模型组明显降低(P<0.05)。变形菌门及其余非优势菌门在各组间差异均未见显著性或含量微乎其微(P>0.05)。见Tab 6。
Tab 5 Alpha diversity of intestinal microbial flora among ±s)

Tab 6 Analysis of intestinal microbial flora among groups in phylum ±s)
*P<0.05vscontrol group;#P<0.05vsalcohol group
2.7.4肠道菌群菌属水平丰度分析结果显示,正常对照组检测到约170个菌属,酒精模型组约为154个菌属,益生菌干预组约为164个菌属,分别较正常对照组减少了9.4%和3.5%。酒精模型组丰度最高的前20个菌属与正常对照组一致率仅为75%,且各菌属丰度亦较正常对照组有较大差别。益生菌干预组丰度最高的前20个菌属与正常对照组一致率达到90%,且其中大部分菌属的丰度构成比较酒精模型组更接近于正常对照组。各组大鼠肠道菌群丰度前20位菌属分布见Fig 7。
3 讨论
肠道菌群是人体在长期进化过程中形成的肠道正常微生物群,它们按一定数量和比例分布在肠道不同节段与部位,对宿主发挥机械屏障、生物屏障、免疫屏障等重要生理作用。长期过量饮酒可使肠道微生物群的组成和分布发生紊乱[7-8],细菌易位、部分革兰阴性菌(G-)过度繁殖均可造成肠道黏膜屏障的完整性破坏及功能障碍,促使内毒素、氨、硫醇等肠源性毒物过度产生并渗漏入血,经门静脉进入肝脏后,最终导致和加重酒精性肝损伤状况[9-10]。因此,维持肠道微生态稳定,恢复肠黏膜屏障功能,对防治酒精性肝损伤具有重要意义[11]。
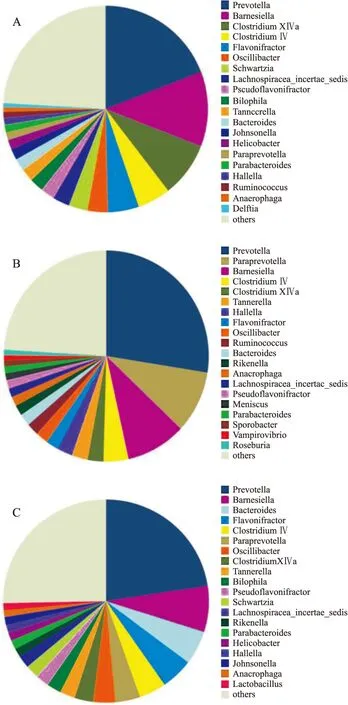
Fig 7 Analysis of intestinal microbial flora among groups in genus level
A:Control;B:Alcohol;C:Probiotics
研究表明,合理摄入活性益生菌制剂,对肠道菌群失调具有良好的改善、修复作用。2001年,我国卫生部公布了双歧杆菌(bifidobacterium)、乳酸杆菌(lactobacillus)、嗜热链球菌( streptococcus thermophilus )等3类共计9种可用于保健食品的益生菌名单。本实验采用包含以上3类益生菌的碧悠发酵乳作为干预物,研究其对酒精性肝损伤及肠道屏障功能的改善效果。结果显示,益生菌对酒精摄入导致的肝组织损伤具有一定保护作用,与相关报道一致[4-5,12-13]。D-LA是细菌发酵的代谢产物,DAO是哺乳动物肠黏膜上层绒毛细胞中具有高度活性的细胞内酶,二者在肠黏膜细胞遭到破坏时均可释放入血,从而成为肠道屏障功能检测血清学敏感评价指标。FOXO4是叉头框蛋白转录因子O亚家族的一员,研究表明,肠黏膜组织中FOXO4表达降低与肠黏膜屏障功能障碍密切相关[14]。本实验检测结果显示,补充益生菌可明显改善小肠组织超微结构损伤状况,血清D-LA和DAO水平明显降低,FOXO4表达则明显增多,表明益生菌干预对酒精摄入引起的肠道黏膜屏障破坏具有一定修复作用。
为了进一步探讨益生菌改善肠道屏障功能,缓解肝组织损伤的作用机制是否与其对肠道菌群的调节作用有关,本研究采用16S rDNA高通量测序技术对大鼠粪便肠道菌群结构进行了系统的分子生态学分析。16S rDNA是编码原核生物核糖体小亚基rRNA(16S rRNA)相对应的DNA序列。由于16S rDNA能够较好体现不同菌属之间的差异,故而作为细菌分类学研究最有用的“分子钟”而被普遍使用[6]。本实验测序结果表明,酒精诱导使肠道菌群多样性及菌门、菌属丰度均受到一定影响,主要表现为:① OTU、VENN、Shannon指数等多样性评价指标均较正常对照组降低;② 厚壁菌门及拟杆菌门等优势菌门、柔膜菌门及迷踪菌门等非优势菌门数量均较正常对照组差异具有显著性;③ 正常对照组分布前3位的菌属分别为普氏菌属(Prevotella)、Barnesiella菌属和梭菌属XlVa,而酒精模型组分布前3位的菌属中,帕拉普氏菌属(Paraprevotella)取代了Barnesiella菌属位于第2位;④ 正常对照组分布于前20位的菌属中施氏菌属、嗜胆菌属、螺杆菌属(Helicobacter)、Johnsonella菌属和代尔夫特菌属(Delftia)在酒精模型组前20位菌属分布中均未出现,取而代之的是理研菌属(Rikenella)、新月菌属(Meniscus)、Sporobacter菌属、蝙蝠弧菌属(Vampirovibrio)和罗氏菌属(Roseburia)5种菌属。补充益生菌对恢复肠道菌群正常状态具有一定调节作用。主要表现为:① 各种多样性评价指数均较酒精模型组更接近正常对照组;② 各优势菌门数量与酒精模型组比较差异虽无显著性,但均有所改善,更趋向于正常大鼠,且迷踪菌门数量明显降低至正常水平。③ 分布在前2位的菌属与正常对照组一致;④ 分布在前20位的菌属中,只有理研菌属与酒精模型组一致而未出现在正常对照组中,而作为有益菌的乳杆菌属(Lactobacillus)只出现在益生菌干预组。以上结果表明,酒精诱导使肠道菌群发生扰动,补充益生菌可能通过调节肠道菌群结构,有效改善肠道菌群紊乱状况,修复肠黏膜屏障,减少内毒素等有毒物质渗漏入血,从而延缓酒精性肝损伤进程。
综上所述,益生菌通过调节肠道微生态紊乱,改善肠道屏障功能,对大鼠酒精性肝损伤发挥保护作用。益生菌作为一种安全有效的活体微生物制剂,值得在酒精性肝损伤治疗领域得到进一步推广应用。
(致谢:本实验在青岛大学医学院医学营养研究所实验室完成,感谢实验室全体老师对本实验的大力支持和帮助。)
[1]邱萍,李相,孔德松,等. 酒精性肝病发病机制研究的新进展[J]. 中国药理学通报,2014,30(2):160-3.
[1]Qiu P, Li X, Kong D S, et al. Research progress on pathogenesis of alcoholic liver disease[J].ChinPharmacolBull, 2014, 30(2):160-3.
[2]Szabo G,Bala S. Alcoholic liver disease and the gut-liver axis[J].WorldJGastroenterol, 2010, 16(11):1321-9.
[3]Nanji A A, Khettry U, Sadrzadeh S M. Lactobacillus feeding reduces endotoxemia and severity of experimental alcoholic liver(disease)[J].ProcSocExpBiolMed,1994, 205(3):243-7.
[4]Chang B, Sang L, Wang Y,et al. The protective effect of VSL#3 on intestinal permeability in a rat model of alcoholic intestinal injury[J].BMCGastroenterol,2013,13:151.
[5]Komatsuzaki N,Shima J. Effects of live Lactobacillus paracasei on plasma lipid concentration in rats fed an ethanol-containing diet[J].BiosciBiotechnolBiochem,2012,76(2):232-7.
[6]Ong S H,Kukkillaya V U,Wilm A,et al. Species identification and profiling of complex microbial communities using shotgun Illuminasequencing of 16S rRNA amplicon sequences[J].PLoSOne,2013,8(4):e60811.
[7]Mutlu E A,Gillevet P M,Rangwala H, et al. Colonic microbiome is altered in alcoholism[J].AmJPhysiolGastrointestLiverPhysiol,2012,302(9):G966-78.
[8]Kavanaugh M J,Clark C, Goto M, et al. Effect of acute alcohol ingestion prior to burn injury on intestinal bacterial growth and barrier function[J].Burns,2005,31(3):290-6.
[9]Mutlu E, Keshavarzian A, Engen P,et al. Intestinal dysbiosis: a possible mechanism of alcohol-induced endotoxemia and alcoholic steatohepatitis in rats[J].AlcoholClinExpRes,2009,33(10):1836-46.
[10]吴夏飞,连娜琦,陆春风,等. 肠道菌群对慢性肝脏疾病影响的研究进展[J].中国药理学通报,2013,29(12):1644-7.
[10]Wu X F, Lian N Q, Lu C F, et al. Research progress on effect of intestinal flora on chronic liver diseases[J].ChinPharmacolBull, 2013, 29(12):1644-7.
[11]Szabo G. Gut-liver axis in alcoholic liver disease[J].Gastroenterology,2015,148(1): 30-6.
[12]张波,鲁晓岚,宋亚华,等.肠道内环境在酒精性脂肪肝发病中的初始作用及益生菌的治疗效果[J].中华肝脏病杂志,2012,20(11):848-52.
[12]Zhang B, Lu X L, Song Y H, et al. Changes in the intestinal microenvironment during development of alcoholic fatty liver disease and related effects of probiotic therapy[J].ChinJHepatol,2012,20(11):848-52.
[13]Wang Y, Kirpich I, Liu Y, et al.Lactobacillus rhamnosus GG treatment potentiates intestinal hypoxia-inducible factor, promotes intestinal integrity and ameliorates alcohol-induced liver injury[J].AmJPathol,2011,179(6): 2866-75.
[14]Chang B,Sang L,Wang Y,et al. The role of FoxO4 in therelationship between alcohol-induced intestinal barrier dysfunction and liver injury[J].IntJMolMed,2013,31(3):569-76.
Effects of probiotics on alcoholic liver injury in rats and its mechanisms
LIANG Hui1, LYU Rui2, FU Yong1, ZHOU Zhi-tong3, LIU Ying4,ZHOU Xiao-bin5,WANG Wen-cheng1, LIU Man1, MA Ai-guo1
(1.TheInstituteofHumanNutrition,MedicalCollegeofQingdaoUniversity,QingdaoShandong266021,China;2.LaboratoryofPathogenBiology,MedicalCollegeofQingdaoUniversity,QingdaoShandong266071,China;3.TheSpecialtyofFoodScienceandEngineering,JiangnanUniversity,WuxiJiangsu214122,China;4.LaboratoryofCellularandMolecularBiology,MedicalCollegeofQingdaoUniversity,QingdaoShandong266071,China;5.TeachingandResearchSectionEpidemicofDiseaseandHealthStatistics,MedicalCollegeofQingdaoUniversity,QingdaoShandong266021,China)
AimTo observe the protective effects of probiotics on alcoholic liver injury in rats.MethodsMale Wistar rats were randomly divided into the following three groups: control group, normal diet with normal (5×108CFU·kg-1·d-1) treatment group. Excluding the rats in the normal control group, the other animals were initially received intragastric administration with 56%(V/V) ethanol 5.5~11.0 mL·kg-1·day-1for 8 weeks. Then the rats’ faeces were collected, and the liver and the small intestine were obtained for pathologic and ultrastructural observation. Serum ALT, AST and ALP was measured by method of biochemistry. Serum DAO and D-LA was measured by enzyme linked immunosorbent assay. The expression of FOXO4 in small intestine was detected by immunohistochemistry. The intestinal flora genome DNA was extracted from faeces and the sequence of 16S rDNA was analyzed by high-throughput sequencing technologies.ResultsHepatic steatosis was obviously improved in probiotics treatment groups compared with ethanol-treated group, and the ultrastructural such as mitochondrial and rough endoplasmic reticulum pathological changes was significantly alleviated. The ultrastructural changes in intestinal were better in probiotics treatment group than in the ethanol-treated group. And ethanol-induced rats’ serum ALT, AST, ALP, D-LA and DAO levels showed a significant reduction in the probiotics treatment groups compared with the ethanol-treated group(P<0.05). The FOXO4 expression was increased obviously in the probiotics treatment groups compared with the ethanol-treated group(P<0.05). And the intestinal flora diversity was impacted after feeding alcohol, and probiotics had a certain regulative action in helping the intestinal flora back to normal state; At phylum level, the Firmicutes quantity was lower and the Bacteroidetes quantity was higher in ethanol-treated group than those in the control group(P<0.05), and the conditions were improved after supplementing probiotics. At genus level, the percent of genus abundance was similar to normal control group in the probiotics treatment groups compared with the ethanol-treated group.ConclusionProbiotics can relieve liver injury induced by alcohol in rats, and the mechanism may be related to the modulation of probiotics on the intestinal flora distribution and intestinal barrier.
probiotics; alcoholic liver disease; intestinal barrier; intestinal flora;16s rDNA high throughput sequencing;molecular ecology
2016-02-18,
2016-04-16
国家自然科学基金资助项目(No 81573137);达能营养中心膳食营养研究与宣教基金资助项目(No DIC2014-03); 青岛大学创新型教学实验室研究项目
梁惠(1964-),女,博士,教授,博士生导师,研究方向:医学营养学,Tel:0532-82991503,E-mail:qdlianghui@126.com;马爱国(1956-),男,博士,教授,博士生导师,通讯作者,E-mail:magfood@126.com
10.3969/j.issn.1001-1978.2016.07.021
A
1001-1978(2016)07-0991-07
R-332;R154;R322.45;R575.01;R975
网络出版时间:2016-6-20 11:49网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160620.1149.042.html