LC-MS/MS法测定人血浆中甲磺酸雷沙吉兰的浓度及其体内药动学研究
2016-08-10刘泽娟赵佳佳蒋学华
刘泽娟,赵 萍,陈 娟,赵佳佳,华 晶,王 凌,蒋学华
(四川大学华西药学院,四川 成都 610041)
LC-MS/MS法测定人血浆中甲磺酸雷沙吉兰的浓度及其体内药动学研究
刘泽娟,赵萍,陈娟,赵佳佳,华晶,王凌,蒋学华
(四川大学华西药学院,四川 成都610041)
目的建立人血浆中甲磺酸雷沙吉兰(rasagiline mesylate,PAI)的液相色谱-串联质谱(LC-MS/MS)测定方法,并应用于研究其在中国健康人体内的药动学特征。方法以氯吡格雷为内标,血浆样品经液-液萃取后,通过三重四级杆串联质谱仪,以选择性正离子反应监测进行测定,检测离子对为m/z172.3→117.1(雷沙吉兰),m/z322.3→184.0(氯吡格雷)。甲磺酸雷沙吉兰线性范围为0.1047~20.93 μg·L-1,定量限为0.1047 μg·L-1,方法学各项指标均符合要求。应用此法研究24名(男女各半)中国健康志愿者口服甲磺酸雷沙吉兰片的药动学特点及进行了统计学比较。结果结果显示0.5、1.0及2.0 mg 3个剂量组(n=12)甲磺酸雷沙吉兰的吸收呈线性动力学特征;中剂量多次给药后,无蓄积现象;性别对雷沙吉兰主要药动学参数的影响差异也无统计学意义;但高脂饮食对雷沙吉兰的药物峰浓度有明显影响,但对吸收程度无明显影响。结论建立的LC-MS/MS测定法专属、灵敏,满足甲磺酸雷沙吉兰片的人体药动学研究。
甲磺酸雷沙吉兰;药代动力学;血药浓度;LC-MS/MS;人血浆;测定
甲磺酸雷沙吉兰(rasagiline mesylate,PAI)是一种强效、高选择性、不可逆的B型单胺氧化酶(MAO-B)抑制剂,对多巴胺能运动神经功能失调具有治疗作用[1]。目前多种药物用于帕金森病(PD)的治疗[2],PAI在临床上主要用于治疗早期PD,亦可作为较晚期患者治疗药物左旋多巴的补充用药[3]。其作用机制是阻滞神经递质多巴胺的分解,从而增加多巴胺的蓄积,引起纹状体中多巴胺细胞外水平上升。多巴胺水平的升高和随后多巴胺能活性的增强,能使PD患者的临床症状(多巴胺能运动功能障碍)得到改善[4]。本研究建立了一种高效、快速、准确的LC-MS/MS法,对24名健康受试者空腹单次、多次及高脂餐后口服甲磺酸雷沙吉兰片后的药动学进行研究,为临床治疗的有效性和安全性评价提供全面参考。
1 材料与方法
1.1药品和试剂甲磺酸雷沙吉兰片(规格:1.0 mg/片,批号:20130104,四川方向药业有限责任公司);甲磺酸雷沙吉兰对照品(PAI,批号:121223,含量99.68%,四川方向药业有限责任公司);硫酸氢氯吡格雷(CLO,内标)对照品(批号:100819-201102,含量99.5%,中国食品药品检定研究院);乙酸乙酯(分析纯,批号为20140624,天津市致远化学试剂有限公司);氢氧化钠(分析纯,批号:20111101,天津市瑞金特化学品有限公司);甲酸铵(色谱纯,批号:WC390060,Shanghai ANPEL Scientific instrument Co.Ltd);甲醇(色谱纯,批号:3DL0001,SPECTRUM CHEMICAL MFG.CORP);水为去离子水。
1.2色谱条件CTC Analytics HTS PAL Autosampler自动进样器(瑞典CTC Analytics AG);SHIMADZU SCL-10A vp二元泵;DGU-14A脱气系统(日本Shimadzu 公司);色谱柱CAPCELL PAK C18(5 μm,2.0×50 mm);流动相水溶液(含5 mmol·L-1甲酸铵;A),甲醇(含5 mmol·L-1甲酸铵;B),梯度洗脱(洗脱程序见Tab 1);流速:0.4 mL·min-1;柱温:35℃;进样量5 μL。

Tab 1 Gradient elution procedure
1.3质谱条件API 3000TM型三重四极杆串联质谱仪,ESI 离子源(美国Applied Biosystem公司);监测模式正离子模式;扫描方式多反应监测(MRM);监测离子对m/z 172.3→117.1(PAI),m/z 322.3→184.0(CLO);离子喷射电压3 500 V;温度400℃;雾化气10;气帘气8;碰撞气8;去簇电压12V(PAI)、40V(CLO);聚焦电压64V(PAI)、109V(CLO);碰撞能量17V(PAI)、30V(CLO);碰撞室出口电压10V(PAI)、10V(CLO)。
1.4溶液配制PAI对照品溶液:精密称取PAI对照品20.93 mg置100 mL量瓶中,用甲醇溶解并定容,得浓度为209.3 mg·L-1的PAI对照品储备液。进一步以甲醇稀释得PAI浓度分别为2.094、4.188、10.47、20.94、104.7、209.3和418.6 μg·L-1的标准曲线工作液。
内标溶液:精密称取CLO对照品10.11 mg,置50 mL量瓶中,用甲醇溶解并定容,得浓度为202.2 mg·L-1的CLO对照品储备液;进一步用甲醇稀释成浓度为101.1 μg·L-1的内标工作液。
1.5样品处理与测定精密移取志愿者血浆(室温融化)0.3 mL,加入甲醇15 μL,涡旋振荡30 s,静置备用。
取含药血样或待测血样,加入内标工作液15 μL,涡旋30 s后加入氢氧化钠溶液(0.1 mol·L-1)50 μL,涡旋30 s后加入3 mL萃取剂(乙酸乙酯),再涡旋3 min,12 000 r·min-1离心5 min。移取上清液于37℃洁净氮气吹干,残渣加入100 μL甲醇复溶,涡旋混合3 min后12 000 r·min-1离心3 min,上清液转入0.5 mL EP管内12 000 r·min-1离心1 min,吸取上清液进样。
1.6给药设计入选24名健康受试者(男女各半),经全面体检合格,签署知情同意书,并经中国人民解放军第四军医大学第一附属医院伦理委员会审批同意。将受试者随机分为两组,每组男女各半,其中1组进行空腹低(0.5 mg)、中剂量(1.0 mg)单次给药和多次给药(每天1.0 mg,连续7 d)试验,另一组进行空腹、餐后高剂量(2.0 mg)单次给药试验,两周期之间间隔7 d。空腹组禁食12 h后给药;餐后组于服药前30 min内进食总热量为800~1 000卡路里的高脂早餐(150卡路里左右的蛋白质、250卡路里左右的碳水化合物、500~600卡路里的脂肪),之后给药。受试者于实验d 1或d 7服药前(0时)和服药后5、10、15、20、30、45 min、1、1.25、1.5、2、3、4、6、8、10 h从静脉采血,中剂量多次给药试验d 4、d 5、d 6早晨于服药前采血,采血量约4 mL,置于肝素抗凝的试管中,离心5 min(4 000 r·min-1),分离血浆,置-20℃冰箱备用。
2 结果
2.1专属性试验在优化后的色谱/质谱条件下,雷沙吉兰及内标氯吡格雷的质谱图见Fig 1。分别取6个不同来源的人空白血浆、空白血浆+PAI、空白血浆+CLO和志愿者服药后血浆样品,按上述方法处理样品,分别进样,图谱见Fig 2。由图可见,血浆中内源性物质对待测物的测定无干扰。
2.2线性范围和最低定量限取空白血浆0.3 mL于4.0 mL EP管中,分别精密加入PAI标准曲线工作溶液15 μL,涡旋振荡30 s,得浓度分别为0.1047、0.2094、0.5235、1.047、5.235、10.47和20.93 μg·L-1的含药血浆,按上述方法处理样品。以含药血浆中PAI与CLO峰面积的比值R为纵坐标,浓度C为横坐标,进行加权回归,计算得PAI的标准曲线方程R=0.401C+0.00503,r=0.9987。含药血浆中PAI在0.1047~20.93 μg·L-1范围内线性关系良好。最低定量限(LLOQ)为0.1047 μg·L-1。
2.3准确度和精密度分别配制0.1047、0.2618、5.235和16.75 μg·L-1的含药血浆(即LLOQ、低、中、高浓度,下同),各浓度6个,连续3 d测定,计算准确度和日内、日间RSD。见Tab 2。
2.4提取回收率记录精密度试验项下d 1低、中、高浓度的含药血浆图谱中PAI和CLO峰面积,以此作为样品提取后测定的峰面积。取空白人血浆0.3 mL,加入氢氧化钠溶液(0.1 mol·L-1)50 μL,涡旋30 s后加入3 mL萃取剂(乙酸乙酯),再涡旋3 min,12 000 r·min-1离心5 min,移取上清液,于上清液中分别加入低、中、高(0.2618、5.235、16.75 μg·L-1)3种不同浓度的PAI系列工作溶液及内标工作溶液各15 μL,涡旋30 s后,按上述方法处理样品。记录PAI、CLO峰面积,以此作为PAI样品未提取测定的峰面积。计算得低、中、高浓度的含药血浆中PAI的提取回收率分别为(74.20±4.81)%、(75.37±5.38)%、(82.55±4.40)%(n=6);内标萃取回收率为:(74.51±5.28)%(n=18)。
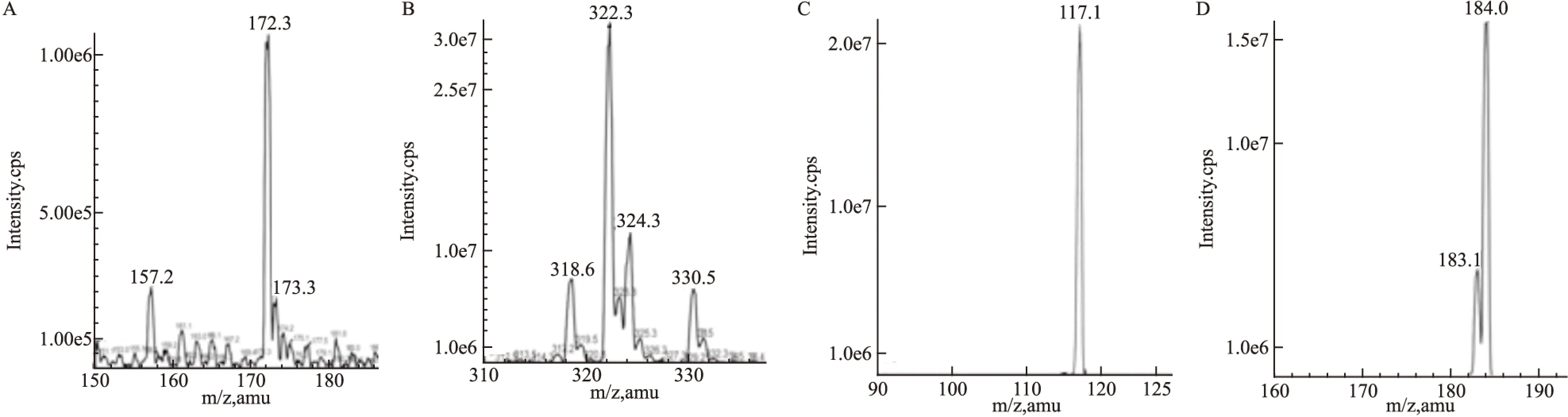
Fig 1 Parention full scan mass-spectrogram of PAI(A) and COL (B) Production mass-spectrograms of PAI (C) and GLO (D)
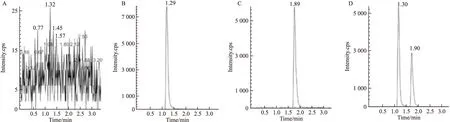
Fig 2 Typical chromatograms
A:Blank plasma;B:Blank plasma+PAI;C:Blank plasma+CLO;D: Plasma sample 30 min after single oral administration of 1.0 g rasagilinemesylate tablet

Tab 2 Results of accuracy and precision tests/%
2.5基质效应取4 mL EP管12个,分别加入低、高浓度的PAI对照品溶液和内标工作液15 μL,各6份,加入氢氧化钠溶液(0.1 mol·L-1)50 μL,涡旋30 s后,按上述方法处理样品。记录PAI、CLO峰面积。计作set1。选择6种不同来源的空白血浆,加入低、高浓度(n=6)的PAI对照品溶液,按“3.4”项下方法制备未提取的含药血浆,得到set2。
绝对基质效应评价:以不同来源样品set2中样品峰面积/set1中样品平均峰面积之比值计算基质效应因子(matrix factor,MF);以待测物与内标MF的比值计算内标归一化基质效应因子(IS-normalized MF)。
相对基质效应评价:以多个样品获得的内标归一化基质效应因子计算变异系数。结果见Tab 3。可见低、高浓度样品的变异系数(即相对基质效应)为6.05%和1.15%,均小于15%,表明基质对于未知样品测定结果准确度的影响可以忽略。

Tab 3 Results of Matrix effects(n=6)
2.6稳定性试验按“2.3”项下方法配制0.2618和16.75 μg·L-1的含药血浆(即低、高浓度),分别考察了含药血浆处理后4℃放置24 h、室温放置8 h、冻融3次以及-20℃冻存40 d后的稳定性。结果与0时刻含药血浆相比较,变异均在±4%范围内(n=6),表明含药血浆在上述条件下稳定。
2.7药动学试验
2.7.1药时曲线数据采集完成后,经Phoenix WinNonlin 6.3药动学统计软件处理得到不同给药方式组平均血药浓度-时间数据,志愿者单次给药(SL、SM、SH)、多次给药(MM)、饮食影响(FH)的试验中,各个平均药-时曲线,见Fig 2。
2.7.2药动学参数由实际测定的血药浓度经时数据读出Cmax和Tmax。采用Phoenix WinNonlin6.3软件拟合计算相关药动学参数,结果见Tab 4-1、4-2。

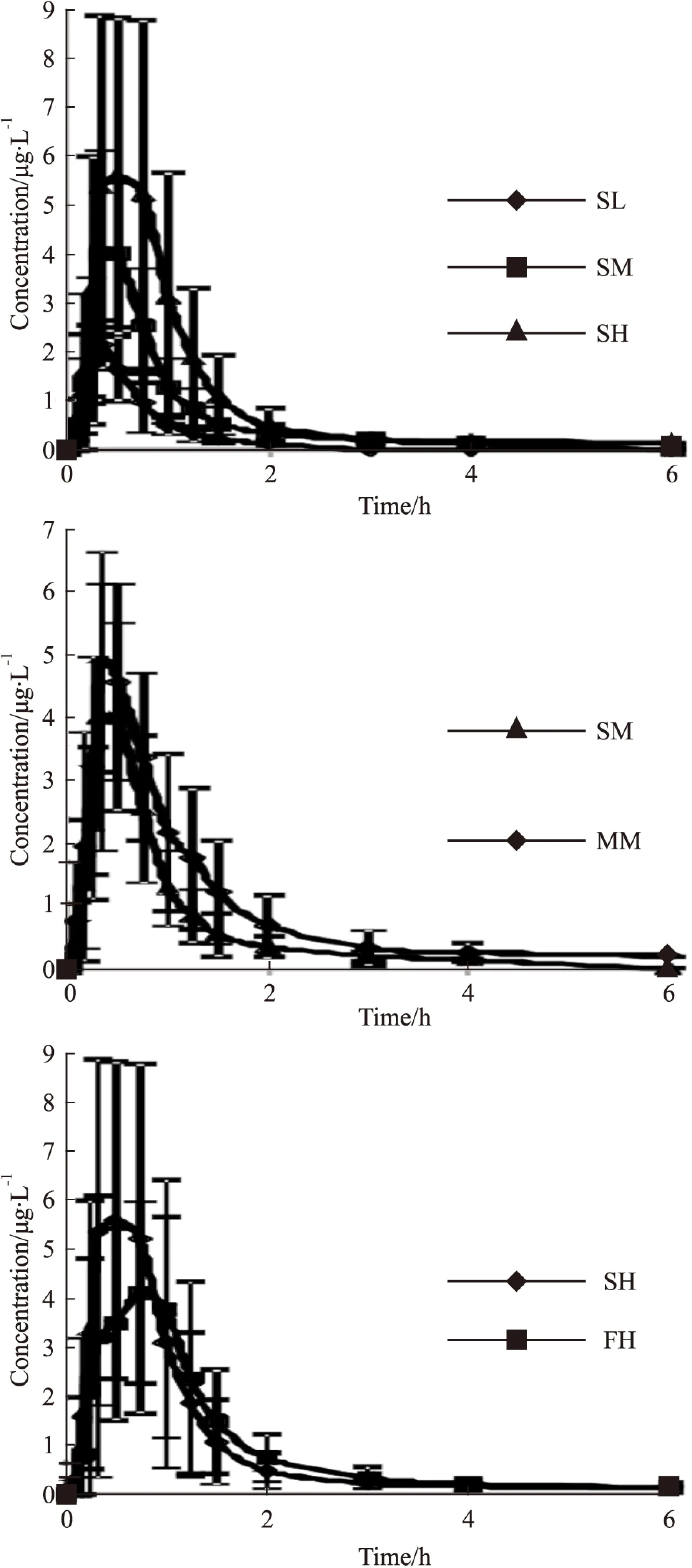
Fig 3 Mean Drug Concentration-time Curves of rasagiline following oral administration in Healthy Volunteers(n=12)
Tab 4-1

PharmacokineticparameterLow-dosesingleMedium-dosesingleMultipleCmax/μg·L-12.45±0.445.36±1.035.74±1.15Tmax/h0.35±0.100.40±0.100.39±0.11T1/2/h0.47±0.270.73±0.320.71±0.30AUC0→t/μg·L-1·h1.39±0.363.36±1.035.18±1.95AUC0→∞/μg·L-1·h1.52±0.423.54±1.035.37±2.01CL/L·h-1359.03±0.36311.58±113.65211.07±77.26Vz/L224.49±106.40312.69±154.47203.87±80.09MRT0→t/h0.59±0.110.79±0.170.96±0.29MRT0→∞/h0.75±0.210.96±0.201.08±0.34
Tab 4-2
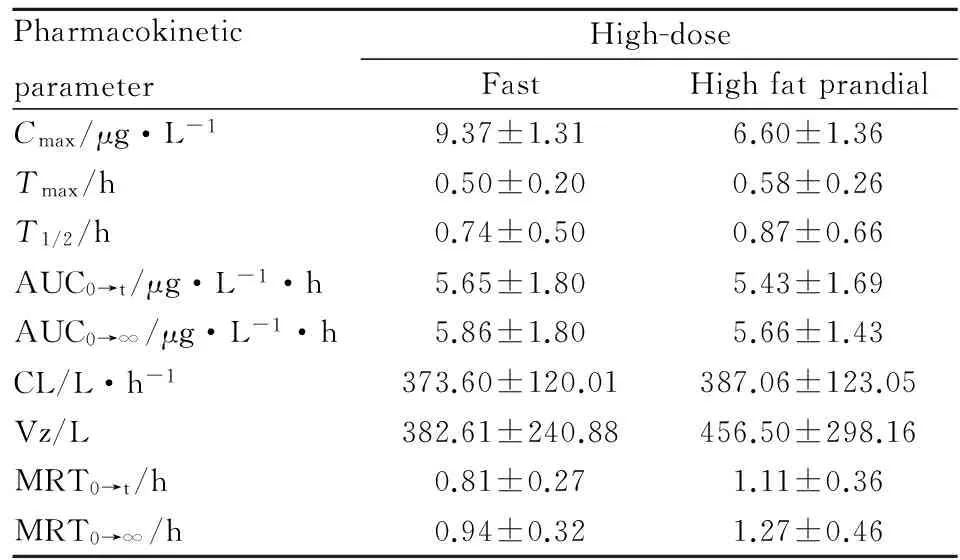
PharmacokineticparameterHigh-doseFastHighfatprandialCmax/μg·L-19.37±1.316.60±1.36Tmax/h0.50±0.200.58±0.26T1/2/h0.74±0.500.87±0.66AUC0→t/μg·L-1·p.65±1.805.43±1.69AUC0→∞/μg·L-1·p.86±1.805.66±1.43CL/L·h-1373.60±120.01387.06±123.05Vz/L382.61±240.88456.50±298.16MRT0→t/h0.81±0.271.11±0.36MRT0→∞/h0.94±0.321.27±0.46
对空腹单次与多次给予相同剂量本品后,PAI的lg(AUC0→t)、lg(AUC0→∞)、lg(Cmax)和消除半衰期T1/2进行配对t检验,结果表明,T1/2的差异无统计学意义(P>0.05),但AUC0→t、AUC0→∞、Cmax的结果有统计学意义(P<0.05),对其Tmax进行秩和检验,结果差异无统计学意义(P>0.05)。计算PAI的蓄积因子为(1.09±0.09)。
对空腹与餐后单次给予相同剂量本品后的lg(AUC0→t)、lg(AUC0→∞)、lg(Cmax)和消除半衰期T1/2进行配对t检验,其AUC0→t、AUC0→∞和消除半衰期T1/2的结果没有统计学意义(P>0.05),但Cmax的结果差异有统计学意义(P<0.05),表明高脂饮食会导致雷沙吉兰峰浓度降低,但暴露量与空腹比较无统计学差异,与文献报道一致[6]。
对男、女不同受试者给予相同剂量本品后的lg(AUC0→t)、lg(AUC0→∞)、lg(Cmax)和消除半衰期T1/2进行独立样本t检验,对其Tmax进行秩和检验,结果表明,性别对于主要药动学参数影响的差异无统计学意义(P>0.05)。
3 讨论
本实验建立的LC-MS/MS法快速、准确、灵敏,适用于本实验样本中甲磺酸雷沙吉兰的人体药动学研究。
对线性动力学特征进行判断的方法,目前常用有3种[5]。① 传统方法,即基于趋势图进行线性药动学判断。以相关系数(r)作为评价指标,r越接近于1,线性越好,但是r值为多大时认为不具有线性动力学特征并没有准确的、规范的判断标准,不免具有主观性。② 采取假设检验的方法,即各受试者药动学参数进行剂量标准化处理后再进行单因素方差分析。此法简单易于计算,但只能定性地分析是否有线性动力学特征,具体剂量增加后,药物线性动力学偏移程度无法获得。③ 幂指数模型,即基于置信区间法的线性动力学特征判定方法。置信区间法应用统计学知识与临床实践经验,不仅将个体间的变异纳入考察范围,而且借鉴生物等效性试验中药动学参数的等效标准,对线性回归斜率进行了明确的判断界定,一改传统判断方法的主观性及单因素方差分析不明确性,更符合药代动力学研究的要求。本文应用②、③两种方法进行分析,均可得出剂量与吸收(AUC、Cmax)具有线性关系。虽然,用③法中统计学得出,AUC判定区间与置信区间有交叉,可能是因为等效标准是针对24个人的,过于严苛所致。由此,我们可以认为,本实验所考察剂量范围内,剂量与吸收(AUC、Cmax)具有明显线性关系。
关于多次给药后的蓄积程度,用蓄积因子来评价,但蓄积因子界值也没有统一的认识。从FDA Clinical Pharmacology and Biopharmaceutics Review(rasagiline mesylate)中得知,原研制剂连续7 d多次给药后的AUC和Cmax分别是单次给药后的1.39、1.45倍,结论是多次给药后PAI几乎没有蓄积。本实验中,本品连续7 d多次给药后,在中国人中的AUC和Cmax分别是单次给药后的1.54、1.09倍,与本品原研制剂的研究结果基本一致,且蓄积因子为(1.09±0.09)。故得出,本品在健康中国人体内几乎没有蓄积现象,与文献报道一致[7]。高脂饮食对本品药动学参数影响试验中,结果显示高脂餐对PAI的Cmax存在明显影响(P<0.05),对暴露量的影响较小,研究结果与文献报道一致[8]。可能是高脂饮食影响胃排空,减慢药物吸收速率,使Cmax明显下降,由血药浓度曲线可以看出,在药物消除整个过程中,高脂餐组的血药浓度比空腹给药组更高,表明可能是餐后药物清除速率降低所致,由此,高脂饮食对PAI的AUC降低并不十分明显。因此,本品的临床治疗用药可不考虑食物的影响。
实验结果表明,健康中国人单剂量口服本品(0.5~2.0 mg)后,剂量与吸收(AUC、Cmax)具有明显线性关系;多次给药后PAI在健康中国人体内几乎没有蓄积现象;高脂饮食会使PAI的峰浓度降低,但对吸收程度无明显影响;临床推荐剂量下,男女受试者的主要药动学参数无明显差异。
(致谢:感谢王凌、蒋学华两位老师对本文研究工作的悉心指导和大力支持,同样感谢本教研室研究生赵萍、陈娟、赵佳佳、华晶同学的关心和帮助。)
[1]Pagonabarraga J,Rodríguez-Oroz M C. Rasagiline in monotherapy inpatients with early stages of Parkinson’s disease and in combined and adjunct therapy to levodopa with moderate and advanced stages[J].RevNeurol,2013,56(1):25-34.
[2]张万鑫, 马婧怡,陈虹,等.松果菊苷对帕金森病大鼠纹状体及海马细胞外液中单胺类神经递质的影响[J].中国药理学通报,2014,30(8):1131-6.
[2]Zhang W X, Ma J Y, Chen H,et al. Effects of echinacoside on striatal and hippocampus extracellular fluid of monoamine neurotransmitter in Parkinson’s disease rats[J].ChinPharmacolBull,2014,30(8):1131-6.
[3]Perez-Lloret S,Rascol O.Safety of rasagiline for the treatment ofParkinson’s disease[J].ExpertOpinDrugSaf,2011,10(4):633-43.
[4]孙铜,郝丽娜.帕金森病治疗新药-雷沙吉兰[J].齐鲁药事,2007,26(8):509-10.
[4]Sun T,hao L N.Parkinson′s disease treatment novel drugs-rasagiline[J].QiluPharmAffairs,2007,26(8):509-10.
[5]赵明,杨劲,魏敏吉.置信区间法用于线性药代动力学特征评价[J].中国临床药理学杂志,2015,31(3):238-40.
[5]Zhao M,Yang J,Wei M J.Using confidence interval method to assess linear pharmacokinetics in doseescalation study[J].ChinJClinPharmacol,2015,31(3):238-40.
[6]顾霄,张圆,宋敏,等.饮食对甲磺酸雷沙吉兰人体药代动力学的影响[J].中国药科大学学报,2013,44(1):85-8.
[6]Gu X,Zhang Y,Song M,et al.Food effects on the human pharmacokinetics of rasagilinemesylate[J].JChinaPharmaUniv,2013,44(1):85-8.
[7]Thebault J J,Guillaume M,Levy R.Tolerability, safety, pharmacodynamics,and pharmacokinetics of rasagiline:A potent, selective, and irreversible monoamine oxidase type B inhibitor[J].Pharmacotherapy, 2004,24(10): 1295-305.
[8]Chen J J, Swope D M. Clinical pharmacologyof rasagiline: a novel,second-generation propergylamine for the treatment of Parkinson diseas[J].JClinPharmacol,2005,45(8) : 878-94.
Determination of rasagiline mesylate in human plasma by LC-MS/MS and its pharmacokinetics study
LIU Ze-juan,ZHAO Ping,CHEN Juan,ZHAO Jia-jia,HUA Jing,WANG Ling, JIANG Xue-hua
(WestChinaSchoolofPharmacy,SichuanUniversity,Chengdu610041,China)
AimTo develop LC-MS/MS method to determine rasagiline mesylate in human plasma and its application in a pharmacokinetics study. MethodsPlasma samples were extracted using liquid-liquid extraction with clopidogrel as internal standard.The content of rasagiline mesylate in human plasma was detected by selectivelypositive ion reaction monitoring on a triple quadrupoles tandem mass spectrometer.The detected ions were m/z 172.3→117.1(rasagiline), m/z 322.3 →184.0(clopidogrel).The linear calibration curve was obtained in the concentration range of 0.1047~20.93 μg·L-1.The lower limit of quantification was 0.1047 μg·L-1.Indicators of the method validation were in line with requirements.The method was used to determine the concentration of rasagiline in human plasma after oral administration of rasagiline mesylate capsule to 24 healthy Chinese volunteers(with half males and females) and the results were compared statistically.ResultsThe single oral dose of 0.5,1.0 and 2.0 mg presented linear pharmacokinetics in the health volunteers. No accumulation was observed with multiple doses. Meanwhile, no significant difference was identified between the gender groups. High fat postprandial has obvious effects on the peak serum concentration of rasagiline,but there was no effect on the absorption amount and cumulative excretion. ConclusionThe LC-MS/MS method is specific and sensitive, and can be successfully applied to the pharmacokinetic study of Rasagiline mesylate tablets in healthy Chinese volunteers.
rasagiline mesylate;pharmacokinetics;plasma concentration;LC-MS/MS;human Plasma;determine
2016-01-14修回稿日期:2016-05-25
刘泽娟(1988-),女,硕士,研究方向:临床用药的药动学基础,E-mail:873709777@qq.com;王凌(1978-),女,博士后,副教授,研究方向:药动学的研究与应用,通讯作者,Tel:028-85503968,E-mail:7649800@qq.com
10.3969/j.issn.1001-1978.2016.07.025
A
1001-1978(2016)07-1017-06
R446.112;R916.4;R969.1;R971.5
网络出版时间:2016-6-20 11:49网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160620.1149.050.html