4-氨基-2-三氟甲基苯基维甲酸酯抗肿瘤作用研究进展
2016-08-09葛金芳综述陈飞虎审校
孟 遥,夏 泉,2,葛金芳综述,陈飞虎审校
◇综 述◇
4-氨基-2-三氟甲基苯基维甲酸酯抗肿瘤作用研究进展
孟 遥1,夏 泉1,2,葛金芳1综述,陈飞虎1审校
基于良好的抗肿瘤增殖及诱导分化效应,维甲酸及其衍生物是近年来抗肿瘤药物开发与研究领域的重点内容之一。4-氨基-2-三氟甲基苯基维甲酸酯(ATPR)是以全反式维甲酸(ATRA)为基础设计合成的新型维甲酸衍生物,其抗肿瘤机制主要包括抑制肿瘤细胞增殖、诱导细胞周期阻滞,促进细胞分化,诱导细胞凋亡,抑制肿瘤细胞侵袭、转移,阻断肿瘤细胞信号转导通路等方面。与ATRA比较,ATPR在体内的半衰期更长,清除更慢,预示其极可能成为具有临床应用价值的抗肿瘤新药。
4-氨基-2-三氟甲基苯基维甲酸酯;全反式维甲酸;抗肿瘤;抑制增殖;诱导分化;细胞周期阻滞
网络出版时间:2016-3-8 8:29:02 网络出版地址:http://www.cnki.net/kcms/detail/34.1065.R.20160308.0829.072.htm l
维甲酸类化合物是指有维生素甲基苯结构和活性的化合物,有着广泛的生理作用和治疗用途。1988年我国学者在国际上首次使用全反式维甲酸(all-trans retinoic acid,ATRA)诱导分化治疗急性早幼粒细胞白血病(acute promyelocytic leukemia,APL)并获得了成功[1]。目前,ATRA已经广泛用于治疗APL[2]等恶性肿瘤,且已成为治疗白血病的首选药物之一。由于ATRA在治疗过程中可使患者出现维甲酸综合征[3]、耐药性[4]等问题使其临床应用受到了限制。因此,国内外对维甲酸类药物展开了结构修饰工作,希望能够拓宽药物的临床应用范围并减少不良反应。该文就新型维甲酸衍生物4-氨基-2-三氟甲基苯基维甲酸酯(4-amino-2-trifluoromethyl-phenyl retinate,ATPR)合成状况、抗肿瘤活性及作用机制予以综述。
1 新型维甲酸衍生物 ATPR的合成状况
众所周知,维甲酸类药物是由环己烯、极性基团和侧链3个部分组成,如将这3个部分用不同的化学基团取代,即可衍生出许多生物活性及作用特点不同的化合物。
Shen et al[5]以ATRA和三氟甲苯衍生物为原料,采用DCC-DMAP法,合成了一系列维甲酸衍生物,并通过1H-NMR,13C-NMR和HR-MS确认维甲酸衍生物结构。抗肿瘤活性筛选结果表明,化合物1D,即ATPR(图1)能有效抑制急性早幼粒细胞白血病细胞(leukemia cell lines NB4,NB4)增殖并诱导其分化。
阮晶晶等[6]以ATRA为母核,在极性基团中引入含三氟甲基的苯酚或者苯胺结构,合成了10种维甲酸衍生物,体外证实这10种维甲酸衍生物中,ATPR显示出对NB4细胞较强的抑制增殖和诱导分化的活性。通过ATPR在大鼠体内的经时过程研究[7]显示,与ATRA比较,ATPR单次或多次给药后,血浆药物浓度均能够维持在较高的水平,且在体内的半衰期更长,平均停留时间更长,清除更慢。
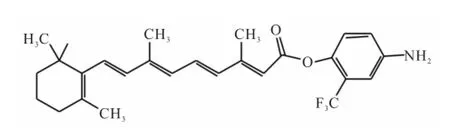
图1 ATPR结构式
2 新型维甲酸衍生物ATPR抗肿瘤生物活性研究现状
2.1 体外研究 目前维甲酸衍生物ATRA、13-cis-RA、9-cis-RA等不仅是重要的诱导分化剂而且已在临床上进行肿瘤治疗和预防。可以说,维甲酸衍生物具有良好的抗肿瘤治疗前景。大量研究[8-20]表明,新型维甲酸衍生物ATPR对于体外培养的多种肿瘤细胞有一定的抑制增殖和诱导分化作用且抗肿瘤活性优于ATRA。
体外抗肿瘤活性测定结果显示,ATPR对白血病[8]、肺腺癌[9-12]、肝癌[13]、乳腺癌[14-17]、卵巢癌[18]、胃癌[19]、鼠淋巴瘤[20]等多种肿瘤细胞均敏感,呈剂量和时间依赖性抑制细胞增殖。流式细胞仪检测细胞周期显示,G0/G1期细胞表达量明显增加,S期细胞表达量减少,提示ATPR可使细胞呈G0/G1期阻滞。瑞氏染色法检测到加药后肿瘤细胞形态趋于分化成熟,NBT还原实验分析分化指标显示NBT阳性细胞率增加,ELISA法检测相应肿瘤标志物抗原的表达水平显示ATPR是有效的诱导分化剂,甚至比ATRA更有效的刺激分化。
另外,张海涛等[13]发现ATPR不但是肝癌细胞(HepG2)有效的分化诱导剂,还能明显促进肝癌细胞凋亡,10μmol/L ATPR作用3 d后使HepG2细胞凋亡率达到38.1%,在细胞周期分布图上细胞凋亡峰明显前移。同样,15μmol/L ATPR作用48 h后就可使人乳腺癌细胞(MDA-MB-231)凋亡率达到33.2%,而相同浓度的ATRA却没有凋亡效果[17]。Hu et al[19]使用50μmol/L的ATPR作用于胃癌细胞(MKN-74)24 h后,发现细胞周期蛋白Cyclin E表达水平降低,促凋亡蛋白Bax表达增加,说明ATPR诱导了胃癌细胞凋亡。
值得一提的是,ATPR还阻碍肿瘤细胞迁移。研究[11-12]表明,ATPR处理人肺腺癌细胞(A549)3 d后,ATPR可降低迁移相关蛋白MLCK、p-MLC、pp38蛋白在A549细胞中的表达,随着药物浓度的增加,下调作用更为显著,说明ATPR可阻碍A549细胞迁移。ATPR也可抑制MDA-MB-231细胞迁移,ATRA处理48 h后,MDA-MB-231细胞的相对迁移率为90%,而ATPR同样处理后则为50%[16]。
2.2 体内研究 动物实验在新型抗肿瘤药的评价和筛选过程中有着十分重要的作用。在ATPR体外研究的基础上,体内研究也逐渐展开并证实ATPR的抗肿瘤效应。
王新群[21]以ATRA为阳性对照药物,采用隔日腹腔注射的方法,观察了ATPR(5、10、20 mg/kg)对人胃癌细胞(SGC-7901)BALB/c-nu/nu移植瘤裸鼠的治疗作用。结果表明,ATPR(20 mg/kg)连续给药5周后移植瘤重量及瘤体积显著减小,说明ATPR对裸鼠移植瘤生长具有抑制作用。HE染色可见ATPR组部分瘤细胞出现固缩凋亡。另外,ATPR使 G0/G1期细胞数目明显增加,S期、G2/M期细胞数目减少,细胞周期明显受到抑制。待裸鼠饲养至衰竭时处死或者让其自然死亡,记录死亡时间,其中,ATPR 20 mg/kg剂量组的生命延长率为11.02%,可将小鼠生存期延长将近2周。而ATRA组的生命延长率为9.8%。
陈慧慧[22]建立了NB4细胞 NOD/SCID免疫缺陷小鼠模型,并于建模后第7天开始腹腔注射ATPR(5、10、20 mg/kg),隔日给药,连续4周后取腹水瘤细胞观察形态,发现ATPR(20 mg/kg)给药后肿瘤细胞体积缩小,核仁消失,染色质增粗,胞质增多,核浆比例缩小,核偏于一侧,说明ATPR可诱导腹水瘤细胞分化成熟。NOD/SCID小鼠瘤组织处于G0/ G1期的细胞占(50.12±3.54)%,而ATPR(5、10、20 mg/kg)处理后瘤细胞G0/G1期的细胞显著增多。ATPR不仅使小鼠体内NB4细胞增殖受到抑制,腹水及实体瘤的形成时间延长,还使荷瘤小鼠的生存期显著延长,ATPR(5、10、20 mg/kg)给药小鼠的生存期分别为(39.00±6.48)、(44.40±5.46)、(50.20±4.87),生命延长率则分别达到13.04%、28.70%、45.51%。
药物在体内的分布部位及浓度高低与其药理作用效果密切相关。詹侠等[23]通过对SD大鼠灌胃给ATPR和静脉注射给ATPR两种方式后,HPLC法测定各组织中ATPR浓度;发现ATPR在肝、脾、肾、肺等组织的药物浓度均在10-5~10-9mol/L范围内,表明ATPR对肝、脾等肿瘤均有利于发挥抗肿瘤作用。另外,两种途径给药后ATPR均能在肝脏维持较高浓度,对肝组织的靶向性均较高,提示ATPR在治疗肝癌方面可能会有较好的靶向作用。
3 新型维甲酸衍生物ATPR衍生物抗肿瘤机制研究
3.1 抑制肿瘤细胞增殖、诱导细胞周期阻滞 近年来,对维甲酸衍生物ATPR抗肿瘤作用机制的研究愈来愈多,但其确切机制仍不清楚。目前研究表明,ATPR的抗肿瘤作用机制主要包括抑制肿瘤细胞增殖[18]、诱导细胞周期阻滞[8],诱导细胞分化[20]和凋亡[13],抑制肿瘤细胞侵袭[16]并阻断肿瘤细胞信号转导通路[11]等方面。
无限增殖性是恶性肿瘤细胞最显著的特点,细胞周期调控异常与细胞癌变密切相关。而细胞周期是细胞生命活动的基本过程,分为G0/G1、S、G2、M期,其中G0/G1期是决定细胞增殖状态的关键阶段,该期阻滞可使细胞增殖周期延长,增殖减慢。诱导细胞周期阻滞是抑制肿瘤细胞增殖的重要机制。
阮晶晶等[8]首先报道了ATPR使细胞周期蛋白Cyclin D1、Cyclin E表达量减少,周期蛋白依赖性激酶CDK2、CDK4、CDK6也有不同程度的减少,而细胞周期依赖激酶抑制因子P57kip2表达量则增加明显,提示ATPR很可能是通过上调P57kip2的表达从而抑制Cyclin-CDK激酶复合物,使细胞周期停滞于G1期。吴繁荣等[18]使用MTT法分析ATPR对卵巢癌细胞(SKOV3)的抑制作用,结果表明抑制细胞增殖呈剂量依赖性,其中1×10-5mol/L ATPR抑制效应最强,在72 h抑制效应达到最大,对卵巢癌最高抑制率达22.7%。LDH法检测细胞毒性实验提示ATPR抑制鼠淋巴瘤细胞(YAC-1)增殖可能与其细胞毒性相关[20]。
另外,维甲酸类药物通过与核受体RARs或RXRs结合,激活目的基因,从而参与调控多种重要生理过程[20]。RARβ沉默后,对ATPR敏感的 SGC-7901细胞表现出ATPR抗性,提示RARβ可能介导ATPR抑制细胞增殖[24]。Wang et al[11]发现ATPR也可下调RXRα的表达,同时上调RARα及RARγ的表达,推测ATPR通过影响RARs和RXRs的表达和分布来抑制A549细胞的增殖。还有研究[19]显示转录因子(AP-1)与细胞生长,增殖有关,而ATPR可明显抑制AP-1活性,提示ATPR参与RXR介导的抑制AP-1活性也可能是其抑制机制。维甲酸受体诱导基因1(RRIG1)是RAR-β2的下游基因,能够抑制肿瘤细胞生长和侵袭。Wang et al[15]证明ATPR明显抑制人乳腺癌细胞(MCF-7)增殖并诱导其分化,可能与上调RRIG1表达,降低p-ERK的表达,提高ERβ和p-p38的表达有关。
3.2 诱导细胞分化 细胞分化是指细胞后代在形态、结构和功能上发生差异的过程,细胞一旦沿一定方向分化,一般不能再反分化到原来的幼稚形态,是细胞由幼稚转向成熟的标志,因而分化过程的完成也标志着细胞再增殖能力的丧失。肿瘤细胞的周期特点是细胞群体主要分布在DNA合成活跃的S期,而分化细胞群体主要分布在DNA合成静止的G0/ G1期,这也与ATPR诱导肿瘤细胞出现G0/G1期阻滞相吻合。
myc基因家族是一组在细胞增殖、分化、凋亡中发挥重要作用的原癌基因,其基因产物c-myc蛋白在许多肿瘤中存在着异常表达,与细胞增殖和分化密切相关的端粒酶活性的激活与端粒酶逆转录酶(human telomerase reverset transcriptases,hTERT)的转录水平高度一致[25]。陈慧慧等[25]最先报道了1 μmo l/L ATPR诱导NB4细胞分化过程中,c-myc蛋白表达与hTERT的表达水平均呈下降趋势,所以预测ATPR可能是通过抑制c-myc蛋白的表达从而抑制hTERT及端粒酶活性,最终诱导NB4细胞分化。另外,RARβ基因靶向沉默后,ATPR对SGC-7901细胞的诱导分化能力显著下降,提示RARβ也可能参与ATPR诱导分化[24]。有研究[14]表明,ATPR诱导分化机制还可能通过调节维甲酸受体和雌激素受体的平衡,并上调RRIG1表达有关。
3.3 诱导细胞凋亡 细胞凋亡亦称细胞程序性死亡,是一种细胞的主动死亡过程,是一个受细胞内基因及细胞外因子多因素调控的过程。诱导肿瘤细胞凋亡是目前大多数抗肿瘤药物共有的药理研究机制之一。
张海涛等[13]经过体外实验证实ATPR显著抑制抗凋亡蛋白Bcl-2、Bcl-xS/L和p-Erk表达,指出ATPR可能是通过MAPK通路影响Bcl-2家族蛋白以及骨桥蛋白(osteopontin,OPN)的表达,促使线粒体释放细胞色素C从而影响Caspase家族蛋白表达,最终导致细胞凋亡。赵大海[9]用ATPR作用于A549细胞,HE染色观察到了凋亡细胞。ATPR可降低细胞周期蛋白Cyclin E表达水平,增加促凋亡蛋白Bax的表达,降低Bcl-2/Bax比率,Bcl-2/Bax比率降低还与促凋亡蛋白Caspase-3活化和后续的凋亡有关[19]。
Wang et al[17]证明ATPR抑制ERK、JNK和 p38的磷酸化,还抑制了内质网应激蛋白BiP蛋白的表达,提高了CHOP蛋白的表达。ATPR降低RXRα蛋白的表达,同时还降低了RARβ和 RXRβ的表达。故推测ATPR诱导细胞凋亡,可能是通过ATPR 与RARβ/RXRβ复合体结合,进而激活MAPK通路介导的内质网应激有关。周佳丽等[26]深入研究发现,与ATRA比较,相同浓度的ATPR能明显促进细胞凋亡,且随着浓度的增加,凋亡作用越加显著。ATPR下调抗凋亡蛋白Bcl-2、NF-κB、survivin的表达,上调促凋亡蛋白Bax、Grim-19、Caspase-3的表达。Hoechst染色结果显示ATPR处理细胞可出现明显的凋亡小体,且随着浓度升高,凋亡小体显著增多,而ATRA组凋亡小体明显少于ATPR组。
ATPR诱导细胞凋亡是复杂的,受多因素影响的,而ATPR诱导细胞凋亡的作用靶点和机制目前还不清楚,需要再行研究。
3.4 抑制肿瘤细胞侵袭、转移 肿瘤细胞的迁移是肿瘤浸润和转移的关键步骤,有效控制侵袭和转移是治疗肿瘤的有效途径之一。近年来显示肌球蛋白轻链激酶MLCK与肿瘤转移密切相关,但分子机制尚不明确。
研究[27]显示,ATPR能显著抑制肿瘤细胞侵袭和转移。5 mg/L ATPR对A549细胞的抑制率为66%,而相同浓度的ATRA处理后抑制率则为40%。ATPR处理3 d后,可下调细胞相关蛋白MLCK、p-MLC和p38蛋白的磷酸化表达水平,且随着药物浓度的增加下调作用增强,提示ERK-MARK通路介导的MLCK蛋白的低表达也可能是ATPR抑制细胞迁移机制之一。
ATPR也可能通过RARβ/MLCK通路抑制胃腺癌细胞 (BGC823)的迁移[28]。因而,下调 MLCK的磷酸化水平进而抑制细胞迁移,可能是ATPR抑制肿瘤侵袭的部分机制。
3.5 异常肿瘤细胞信号转导通路 肿瘤的发生与发展是级联反应,非常复杂。各种刺激通过细胞内生长因子、细胞因子等介质与相应受体结合后诱发细胞内一系列级联反应,使细胞发生抑制增殖、周期停滞和凋亡等反应,由此构成细胞信号转导系统。细胞信号转导系统在肿瘤的发生发展中有着重要作用。
近年来,人们逐渐认识到肿瘤发生的本质是细胞信号转导通路异常,从而导致肿瘤细胞过度增殖、浸润与转移等。
王梅等[10]发现ATPR组OPN的表达下降、c-Jun氨基末端激酶(JNK)磷酸化水平上升,且A549细胞增殖率与OPN的表达量呈正比;加入JNK通路抑制剂后,OPN的表达量上升。说明ATPR显著抑制A549细胞增殖,可能是通过激活JNK通路,上调JNK磷酸化水平并抑制骨桥蛋白OPN的表达。
淋巴瘤细胞中抑制Akt的磷酸化可以降低Cyclin D的过表达从而抑制肿瘤细胞的生长[20]。彭晓清等[20]指出 ATPR抑制肿瘤细胞增殖并诱导其分化可能是参与调节PTEN/PI3K/Akt信号通路,从而抑制Cyclin D的过表达。
随着对ATPR参与调节的细胞信号转导通路的不断研究,将其研制成新型靶向性的信号转导抑制剂也是一个非常值得开发的领域。
4 新型维甲酸衍生物ATPR的前景
20世纪末以来,诱导分化治疗逐渐成为肿瘤治疗研究最活跃的领域之一。此类治疗手段的基本特点在于药物并不直接杀伤肿瘤细胞而是诱导其分化帮助其成为正常或接近正常的细胞,这样就避免了骨髓抑制、免疫抑制等毒副作用,因而具有良好的临床应用前景。
ATRA作为经典的细胞分化诱导剂,开创了诱导分化治疗肿瘤的新思路,使肿瘤的治疗研究有了质的飞跃。但由于ATRA具有使患者出现维甲酸综合征及耐药性等缺点,使其应用受限。因此,寻找疗效更好的维甲酸衍生物成为必然。
大量研究表明,新型维甲酸衍生物ATPR在抑制肿瘤细胞增殖和诱导其分化等方面都明显优于ATRA,抑瘤效果明显,已被多数学者认同。值得注意的是,研究[29]表明,ATPR(10-4mol/L)的主要作用机制为细胞毒作用,而在10-5mol/L及以下浓度时则以诱导分化为主要机制。所以,还应加强ATPR的临床研究,进一步明确不同浓度的ATPR抗肿瘤的作用机制及不良反应,使ATPR真正造福于人类。
随着对肿瘤细胞的深入研究,开发分子靶向性维甲酸类药物将可能在肿瘤治疗领域取得突破性和革命性进展。因此,深入研究ATPR对肿瘤细胞作用的信号通路,寻找分子作用靶点,不仅对开发维甲酸类抗肿瘤药物具有重要的科学意义,还将为人类最终攻克肿瘤开辟广阔的前景。
[1] Huang M E,Ye Y C,Chen S R,et al.Use of all-trans retinoic acid in the treatment of acute promyelocytic leukemia[J].Blood,1988,72(2):567-72.
[2] Machida H,Shinohara T,Iwahara Y,et al.Acutemyeloid leukemia with myelodysplasia-related changesmimicking acute promyelocytic leukemia[J].Intern Med,2011,50(24):3037-41.
[3] Dhar A K,Barman PK.Retinoic acid syndrome-cardiac complication[J].JAssoc Physicians India,2012,60:63-5.
[4] Tomita A,KiyoiH,Naoe T.Mechanisms ofaction and resistance toall-transretinoic acid(ATRA)and arsenic trioxide(As2O3)in acute promyelocytic leukemia[J].Int JHematol,2013,97(6):717 -25.
[5] Shen J,Shi JB,Chen FH,etal.Synthesis and anti-tumor activity ofall-trans retinoic acid derivatives[J].Chinese Chemical Letters,2009,20(7):809-11.
[6] 阮晶晶,陈飞虎,徐 佼,等.新型维甲酸衍生物诱导NB4细胞分化的初步研究[J].中国临床药理学与治疗学,2008,13 (11):1237-42.
[7] Zhan X,Chen F H,Tang JH,et al.Pharmacokinetics of 4-amino-2-trifluoromethyl-phenyl retinate,a novel derivate of all-trans-retinoic acid with anti-tumor activity[J].Lat Am JPharm,2014,33 (2):294-301.
[8] 阮晶晶,陈飞虎,徐 佼,等.4-氨基-2-三氟甲基苯基维甲酸酯对K562细胞分化和细胞周期的影响[J].中国药理学通报,2009,25(9):1238-43.
[9] 赵大海.4-氨基-2-三氟甲基苯基维甲酸酯对肺腺癌细胞株A549分化和增殖的影响[J].临床肺科杂志,2009,14(12):1642-3.
[10]王 梅,赵佳佳,桂淑玉,等.全反式维甲酸及其衍生物4-氨基-2-三氟甲基苯基维甲酸酯对A549细胞增殖和OPN表达的影响[J].安徽医科大学学报,2012,47(11):1312-5.
[11]Wang H,Gui SY,Chen FH,et al.New insights into 4-amino-2-tri-fluoromethyl-phenyl ester inhibition of cellgrowth andmigration in the A549 lung adenocarcinoma cell line[J].Asian Pac JCancer Prev,2013,14(12):7265-70.
[12]Fan T T,Cheng Y,Wang Y F,et al.A novel all-trans retinoid acid derivative N-(3-trifluoromethyl-phenyl)-retinamide inhibits lung adenocarcinoma A549 cellmigration through down-regulating expression ofmyosin light chain kinase[J].Asian Pac JCancer Pre,2014,15(18):7687-92.
[13]张海涛,何 苇,桂淑玉,等.4-氨基-2-三氟甲基苯基维甲酸酯对肝癌细胞株HepG2增殖凋亡分化的影响[J].安徽医科大学学报,2010,45(2):204-8.
[14]汪 楠,陈飞虎,葛金芳,等.4-氨基-2-三氟甲基苯基维甲酸酯对MCF-7细胞增殖和分化的影响及其机制研究[J].中国药理学通报,2013,29(6):767-72.
[15]Wang N,Ge JF,Pan C X,et al.Anti-tumor effect of 4-Amino-2-Trifluoromethyl-Phenyl Retinate on human breast cancer MCF-7 cells via up-regulation of retinoid receptor-induced gene-1[J].Biomed Pharmacother,2013,67(8):687-92.
[16]Wang B,Yan YW,Zhou J,etal.A novelall-trans retinoid acid derivatives inhibits the migration of breast cancer cell lines MDAMB-231 via myosin light chain kinase involving p38-MAPK pathway[J].Biomed Pharmacother,2013,67(5):357-62.
[17]Wang B,Yan Y W,Zhou Q,et al.A novel all-trans retinoid acid derivative induces apoptosis in MDA-MB-231 breast cancer cells [J].Asian Pac JCancer Prev,2014,15(24):10819-24.
[18]吴繁荣,洪凡青,陈飞虎,等.新型维甲酸衍生物ATPR对肿瘤细胞株SKOV3增殖及分化的影响[J].中国临床药理学与治疗学,2013,18(3):247-52.
[19]Hu K W,Pan X H,Chen F H,et al.A novel retinoic acid analog,4-amino-2-trifluoromethyl-phenyl retinate,inhibits gastric cancer cell growth[J].Int JMol Med,2014,33(2):415-22.
[20]彭晓清,陈飞虎,葛金芳,等.4-氨基-2-三氟甲基苯基维甲酸酯通过PTEN/PI3K/Akt抑制YAC-1细胞增殖和诱导其分化[J].中国药理学通报,2014,30(1):60-5.
[21]王新群.4-氨基-2-三氟甲基苯基维甲酸酯(ATPR)对人胃癌SGC-7901移植瘤裸鼠的治疗作用及机制研究[D].安徽医科大学,2012.
[22]陈慧慧.4-氨基-2-三氟甲基苯基维甲酸酯对移植性人白血病模型小鼠的作用及对维甲酸受体和维甲类X受体的影响[D].安徽医科大学,2011.
[23]詹 侠,陈飞虎,汤继辉,等.新型维甲酸衍生物ATPR大鼠体内组织分布的研究[J].中国药理学通报,2014,30(7):985-8.
[24]王新群,陈飞虎,葛金芳,等.RARβ沉默对4-氨基-2-三氟甲基苯基维甲酸酯抗SGC-7901细胞增殖作用的影响[J].安徽医药,2012,16(8):1066-9.
[25]陈慧慧,陈飞虎,徐 佼,等.c-myc、hTERT在4-氨基-2-三氟甲基苯基维甲酸酯诱导NB4细胞分化中的作用[J].安徽医科大学学报,2011,46(3):235-9.
[26]周佳丽,颜蕴文,江巧玲,等.全反式维甲酸及其衍生物对乳腺癌细胞株MDA-MB-231凋亡的影响[J].安徽医科大学学报,2015,50(2):154-7.
[27]王 浩.4-氨基-2-三氟甲基苯基维甲酸酯对肺腺癌A549细胞增殖和迁移影响及其可能的机制[D].安徽医科大学,2014.
[28]杨艳艳.全反式维甲酸(ATRA)及其衍生物4-氨基-2-三氟甲基苯基维甲酸酯(ATPR)对人胃腺癌细胞株BGC823迁移的影响及其机制的初步探讨[D].安徽医科大学,2014.
[29]吴 菲,陈飞虎,洪凡青,等.ATPR对 ECA-109、PANC-1、HeLa细胞增殖及分化的影响[J].中国癌症杂志,2012,22 (4):257-63.
R 979.1;R 965.1;R 966
A
1000-1492(2016)04-0606-05
2015-12-21接收
国家“重大新药创制”科技重大专项(编号:2011ZX09401-021)
1安徽医科大学药学院,合肥 230032
2安徽医科大学第一附属医院药剂科,合肥 230022
孟 遥,女,硕士研究生;
陈飞虎,男,博士,教授,博士生导师,责任作者,E-mail:cfhchina@sohu.com
