呼吸道合胞病毒空斑形成实验的条件优化
2016-08-09汪旻旻黄升海
于 莉,吴 璇,汪旻旻,黄升海
◇经验与体会◇
呼吸道合胞病毒空斑形成实验的条件优化
于 莉,吴 璇,汪旻旻,黄升海
采用空斑形成实验方法测定呼吸道合胞病毒(RSV)的滴度,加入覆盖层倒置培养27、30、34、40 h后经固定染色、剔除覆盖层后,可见清晰透明空斑,边缘清晰、形态均为圆形或类圆形,空斑直径分别为1、1.5、3、5 mm左右。加入覆盖层后培养病毒的时间可以影响RSV最终所形成的空斑大小,并且随着时间的延长空斑逐渐增大,在30~34 h所形成的空斑大小最佳,易于计数。病毒的稀释度也会影响空斑最终形成的数量,且随着稀释度的增加,空斑数量逐渐减少。关键词 呼吸道合胞病毒;空斑形成实验;甲醛-结晶紫
网络出版时间:2016-3-8 8:29:02 网络出版地址:http://www.cnki.net/kcms/detail/34.1065.R.20160308.0829.064.htm l
呼吸道合胞病毒(respiratory syncytial virus,RSV)被认为是引起世界范围内婴幼儿严重下呼吸道感染最常见的病原体,也是引起免疫力低下患者和老年人下呼吸道感染的病原体之一[1-3]。因此RSV越来越受到重视,而对RSV致病机制的研究及抗RSV药物和疫苗的研发均需对RSV的滴度进行定量测定。国内外通常采用空斑计数对病毒进行滴度检测。该实验采用甲醛-结晶紫空斑法在原有的空斑形成实验方法上[4-5],通过对营养覆盖物培养时间的改变,就RSV在人喉癌上皮细胞(human larynx carcinoma epithelial cell,Hep-2)上在培养时间及病毒稀释度改变的条件下所形成空斑的大小及数量进行研究,进而进行条件优化。拟达到相对较好的实验条件,能够更精确地对病毒滴度进行检测,并且重复性相对较好,为临床病程的判断提供更准确的参考信息。
1 材料与方法
1.1 细胞及病毒 Hep-2细胞为人喉癌上皮细胞,RSV为国际标准株Long株,以上均由安徽医科大学微生物学教研室保存。
1.2 主要试剂 新生牛血清(杭州四季青公司);DMEM培养基(美国Gibco公司);琼脂糖(上海生工生物工程股份有限公司);6孔细胞培养板(中国Nest Biotechnology公司)。
1.3 细胞培养及病毒增殖 用含10%新生牛血清的DMEM培养液培养Hep-2细胞,长至80%时,用0.25%胰酶消化传代;将细胞经0.25%胰酶消化后接种至细胞培养瓶中,待细胞生长至60%~70%融合时,弃去培养液,PBS冲洗2次,取10 m l RSV加入Hep-2细胞中,37℃、5%CO2条件下孵育,15~30 min摇晃1次;2 h后,弃去上清液,加入含3%新生牛血清的DMEM病毒维持液10 ml,37℃、5% CO2条件下孵育;至Hep-2细胞典型融合病变达90%~100%时,将细胞刮下,4℃、3 000 r/min离心10 min,收集上清液分装后冻于-80℃或液氮罐中备用。
1.4 空斑形成实验 实验过程:①以5.0×105的密度接种Hep-2细胞于6孔细胞培养板中,置于37℃、5%CO2培养箱中培养,使其24 h内长成单层;②在冰盘上用DMEM将RSV作10倍连续系列稀释(图1),即在一系列2 ml的EP管中先加入1.8 m l DMEM,取0.2ml RSV加入第一支Ep管中,充分混匀后的该RSV病毒悬液的稀释度为10-1,取混合后的0.2 ml病毒悬液加入第二支EP管中,该管中的病毒稀释度为10-2,依此类推作系列稀释,则得到连续10倍稀释的病毒悬液。随着稀释度的增加,病毒的毒力逐渐减弱;③弃去细胞培养板中各孔中的培养液,取稀释度为10-7~10-11的病毒悬液1 ml加入培养板中,剩下1孔不加病毒仅加入1 ml的DMEM作为正常对照,置37℃、5%CO2培养箱中吸附3 h,期间每15~30 min摇动1次,以保证病毒分布均匀;④弃去各孔中的病毒液,用PBS轻轻洗涤3次。每孔加入3 ml的营养琼脂覆盖层(含5%新生牛血清的 2×DMEM与1%琼脂糖等体积混匀),新生牛血清的终浓度为2.5%,琼脂糖为0.5%。室温下水平放置15 min使其凝固;⑤置于37℃、5%CO2培养箱中倒置培养。分别培养27、30、34、40 h后取出培养板,每孔加入2 ml含甲醛的结晶紫固定过夜。次日剔除覆盖层,用自来水轻轻冲洗后即可观察到清晰的空斑。
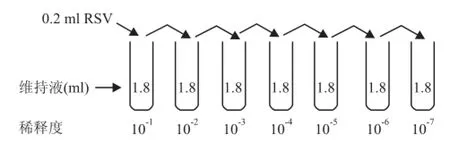
图1 RSV作10倍连续系列稀释
2 结果
加入营养琼脂覆盖层分别倒置培养27、30、34、40 h后,每孔加入2 ml含4%甲醛的结晶紫溶液固定染色。结果可见,加入覆盖层后培养27 h,进行固定染色过夜,剔除覆盖层,用自来水轻轻冲洗后可观察到直径约1 mm、形态为圆形或者类圆形的空斑,边缘整齐,清晰透明;且随着病毒稀释度的增加,空斑的数量逐渐减少。该培养时间点所形成的空斑面积较小,不易于计数(图2)。培养30 h及34 h的细胞培养板剔除覆盖层后,可观察到比27 h的空斑略大,直径分别约为1.5和3 mm,该时间段内形成的空斑较易于观察计数,且空斑的数量亦随着病毒的稀释逐渐减少(图3~4)。而培养40 h后则观察到直径为5 mm左右的大空斑,不易于计数,空斑形成的数量与病毒的稀释程度呈反比(图5)。
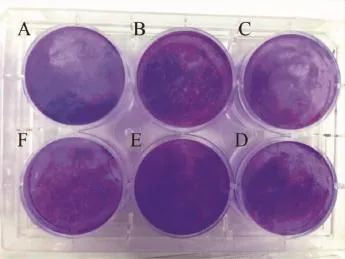
图2 加入覆盖层倒置培养27 h后经固定染色、剔除覆盖层所形成的空斑A:空白对照;B~F:病毒稀释度分别为 10-7~10-11
3 讨论
RSV是婴幼儿细支气管炎和病毒性肺炎的最重要原因,在婴幼儿中有较高的发病率及死亡率,而且可以引起中耳炎及呼吸暂停等一系列疾病[3,6]。在全球不同地区统计每年因RSV感染死亡的人数高达16万,而因并发RSV感染死亡的人数近60万[7]。因此,检测、预防和治疗RSV感染的研究非常重要。而在进行上述RSV相关基础研究时,首先要对RSV病毒的滴定进行测定。
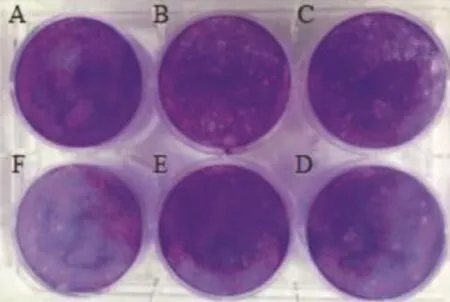
图3 加入覆盖层倒置培养30 h后经固定染色、剔除覆盖层所形成的空斑A:空白对照;B~F:病毒稀释度分别为 10-7~10-11
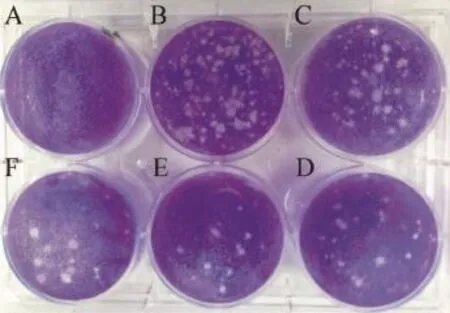
图4 加入覆盖层倒置培养34 h后经固定染色、剔除覆盖层所形成的空斑A:空白对照;B~F:病毒稀释度分别为 10-7~10-11
由于RSV是RNA病毒,属于副黏病毒属,对其进行病毒滴度的测定比DNA病毒更难。此前也有学者用免疫法测定 RSV滴度,但是一旦RSV融合(F)蛋白发生突变,抗F蛋白的单克隆抗体就会失效,从而导致空斑实验失败[8]。而传统的病毒空斑技术操作较繁杂,影响病毒空斑形成的因素较多,且用中性红染色的标本不能固定保存[9]。针对这些问题本研究采用甲醛-结晶紫空斑法对RSV进行空斑形成实验的研究。甲醛-结晶紫空斑法是利用病毒感染细胞后形成一个局限性的病变细胞区,由于结晶紫是碱性染料,可以与细胞核中的核酸结合,把核染成紫色。正常细胞经结晶紫染色后呈紫色,经甲醛作用固定于培养板上。而病毒感染所致病变的细胞则不能固定,被自来水冲掉形成空斑,肉眼可见圆形或类圆形斑。理论上一个最初感染细胞的病毒颗粒形成一个空斑,经结晶紫染色后即可直接肉眼观察、计数空斑,精确测定病毒感染单位量[10]。

图5 加入覆盖层倒置培养40 h后经固定染色、剔除覆盖层所形成的空斑A:空白对照;B~F:病毒稀释度分别为 10-7~10-11
应用此法测定RSV滴度简便易行、耗时短、成本低,能准确测定病毒的滴度,还可保留实验结果,并且重复性好,具有较高的稳定性[9]。但是影响空斑形成的因素有很多,本研究主要检测了在其他条件不变的情况下,培养时间及病毒毒力变化对空斑大小及其数量的影响。研究显示,RSV空斑形成实验中,感染RSV后加入覆盖层培养病毒的时间可以影响RSV最终所形成的空斑大小,并且随着时间的延长空斑逐渐增大。在加入覆盖层后培养感染RSV的Hep-2细胞30~34 h,得到的空斑清晰且易于计数;而且随着病毒的毒力减弱,空斑的数量逐渐减少。该条件下得到的空斑敏感性更高、定量更精确,且重复性好,能够为临床病程的判断提供更准确的参考信息,更好地为临床服务。
本实验中只对RSV病毒的空斑形成实验做了条件优化,没有以其他的病毒作为对照;另外也只做了不同培养时间和病毒稀释度这两个方面的影响因素,对琼脂糖浓度等条件并没有进行探讨,有待进一步完善。
[1] Nair H,Nokes D J,Gessner B D,et al.Global burden of acute lower respiratory infections due to respiratory syncytial virus in young children:a systematic review and meta-analysis[J].Lancet,2010,375(9725):1545-55.
[2] Hall C B.Respiratory syncytial virus in young children[J].Lancet,2010,375(9725):1500-2.
[3] 朱童娜,吴 璇,邱 欢,等.呼吸道合胞病毒感染人肺上皮细胞诱导氧化应激对TLR7基因及其下游因子表达的影响[J].安徽医科大学学报,2014,49(11):1539-43.
[4] Dulbecco R.Production of plaques inmonolayer tissue cultures by single particles ofan animal virus[J].Proc Natl Acad Sci U SA,1952,38(8):747-52.
[5] McKimm-Breschkin JL.A simplified plaque assay for respiratory syncytial virus-direct visualization of plaqueswithout immunostaining[J].JVirol Methods,2004,120(1):113-7.
[6] Chen YW,Huang Y C,Ho T H,etal.Viral etiology ofbronchiolitis among pediatric inpatients in northern Taiwan with emphasis on newly identified respiratory viruses[J].JMicrobiol Immunol Infect,2014,47(2):116-21.
[7] 朱传凤,傅生芳,寇桂英,等.人呼吸道合胞病毒黏附蛋白片段的原核表达和纯化[J].中国生物制品学杂志,2012,25 (4):389-92.
[8] Shinoff JJ,O′Brien K L,Thumar B,etal.Young infants can develop protective levels of neutralizing antibody after infection with respiratory syncytial virus[J].J Infect Dis,2008,198(7):1007 -15.
[9] 蒋 虹,乔红伟,丛 嚣,等.SARS-CoV细胞空斑试验[J].中国比较医学杂志,2009,19(8):65-6.
[10]王金华,陈爱欢.甲基纤维素-结晶紫空斑法在呼吸道合胞病毒检测中的应用[J].中华临床医师杂志,2013,7(23):10806-8.
Condition optim ization for plaque form ing test of respiratory syncytial virus
Yu Li,Wu Xuan,Wang Minmin,et al
(Dept of Microbiology,Anhui Medical University,Hefei 230032)
Respiratory syncytial virus(RSV)titerswere investigated by plaque formation assay.Clarity and boundary clear plaques could be visible after fixed dyeing and removed covers after joining covering cultivation 27,30,34,and 40 h.Round or class round plaque morphologies and plaques in 1,1.5,3 and 5 mm diameter were formed in different layer inversion training time,respectively.Plaques size which was formed by RSV could be affected by virus incubation time after added layer and plaques dimensionswere increased gradually with the time extending in the plaque formation assay for RSV.The plaques were easy to be counted during 30~34 h in which the best size and number ofplaques could be detected.The number of plaques formed eventually could also be affected by the dilution of virus and with the increase of dilution degrees,the reduction of plaque quantitieswas observed. Key words respiratory syncytial viruses;plaque forming assay;formaldehyde-crystal violet
R 373.14
A
1000-1492(2016)04-0595-04
2016-01-18接收
国家自然科学基金(编号:81371797);安徽高校省级自然科学研究重点项目(编号:KJ2012A152)
安徽医科大学基础医学院微生物学教研室,合肥 230032作者简介:于 莉,女,硕士研究生;
黄升海,男,教授,硕士生导师,责任作者,E-mail:huangshh68@aliyun.com
