酿酒酵母组蛋白H3K14乙酰化对H3K4三甲基化的影响
2016-08-09史晨霞薛涛涛赵秀娟崔向军
史晨霞,薛涛涛,赵秀娟,周 媛,梁 栋,崔向军
(内蒙古科技大学 a.数理与生物工程学院;b.生物工程与技术研究所,内蒙古 包头 014010)
0 引言
在细胞里,DNA核心组蛋白有两个结构域:折叠区和氨基末端(N末端)结构域.N末端结构域上的氨基酸位点常发生多种共价修饰,比如乙酰化、甲基化、磷酸化、泛素化和ADP核糖基化等[1].这些组蛋白修饰是在多种组蛋白修饰酶催化下形成的,比如催化酿酒酵母H3K4me3(组蛋白H3第四位赖氨酸(K)的三甲基化)的甲基化酶Set1,以及催化H3K14Ac(Ac:乙酰化)修饰的乙酰化酶Gcn5[2].不同种类的组蛋白修饰对于基因的表达发挥着相异的作用.组蛋白乙酰化通常情况下促进基因表达,它也可与抑制基因表达有关[3].组蛋白甲基化的生物学作用依赖于修饰的位点和种类,或促进基因表达,或抑制基因表达[4].越来越多的证据表明多种修饰之间存在关联关系和因果关系.例如,启动子和增强子区域分别发现H3K4me3/H3K27me3组合以及H3K4me1/H3K27Ac组合[5].H3S10磷酸化可以促进由Gcn5催化的H3K4乙酰化[6];H4R3甲基化有利于P300 (组蛋白乙酰转移酶) 催化H4K8和H4K12的乙酰化[7].另外,H2BK123单泛素化可以借助相关酶蛋白调节H3K4和K79甲基化;H4K16和H4K12位点突变会影响H3K56的乙酰化,但H4组蛋白的其他位点不能产生与此相同的作用[8].
为了研究酿酒酵母组蛋白修饰之间的因果组合关系,课题小组分别以LIU等和POKHOLOK等建立的修饰数据库为基础[9-10],通过对相关实验数据中芯片探针和基因的筛选、酵母转录起始位点的确定、筛选的修饰数据的校验、建立修饰相关群体和构建组蛋白修饰网络等一系列理论方法,研究了修饰之间的因果关系[11-12].本研究通过相关实验验证酵母中的这一修饰因果关系.
1 材料和方法
1.1 材料
1.1.1 实验材料 酿酒酵母BY4741 和包含质粒H3K14A(赖氨酸K突变为丙氨酸A)的大肠杆菌由清华大学生命科学学院戴俊彪博士馈赠,该质粒含有酿酒酵母H3K14位点突变的H3编码序列.选择酿酒酵母BY4741为目的菌株,是因为LIU等在该菌株的基础上完成了CHIP-chip实验,从而得到前期理论工作使用的相关组蛋白修饰数据.
酵母组蛋白H3基因(HHT1和HHT2)和H4基因(HHF1和HHF2)在细胞中分别有2个拷贝,HHT1和HHF1位于II号染色体,HHT2和HHF2位于XIV号染色体.使用的BY4741菌株已经将II号染色体的HHT1和HHF1基因敲除,但XIV号染色体的HHT2和HHF2保留.
1.1.2 实验试剂 BciVI酶,New England Biolabs公司;高保真Taq酶,TaKaRa公司;内参抗体(αtubulin和H3抗体)和H3K4me3抗体(兔源),abcam公司;辣根过氧化物酶标记的二抗(羊抗兔),GE healthcare公司;Ura Minus Media Droupout,北京泛基诺科技有限公司;PVDF膜,Millipore公司;质粒小提试剂盒,天根生化科技有限公司;引物,江苏金唯智生物技术公司合成.其他试剂均为国产分析纯.
1.1.3 培养基 YPD培养基:1%酵母提取物,2%蛋白胨,2%葡萄糖;SC-Ura固体培养基:0.67%YNB, 2%葡萄糖,2%琼脂,0.13 % Ura Minus Media Droupout.
1.2 方法
1.2.1 H3K14突变菌株的构建 在敲除HHT1和HHF1基因的酿酒酵母BY4741菌株的基础上构建H3K14位点突变菌株(BY4741-H3A14).使用质粒小提试剂盒提取质粒;BciVI酶酶切质粒,15 μL体系:Plasmid DNA 6μL、NEB buffer4 (10×) 1.5 μL、 BciVI (10 000u/mL) 0.2 μL、 无菌水7.3 μL,37 ℃水浴过夜酶切.该酶在质粒有4个酶切位点,四段酶切产物长度分别为4071 bp、2575 bp、1527 bp、613 bp,其中有效片段(含有突变位点)长度为4071 bp.
质粒酶切后,针对有效片段转化酵母细胞;通过Ura缺陷平板筛选转化成功的细胞;在平板上随机挑取8个菌落进行菌落PCR,初步判断所鉴定菌落是否转化成功.围绕目的基因(Ura)设计引物,上游引物为:5'-GGAGCCATTTGTTAATATACCGTCTCATC-3'下游引物为:5'-CTGTGCTCCTTCCTTCGTTC-3'.反应条件为:Taq酶 0.1 μL、10×Buffer 1 μL、dNTP 1 μL、上游引物 0.5 μL、下游引物 0.5 μL、Triton×100 0.5 μL、加无菌水至10 μL.反应程序为:94 ℃预变性5 min,94 ℃变性30 s、55 ℃退火30 s、72 ℃延伸1 min,共30个循环,最后72 ℃延伸7 min[13].
菌落PCR之后提取酵母基因组,针对转化片段进行左臂和右臂的PCR验证(在PCR验证时需做阴性对照,反应程序及条件和阳性对照相同).左臂验证PCR所需引物序列如下,上游引物为:5'-GGAGCCATTTGTTAATATACCGTCTCATC-3',下游引物为:5'-CTGTGCTCCTTCCTTCGTTC-3';阴性对照引物如下,上游引物为:5'-GGAGCCATTTGTTAATATACCGTCTCATC-3',下游引物为:5'-GAATCCGTCGAAGCATACTTA-3'.右臂验证PCR所需引物如下,上游引物为:5'-GAATTTGATACATAAGGCTC GCTCTAG-3',下游引物为:5'- GAGGTCGCTC TTATTGACCACACC-3';阴性对照引物如下,上游引物为:5'- GAATTTGATACATAAGGCTCGCTCTAG-3',下游引物为:5'-GCCAAGAGAAAGACTGTTACTTCTTTG-3'[11].左臂右臂PCR反应条件均为:Taq酶0.1 μL、10×Buffer 1 μL、dNTP 1 μL、上游引物 0.5 μL、下游引物 0.5 μL、基因组模板1 μL、加无菌水至10 μL.反应程序同为:94 ℃预变性5 min,94 ℃变性30 s、55 ℃退火30 s、72 ℃延伸1 min,共30个循环,最后72 ℃延伸7 min.
验证转化成功后, PCR扩增含有突变位点的HHT1基因片段.引物由苏州金唯智生物科技有限公司合成.上游引物为5'-GCCTGGCTTGTATCTGTG-3';下游引物为5'-GGTCATTTAGCGTTCATT-3'.反应条件为:Taq酶 0.3 μL、10×Buffer 5 μL、dNTP 4 μL、上游引物 2 μL、下游引物 2 μL、基因组模板5 μL、加无菌水至50 μL.反应程序为:94 ℃预变性2 min,94 ℃变性30 s、55 ℃退火30 s、72 ℃延伸20 s、共30个循环,最后72 ℃延伸7 min.琼脂糖凝胶电泳检测扩增结果,测序该目的序列.
1.2.2 H3K4me3的Western Blot检测 制备酵母总蛋白样品.收集OD600值0.5~1.0对数期酵母细胞,用无菌水洗一遍;用500 μL~1 mL 0.1 mol/L NaOH室温处理8 min,12 000 r/min离心30 s,去上清;沉淀用1× sample buffer 重悬;100 ℃煮5~10 min,13 000 r/min离心3 min;上清点样;15%的聚丙烯酰胺凝胶分离组蛋白,恒压80 V跑浓缩胶约40 min,120 V跑分离胶约2 h.切胶之后,恒流300 mA 1.5 h转PVDF膜;5%脱脂奶粉的TBST溶液封闭,室温30 min;将H3K4me3抗体以1∶2000的比例加入到含5%脱脂奶粉的TBST溶液中,4 ℃孵育过夜;TBST室温洗膜,每次10 min,重复3次;二抗以1∶2000的比例加入到含5%脱脂奶粉的TBST溶液中,室温孵育1 h;用GE公司的Image Quant LAS4000凝胶成像系统显影.
2 结果和分析
2.1 突变菌株的菌落PCR扩增结果检测
菌落PCR扩增基因片段后,用1%琼脂糖凝胶电泳观察结果,得到与预期片段(700 bp)大小相符的单一扩增条带,见图1.8个菌落转化成功.
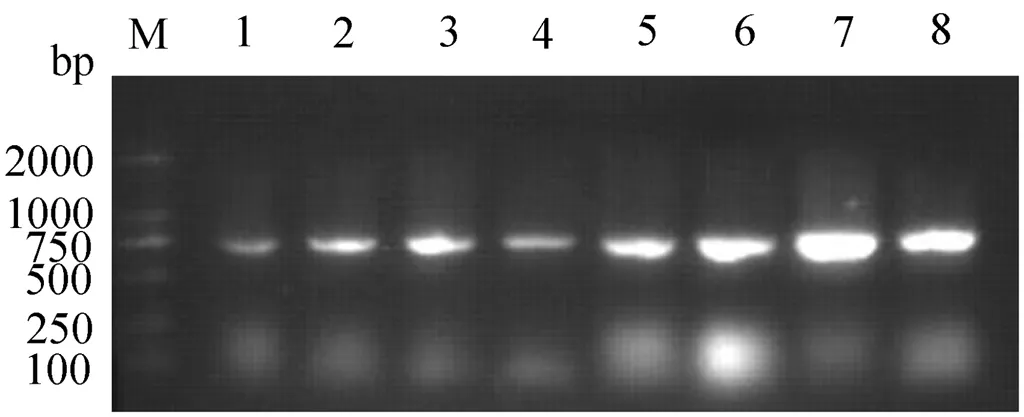
图1 对菌落PCR的琼脂糖凝胶电泳
对转化成功的菌落进行基因组提取,对其转化片段的左臂和右臂进行PCR验证,用1%琼脂糖凝胶电泳观察结果,见图2,得到与预期片段(左臂为700 bp,右臂为896 bp,阴性对照均无条带)相符的条带.泳道1、3、5、7 显示了左臂验证条带,泳道2、4、6、8为左臂验证阴性对照; 泳道9、11、13、15显示了右臂验证条带,泳道10、12、14、16为右臂验证阴性对照.
PCR扩增含有突变位点的HHT1基因片段之后,用1%琼脂糖凝胶电泳观察结果,得到与预期片段(399 bp)大小相符的单一扩增条带(图3).
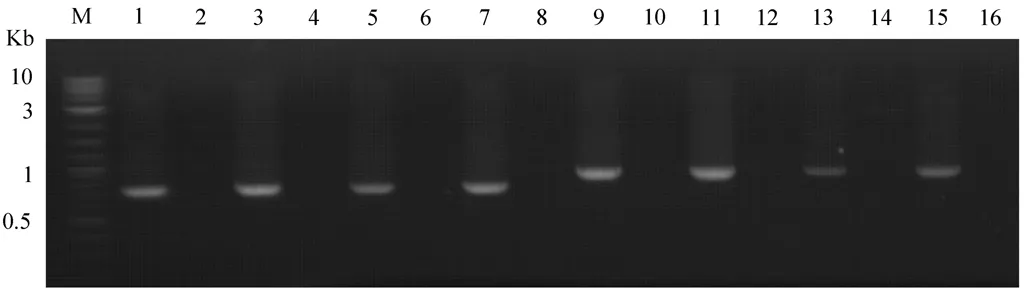
图2 对基因组PCR的琼脂糖凝胶电泳
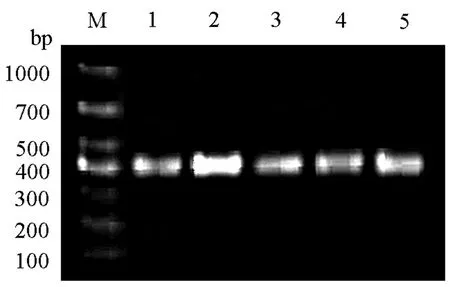
图3 含有突变位点的HHT1基因片段的琼脂糖凝胶电泳
苏州金唯智生物科技有限公司将该序列扩增产物回收纯化后进行测序.测序结果表明,H3基因中编码第14位赖氨酸的碱基(AAG)突变为编码丙氨酸的碱基(GCT).构建的酿酒酵母H3K14位点突变碱基序列与预期相符.
2.2 Western Blot检测结果
图4为酿酒酵母对照菌株BY4741和变体菌株BY4741-H3A14的总蛋白.结果显示两种菌株在组蛋白H3(分子量15.38 kDa)对应位置约15KDa处四个泳道均有明显蛋白印迹.
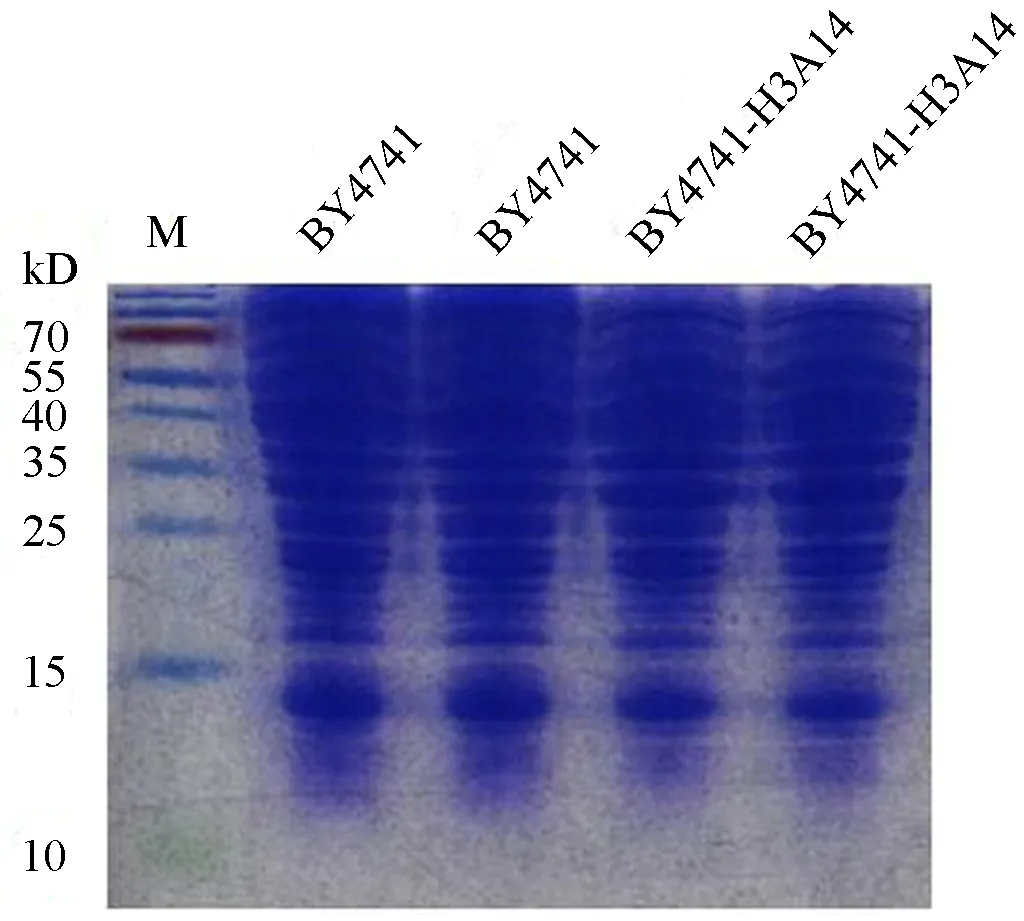
图4 酿酒酵母总蛋白的聚丙烯酰胺凝胶电泳
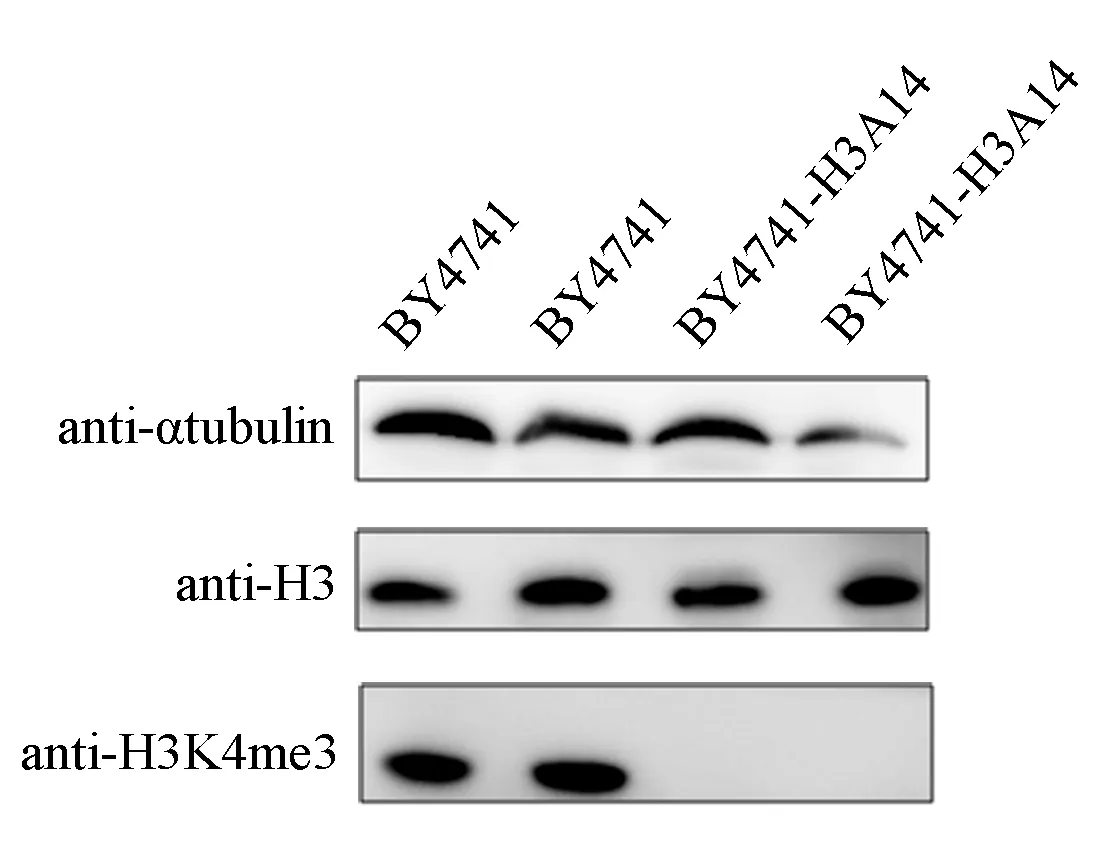
图5 对照菌株酿酒酵母BY4741和变体菌株BY4741-H3A14的αtubulin、H3和H3K4me3修饰的Western blot检测结果Fig. 5 Detection results of αtubulin, H3 and H3K4me3 byWestern blotfor control strains S. cerevisiae BY4741 and mutant strains BY4741-H3K14A
为了避免Western Blot实验结果出现假阳性,进行了内参αtubulin和H3抗体检测.图5为对照菌株酿酒酵母BY4741和变体菌株BY4741-H3A14的αtubulin、H3和H3K4me3修饰的Western blot检测结果.在酿酒酵母BY4741和突变菌株BY4741-H3A14均能检测到αtubulin和组蛋白H3的表达,而对于H3K4me3修饰的检测结果却刚好相反,BY4741对照菌株含有H3K4me3修饰,而变体菌株BY4741-H3A14中未检测到该修饰.结果表明酿酒酵母H3K14Ac确实能够影响H3K4me3,它们之间存在因果关联关系.
3 结论
通过构建酵母组蛋白氨基酸变体验证了网络显示的两种修饰之间的因果关联关系.这一研究工作也为之后验证网络显示的其他修饰之间的因果关系提供了有价值的参考.同时,之前构建的修饰关系网络也为研究修饰之间的因果关系提供了线索,使得相关的实验研究目标明确.此类研究使得对于组蛋白密码产生了比较深刻的认识.哪些组蛋白修饰之间的因果关联关系具有与氨基酸密码子类似的普适性,是进一步比较关注的问题.
