硅藻土对腐殖酸的吸附动力学研究
2016-08-09邓建绵
邓建绵,米 晓,赵 艳
(华北水利水电大学 环境与市政工程学院,河南 郑州 450011)
0 引言
水体中的腐殖酸会使水体散发臭味,促进水体中微生物的增值,增加饮用水消毒用氯量及饮用水中消毒副产物含量,危害居民身体健康.目前,去除水中腐殖酸的技术主要有吸附[1-2]、絮凝沉淀[3-4]、氧化还原[5-6]、膜分离技术[7-8]等.硅藻土及改性硅藻土是常用的吸附剂,可用于吸附去除水体中的重金属[9]、有机物[10]等污染物质.曹亚丽[11]利用聚二甲基二烯丙基氯化铵作为改性剂, 对硅藻土进行有机改性, 并用有机改性硅藻土吸附去除水中腐殖酸.当pH =6.0.改性硅藻土投加量为0.4 g/L,吸附120 min 时, 对腐殖酸吸附去除率达83.15%.改性硅藻土对腐殖酸的吸附行为符合Freundlich 等温方程式.本实验以硅藻土为吸附剂,对硅藻土吸附腐殖酸的动力学与热力学进行研究,为硅藻土吸附去除水体中腐殖酸提供借鉴.
1 实验部分
1.1 材料与试剂
40目纯净硅藻土,吉林省临江北峰硅藻土有限公司.HA-Na(Simon)、NaOH、HCl、NaHCO2、Na2SO4、Na2HPO4、Na2SiO3、NaNO3均为分析纯.
1.2 实验方法
取50 mL浓度为20 mg/L的腐殖酸溶液加入100 mL锥形瓶中,加入硅藻土10 mg.在恒温摇床中于150 r/min转速下振荡24 h,达到吸附平衡,取样经0.45 μm滤膜过滤后测定.吸附动力学实验在pH= 5.0、7.0和9.0的条件下进行[11].吸附等温线实验在15 ℃、25 ℃和35 ℃下进行.溶液的pH值用0.1 mol/L的HCl或NaOH溶液进行调节.
1.3 分析方法
腐殖酸的浓度采用紫外分光光度法进行测定.在254 nm波长处测定溶液吸光度,分析溶液中腐殖酸的浓度.硅藻土对腐殖酸的去除率(R)和单位质量硅藻土的吸附量(qe)分别利用式(1)和式(2)计算.
(1)
(2)
式中:C0为吸附前腐殖酸浓度,mg/L;C为吸附后腐殖酸浓度,mg/L;V为溶液体积,mL;m为硅藻土质量,g.
2 结果与讨论
2.1 吸附动力学研究
本文采用准一级动力学模型、准二级动力学模型、Elovich模型和双常数模型对硅藻土吸附腐殖酸进行拟合.
准一级动力学公式见式(3)
qt=qe(1-e-k1t).
(3)
准二级动力学公式见式(4)
(4)
Elovich动力学公式见式(5)
qt=a+klnt.
(5)
双常数动力学公式见式(6)
qt=e(a+klnt).
(6)
将准一级动力学模型和准二级动力学模型分别变换为式(7和式(8).
准一级动力学公式
ln(qe-qt)=lnqe-k1t.
(7)
准二级动力学公式见式(8)
(8)
式中:qe为溶液平衡吸附量,mg/g;qt为溶液t时吸附量,mg/g;k1和k2分别为准一级和准二级动力学模型的吸附常量,min-1,与吸附反应的活化能有关;a为常数;k为吸附常数.调整溶液pH=5、7、9时,按式(5)、(6)、(7)和(8)进行动力学拟合,结果如图1、图2、图3和图4所示.
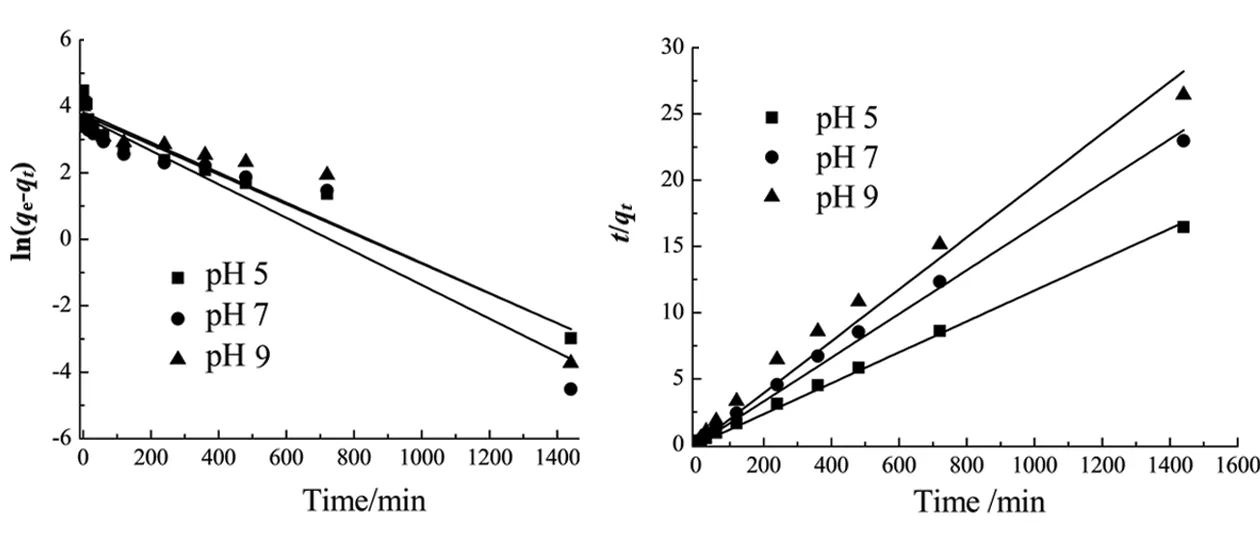
图1 硅藻土吸附HA线性准一级动力学(1)和线性准二级动力学拟合(2)Fig. 1 Linear pseudo first order kinetics fitting(1) and the linear pseudo second order kinetics fitting(2) for HA adsorption onto diatomite

图2 硅藻土吸附HA的非线性准一级动力学、非线性准二级动力学以及Elovich动力学、双常数动力学拟合(pH=5)Fig. 2 Nonlinear pseudo first order kinetics fitting(1) and the nonlinear pseudo second order kinetics fitting(2) and the Elovich kinetics fitting and the double constant kinetics fitting for HA adsorption onto diatomite (pH=5)

图3 硅藻土吸附HA的非线性准一级动力学、非线性准二级动力学以及Elovich动力学、双常数动力学拟合(pH=7)Fig. 3 Nonlinear pseudo first order kinetics fitting(1) and the nonlinear pseudo second order kinetics fitting(2) and the Elovich kinetics fitting and the double constant kinetics f fitting or HA adsorption onto diatomite (pH=7)

图4 硅藻土吸附HA的非线性准一级动力学、非线性准二级动力学以及Elovich动力学、双常数动力学拟合(pH=9)Fig. 4 Kinetic fitting of nonlinear pseudo first order kinetics(1) and the nonlinear pseudo second order kinetics(2) and the Elovich kinetics and the double constant for HA adsorption onto diatomite (pH=9)
在pH=5、7、9时,线性准一级动力学、线性准二级动力学、非线性一级动力学、非线性二级动力学模拟的R2及其他拟合参数如表1~表3所示.分析结果表明,准二级动力模型能较好地描述腐殖酸在硅藻土上的吸附行为,说明该吸附过程为化学吸附[12-13].同时,Elovich模型、双常数动力学模型也能较准确描述腐殖酸在硅藻土上的吸附,也可用来描述该吸附过程.而由线性准二级动力学模型计算出的平衡吸附量在pH=5、7、9时分别为83.8、55.3、41.3 mg/g,与实验值接近.

表1 硅藻土吸附HA的线性动力学模型拟合参数Tab. 1 Fitting parameters of the linear kinetic model of HA adsorption onto diatomite

表3 硅藻土吸附HA的Elovich、Double Constant动力学模型拟合参数Tab. 3 Fitting parameters of the kinetic model of Elovich and double Constant of HA adsorption onto diatomite
2.2 吸附热力学
用腐殖酸配制浓度为5~100 mg/L的溶液,维持平衡时溶液pH=7.0±0.1,调节反应温度分别为15 ℃、25 ℃、35 ℃时,测定溶液的吸附平衡浓度,并建立吸附等温线模型,绘制吸附等温线.
吸附等温线是用来分析吸附剂吸附能力和工程设计的基础.本文主要采用Langmuir、Freundlich、Temkin和Koble-Corrigan热力学方程进行拟合.所用方程如下:
Langmuir方程
(9)
Freundlich方程
qe=kFCe1/n.
(10)
Temkin 方程
qe=A+BlnCe.
(11)
Koble-Corrigan方程
qe=A+BlnCe.
(12)
式中:qmax为最大吸附容量,mg/g;qe为平衡吸附量,mg/g;KL为Langmuir吸附常数;KF为Freundlich平衡常数;Ce为腐殖酸溶液的平衡浓度,mg/L;n、A、B为等温常数.拟合结果如图5、图6和图7所示.
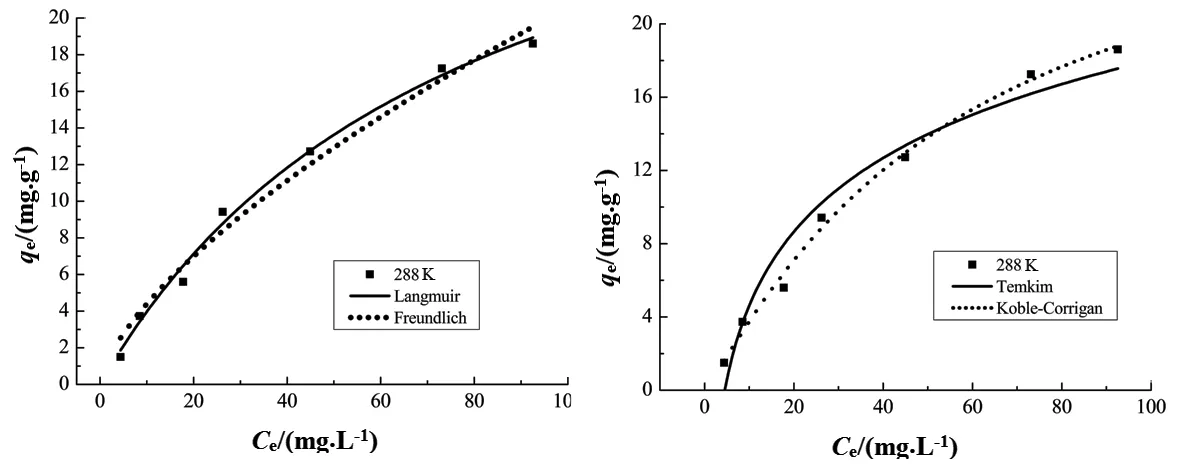
图5 硅藻土对HA的吸附等温线(15 ℃)Fig. 5 The isotherms fitting of HA adsorption onto diatomite (15 ℃)

图6 硅藻土对HA的吸附等温线(25 ℃)Fig. 6 The isotherms fitting of HA adsorption onto diatomite (25 ℃)

图7 HA在硅藻土上的吸附等温线(35 ℃)Fig. 7 The isotherms of HA adsorption onto diatomite (35 ℃)
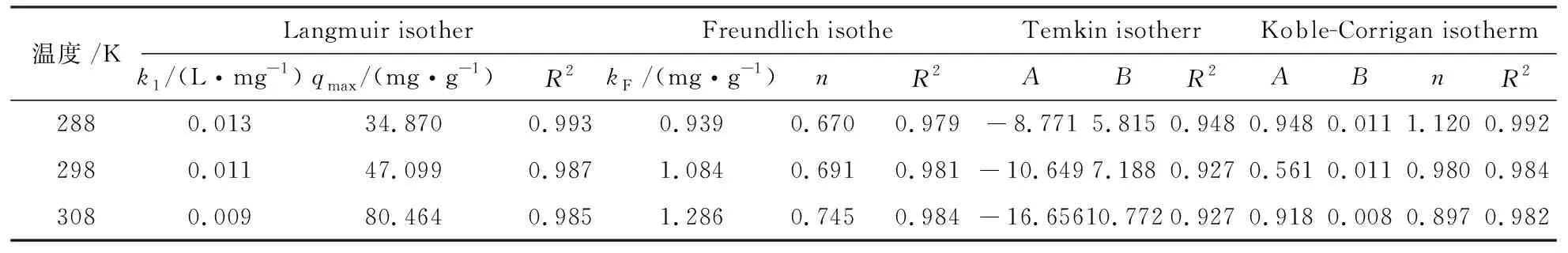
温度/KLangmuir isotherFreundlich isotheTemkin isotherrKoble-Corrigan isothermk1/(L·mg-1)qmax/(mg·g-1)R2kF /(mg·g-1)nR2ABR2ABnR22880.01334.8700.9930.9390.6700.979-8.7715.8150.9480.9480.0111.1200.9922980.01147.0990.9871.0840.6910.981-10.6497.1880.9270.5610.0110.9800.9843080.00980.4640.9851.2860.7450.984-16.65610.7720.9270.9180.0080.8970.982
四种模型拟合等温线参数见表4.由表4可知,与Freundich方程相比,Langmuir方程更适合描述硅藻土对腐殖酸的吸附行为.从Langmuir方程拟合结果可以看出,当吸附温度分别为35 ℃、25 ℃、15 ℃,相应吸附量分别为80.5、47.1、34.9 mg/g,与实验值较接近.同时,Temkin方程和Koble-Corrigan方程拟合度也较高,也可用来描述硅藻土对腐殖酸的吸附过程.
反应的热力学函数采用Gibbs方程进行计算.
Gibbs方程
ΔG0=-RTlnK.
(13)
Van’t Hoff等温式
ΔG0=ΔH0-TΔS0.
(14)
由式(13)和式(14)可得
(15)
式中:△G0为标准吸附吉布斯自由能,J·mol-1;△S0为标准吸附熵变,J·mol-1·K-1;△H0为标准吸附焓变,J·mol-1;R为气体摩尔常数,8.314 J·mol-1·K-1;T为热力学温度,K;K为平衡吸附常数.
在不同温度和不同qe条件下,以qe为横坐标,ln(qe/Ce)为纵坐标,按式(9)绘制曲线,如图8所示,得到相应的K值,由公式(15)得到△G0.通过△G0对T作图得到一条直线,由直线截距和斜率分别求得△H0和△S0,结果如图8所示.
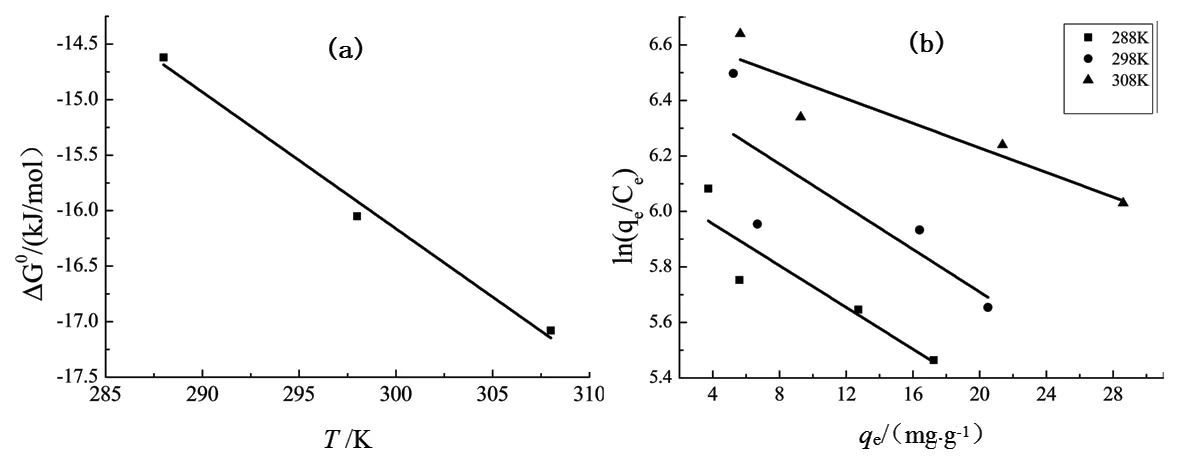
图8 吉布斯自由能变(热力学计算)
从表5中可以看出,ΔH0为正值,表明该吸附反应为吸热[14]反应,升高温度有利于吸附反应的进行,这与实验的平衡吸附量结果相一致.ΔG0为负值,表明该吸附反应是自发反应[15],ΔG0随温度的升高而减小,表明高温有利于该吸附反应的进行.

表5 不同温度下硅藻土吸附HA的热力学参数Tab. 5 Thermodynamic parameters of HA adsorption onto diatomite under different temperatures
3 结论
结果表明,线性准二级动力学模型更适合用于硅藻土对腐殖酸的吸附动力学分析,在pH=5、7、9时,计算出的平衡吸附量分别为83.8、55.3、41.3 mg/g,与实验值接近,可用于指导工程实践.Langmuir方程更加适合用于描述硅藻土对腐殖酸的吸附行为,与曹亚丽[12]采用改性硅藻土分析结果不同.根据Langmuir方程计算吸附量分别为80.5 、47.1、34.9 mg/g,与实验值较接近.由于该吸附属于吸热反应,可通过适宜提高温度加快吸附反应,降低工程规模与投资.
